СЕКРЕЦИЯ
Исходные концентрации
Концентрация инсулина в плазме периферической венозной или артериальной крови здоровых лиц после ночного голодания составляет обычно 10—20 мкЕД/мл (0,4—0,8 нг/мл). Как уже отмечалось, в процессе секреции инсулина освобождаются эквимолярные количества С-пептида, концентрация которого натощак составляет 0,9—3,5 нг/мл. Относительно большие количества С-пептида по сравнению с инсулином объясняются более медленным метаболическим клиренсом этого вещества [30]. Поскольку секрет островков поджелудочной железы поступает в воротную веду и поскольку печень элиминирует 50—60% поступающего в нее инсулина, концентрация его натощак в крови воротной вены в 3 раза выше, чем в периферической крови. При резких «всплесках» секреции (например, в ответ на введение глюкозы или аминокислот) градиент уровней инсулина воротная вена — периферическая кровь может повышаться до 10:1. Этот градиент концентраций инсулина может отчасти объяснять тот факт, что небольшой прирост секреции инсулина изменяет метаболизм глюкозы в печени без изменения периферической утилизации глюкозы [33].
Хотя в плазме периферической крови и можно обнаружить проинсулин, обычно на его долю приходится менее 15% от общей иммунореактивности инсулина в циркуляции. Недавно описан бессимптомный генетический дефект — семейная гиперпроинсулинемия с аутосомно-доминантной наследуемостью, при которой на долю проинсулина приходится 65—90% от общей иммунореактивности инсулина в плазме [34]. Отражает этот дефект нарушение превращения проинсулина в инсулин или нарушение биосинтеза проинсулина — неизвестно. Повышение уровня проинсулина в плазме наблюдается и у больных с инсулиномами (см. следующую главу), а также в сочетании с гипокалиемией. У больных диабетом повышение уровня проинсулина встречается довольно редко и не может объяснить нарушения толерантности к глюкозе, наблюдаемое при различных гиперинсулинемических состояниях (например, при ожирении, беременности, гиперкортицизме).
У получающих инсулин больных диабетом присутствие антител препятствует определению инсулина в крови обычными радиоиммунологическими методами. В таких условиях можно оценивать остаточный резерв секреции инсулина с помощью определения С-пептида. Кроме того, у больных с гипогликемией и гиперинсулинемией определение С-пептида может дать ответ на вопрос, имеет ли циркулирующий инсулин эндогенное происхождение (повышение уровня С-пептида) или симптомы связаны с тайным введением инсулина (снижение уровня С-пептида).
Скорость секреции инсулина, необходимая для поддержания нормальной исходной концентрации гормона, колеблется от 0,25 до 1,5 ЕД/ч. Роль исходной секреции (которая в норме происходит в интервалах между приемами пищи) подчеркивается результатами недавно проведенных исследований, свидетельствующими о том, что программированные системы инфузии инсулина,. которые обеспечивают как исходный уровень гормона, так и его повышение перед едой, гораздо более эффективны в отношении; нормализации гликемии при ювенильном диабете, чем только введение повышенных доз инсулина перед едой [35].
Углеводы
Среди различных факторов, способных стимулировать секрецию инсулина, наиболее важным с физиологической точки зрения является глюкоза. Это находит свое отражение в том, что ежемоментные колебания уровня инсулина в плазме повторяют колебания содержания глюкозы в ней (рис. 10—13). Однако точный механизм, с помощью которого глюкоза действует на b-клетки, вызывая высвобождение инсулина, не совсем ясен. Предложены. две альтернативные теории, одна из которых исходит из роли метаболизма глюкозы в островковых клетках, а другая—из взаимодействия молекулы глюкозы с мембранным рецептором — «глюкорецептором». В пользу метаболической теории свидетельствуют следующие наблюдения: 1) метаболизируемые сахара (гексозы или триозы) являются более мощными стимуляторами секреции инсулина, чем неметаболизируемые углеводы (например, манноза); 2) глюкоза увеличивает концентрацию интермедиатов гликолиза в островковых клетках; 3) вещества, угнетающие метаболизм глюкозы (манногептулоза и 2-дезоксиглюкоза), препятствуют секреции инсулина.
С другой стороны, имеются наблюдения, результаты которых свидетельствуют в пользу существования механизма распознавания глюкозы за счет активации ею мембранного рецептора (глюкорецептор), вследствие чего «запускается» процесс высвобождения инсулина. Эту гипотезу подтверждают данные о том, что с помощью блокаторов ферментов (йодацетат) высвобождение инсулина можно отделить от метаболического потока глюкозы по гликолитическому пути и что a-аномер глюкозы служит более эффективным стимулом секреции инсулина, чем b-аномер, хотя
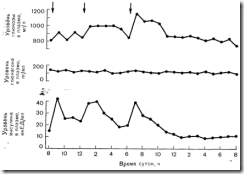
Рис. 10—13. Колебания уровня глюкозы, глюкагона и инсулина в плазме в течение суток у здоровых лиц, потребляющих смешанную пищу. Максимальные размахи уровня глюкозы в плазме за 24 ч обычно не достигают 300 мг/л. Малая степень колебания уровня глюкозы в плазме является следствием обратной связи с секрецией инсулина и повышения секреции инсулина под действием гормонов желудочно-кишечного тракта, выделяющихся в ответ на прием пищи. В отличие от уровня инсулина уровень глюкагона при потреблении смешанной пищи совершенно не меняется (по Tasaka Y. et al., Ногш. Metab. Res., 1975, 7, 205, с модификациями). Стрелками показано время приема пищи. оба аномера подвергаются, по-видимому, одинаковому метаболизму в островковых клетках. Хотя результаты этих наблюдений указывают на стереоспецифичность действия глюкозы, согласно результатам более поздних исследований, a-аномер служит более подходящим субстратом гликолиза в островковых клетках, чем b-аномер, причем стереоспецифичность играет роль на этапе, катализируемом изомеразой фосфоглюкозы [36]. Кроме того, в позднее проведенных исследованиях с йодацетатом были получены данные, которые на самом деле согласуются с метаболической гипотезой [37]. В механизме, с помощью которого гликолиз стимулирует секрецию инсулина, может принимать участие увеличение в клетке уровня НАД-Н и НАДФ-Н, равно как и концентрации R [38].
В процессе стимуляции секреции инсулина, как и во многих других внутриклеточных процессах, принимает участие цАМФ. Считается, что повышение уровня цАМФ выступает прежде всего в качестве положительного модулятора этапа секреции, чувствительного к глюкозе. Тот факт, что теофиллин (ингибитор фосфодиэстеразы) повышает уровень цАМФ, но очень слабо влияет на секрецию инсулина в отсутствие глюкозы, свидетельствует о том, что само по себе увеличение цАМФ является недостаточным условием для стимуляции секреции инсулина.

Рис. 10—14. Внутриклеточная последовательность стимулирующего эффекта глюкозы на секрецию инсулина b-клеткой. Проникновение глюкозы в b-клетку усиливает гликолиз и повышает уровень цАМФ. Эти сдвиги приводят к увеличению внутриклеточного содержания кальция, «запускающего» выброс инсулина.
Как уже отмечалось, конечным этапом триггерного механизма, с помощью которого глюкоза или другие стимулы приводят к высвобождению инсулина из b-клеток, считается увеличение внутриклеточного уровня кальция. Эти изменения кальциевого баланса определяются тормозящим влиянием глюкозы на выход кальция из клетки и мобилизацией внутриклеточных запасов кальция под влиянием цАМФ. На значение изменений внутриклеточного кальция отчетливо указывают результаты исследований с ионофорами—молекулами, действующими в качестве мембранных переносчиков ионов. В присутствии гетероциклической монокарбоновой кислоты А23187 — специфического ионофора двухвалентных катионов, который транспортирует кальций через биологические мембраны, добавление кальция к b-клеткам приводит к «всплеску» секреции инсулина даже без повышения уровня глюкозы или внутриклеточного уровня цАМФ [39].
Общую цепь событий можно суммировать следующим образом проникновение глюкозы в b-клетку усиливает гликолиз, вследствие чего повышается уровень восстановленных пиридиновых нуклеотидов (НАД-Н и НАДФ-Н) и содержание цАМФ. Эти изменения приводят к накоплению кальция, который «запускает» высвобождение инсулина (рис. 10—14).
Характерной особенностью реакции инсулина на глюкозу является ее двухфазность (рис. 10—15). Начальный быстрый «всплеск» секреции начинается в пределах 1 мин после введения глюкозы, достигает максимума в пределах 2 мин и снижается в последующие 3—5 мин. Вторая фаза, характеризующаяся более постепенным приростом уровня инсулина, начинается спустя 5— 10 мин после начала инфузии глюкозы и продолжается в течение

Рис. 10—15. Концентрации иммунореактивного инсулина в плазме крови из воротной и периферической вены до внутривенного введения глюкозы и после него. Натощак концентрация инсулина в плазме воротной вены (1) в 3 раза превышает его уровень на периферии (2), а сразу же после введения глюкозы может превышать периферический уровень в 10 раз (7 наблюдений). Изменения концентрации инсулина в плазме воротной вены указывают на двухфазность реакции b-клеток, в ходе которой резкое увеличение выброса инсулина сменяется более медленным и длительным приростом его (по Blackard W. G., Nelson N. С., Diabetes, 1970, 19, 302).
последующего часа. В опытах на перфузируемой поджелудочной железе ингибитор синтеза белка пуромицин ослабляет выраженность второй фазы, но не влияет на раннюю фазу секреции инсулина. Эти данные позволили предположить, что в b-клетке содержатся два пула инсулина [40]. Остро высвобождаемый пул, содержащий ранее синтезированный инсулин, быстро опустошается в 1-ю фазу секреции. Второй хронический высвобождаемый пул, содержащий вновь синтезируемый инсулин и небольшие количества проинсулина, пополняющие запасы преформированного инсулина, постепенно опустошается во 2-ю фазу. Глюкоза стимулирует синтез инсулина на посттранскрипционном уровне независимо от синтеза новых молекул мРНК [41].


