ГЛЮКАГОН
ХИМИЯ И БИОСИНТЕЗ
Глюкагон представляет собой одноцепочечный полипептид, насчитывающий 29 аминокислотных остатков с молекулярной массой 3485. Недавно проведенные исследования взаимоотношений между структурой и активностью показали, что остатки, расположенные на аминоконце молекулы, необходимы для связывания и клеточного действия гормона. Однако высокое сродство к своему рецептору, позволяющее гормону действовать в физиологических концентрациях, придает глюкагону карбоксильный конец молекулы. В отличие от инсулина глюкагон сохраняет одну и ту же аминокислотную последовательность у всех изученных видов млекопитающих.
Местом биосинтеза глюкагона являются a-клетки островков, Лангерганса. Иммунофлуоресцентные исследования показывают, что эти клетки располагаются по внешнему краю островков и составляют 75% от общей популяции островковых клеток [80]. В самих островковых клетках синтез глюкагона проходит вначале стадию образования более крупного предшественника (проглюкагона), молекулярная масса которого определена в 9000 и который лишен гликогенолитической активности. После расщепления этой молекулы до глюкагона содержимое секреторных гранул в a-клетке выделяется в процессе экзоцитоза (эмиоцитоза), который аналогичен таковому для инсулина.
У лиц с удаленной поджелудочной железой глюкагон исчезает из крови [81]. В отличие от этого у депанкреатизированных собак, не получающих инсулин, в крови сохраняется глюкагон, что объясняется присутствием секретирующих глюкагон клеток в желудке. Внепанкреатическую продукцию истинного глюкагона у депанкреатизированных собак не следует путать с продукцией желудочно-кишечной глюкагоноподобной иммунореактивности (ГПИ). Это вещество обнаруживает перекрестную иммунологическую реакцию с глюкагоном поджелудочной железы и продуцируется клетками, расположенными в тонком кишечнике. Однако оно лишено гипергликемической активности, которой обладают как глюкагон поджелудочной железы, так и внепанкреатический глюкагон, продуцируемый у собак после панкреатэктомии. Структура и функция ГПИ точно не известны.
ЦИРКУЛИРУЮЩИЙ ГЛЮКАГОН
Успехи в изучении физиологии глюкагона во многом были обусловлены разработкой Unger радиоиммунологического метода его определения в плазме. Хотя этот метод специфичен для глюкагона панкреатического происхождения, но, как показало применение гель-фильтрации, только 40—50% от общей глюкагоновой иммунореактивности, определяемой с помощью большинства соот- ветствующих методов, приходится на долю биологически активного гормона (с молекулярной массой 3485). Большая часть остальной глюкагоновой иммунореактивности в плазме здорового человека элюируется в пустом объеме (с белками плазмы), и ее молекулярная масса определена в 160000. Эта фракция получила название «большой глюкагон плазмы» (БГП) и, по всей вероятности, лишена биологической активности. В плазме здоровых лиц идентифицированы небольшие количества и двух дополнительных фракций с молекулярной массой примерно 9000 и 8000. Биологическое значение этих фракций еще предстоит выяснить, хотя считают, что вещество с молекулярной массой 9000 представляет собой проглюкагон. Эта фракция увеличивается в количественном отношении у больных с хронической почечной недостаточностью, по-видимому, вследствие нарушения почечных процессов элиминации [82].
Хотя исходный уровень иммунореактивного глюкагона (75— 150 пг/мл) представлен как биологически активным, так и неактивными компонентами, описанными выше, изменения иммунореактивности в крови, появляющиеся в ответ на физиологическую-стимуляцию (например, аминокислотами) или подавление (например, глюкозой), как правило, отражают изменения в содержании биологически активного компонента иммунореактивности. Таким образом, изменения уровня глюкагона в плазме в ответ на физиологические стимуляторы или ингибиторы, судя по результатам определения доступными в настоящее время методами, вероятно, являются показательными в отношении изменений содержания истинного панкреатического глюкагона. Семейная гиперглюкагонемия представляет собой редкий бессимптомный аутосомно-доминантный дефект, при котором общая иммунореактивность глюкагона в плазме повышена в 2–10 раз, но 85% ее приходится на долю биологически неактивного компонента с высокой молекулярной массой.
СЕКРЕЦИЯ
У здоровых лиц, потребляющих смешанную пищу, секреция глюкагона на протяжении дня колеблется в очень узких пределах (см. рис. 10—13). Таким образом, относительно постоянный уровень глюкагона отличается от уровня инсулина, претерпевающего отчетливые колебания при приеме смешанной пищи или даже при еще меньших изменениях (100—200 мг/л) содержания глюкозы в крови (см. рис. 10—13). Основными физиологическими стимулами секреции глюкагона у здорового человека служат белковая ппища, инфузия аминокислот или физическая нагрузка, особенно, если она велика или длительна. Увеличение секреции глюкагона наблюдали также при острой гипогликемии, после инфузии больших доз адреналина и при гиперкортицизме [84]. Гиперглюкагонемия, сопровождающая голодание, обусловлена в основном снижением катаболизма гормона, а не повышением erо секреции (см. далее).
Подавление секреции глюкагона происходит после приема или инфузии глюкозы. Снижающий уровень глюкагона в крови эффект глюкозы может зависеть от опосредованного инсулином ее поглощения a-клетками. У больных диабетом глюкоза не угнетает секрецию глюкагона, но на фоне инсулинотерапии этот эффект восстанавливается [85]. Как уже отмечалось, мощным ингибитором секреции глюкагона, а также инсулина является соматостатин. Действительно, тормозящее действие соматостатина на функцию a-клеток явилось основой его применения в качестве дополнительного средства лечения инсулинозависимого диабета [52].
ДЕЙСТВИЕ
Хотя глюкагон был обнаружен почти 60 лет назад в качестве гипергликемизирующего фактора, присутствующего в неочищенных препаратах инсулина, его физиологическая роль выяснилась лишь недавно. Ранние исследования наталкивались на невозможность воспроизведения чистого глюкагонодефицитного состояния без одновременного создания дефицита инсулина, а также на отсутствие данных об уровне в крови и скорости секреции глюкагона. Разработка радиоиммунологических методов и открытие соматостатина способствовали выяснению роли глюкагона в гомеостазе глюкозы.
Физиологические приросты содержания глюкагона вызывают повышение уровня глюкозы в крови за счет стимуляции гликогенолиза и глюконеогенеза в печени (рис. 10—22). Наоборот, снижение концентрации глюкагона ниже исходного уровня приводит к снижению в печени продукции глюкозы [86]. Если прирост уровня глюкагона сопровождается небольшим (на 50—150%) приростом уровня инсулина в крови, продукция глюкозы в печени остается неизменной. Последний феномен определяет значение бигормональной реакции (повышение секреции как глюкагона, так и инсулина) на прием белковой пищи (рис. 10—23). Реакция инсулина, вызываемая белковой пищей, обеспечивает поглощение и утилизацию клетками содержащихся в ней аминокислот. Однако само по себе повышение уровня инсулина должно было бы снизить выход глюкозы из печени и тем самым вызвать гипогликемию. Одновременный же прирост уровня глюкагона препятствует проявлению такого эффекта инсулина и обеспечивает сохранение продукции глюкозы на стабильном уровне (см. рис. 10—23). Поскольку при приеме смешанной пищи не изменяется содержание глюкагона (см. рис. 10—13), можно предположить, что глюкагон в ходе эволюции приобрел роль регулятора гликемии главным образом при потреблении мяса.
В отличие от инсулина, влияние которого на различные ткани-мишени продолжается до тех пор, пока не возникнет гипогликемия, глюкагон оказывает лишь кратковременное действие на печеночную продукцию глюкозы, продолжающееся всего 30—

Рис. 10—22. Стимулирующее влияние глюкагона на продукцию глюкозы органами брюшной полости (печенью) у здорового человека. Физиологическая гиперглюкагонемия вызывает быстрое повышение печеночной продукции глюкозы. Однако этот эффект является кратковременным, сохраняясь в течение менее 45 мин. Стимулирующее действие глюкагона на продукцию глюкозы, таким образом, определяется не абсолютной его концентрацией, а изменениями последней (по Felig P. et al., Diabetes, 1976, 25, 1901). 1 — глюкоза: 2 — инсулин.
60 мин (см. рис. 10—22) [84]. Однако, если по достижении данного уровня глюкагона в плазме произойдет его дальнейшее повышение или снижение, то соответственно повысится или снизится продукция глюкозы. Таким образом, глюкагон влияет на метаболизм глюкозы в печени путем изменения своего уровня, а не абсолютной концентрацией. Следовательно, печень сохраняет чувствительность к изменениям уровня глюкагона в крови, но эффект любого данного изменения этого уровня оказывается кратковременным, продолжаясь обычно 60 мин или менее [87].
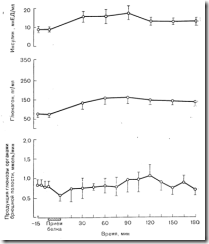
Рис. 10—23. Влияние приема белковой пищи на уровень инсулина и глюкагона в плазме, а также на спланхническую (печеночную) продукцию глюкозы у здорового человека. Повышение содержания глюкагона, вызываемое белковой пищей, необходимо для поглощения и анаболической утилизации содержащихся в ней аминокислот (см. рис. 19—9) (по данным Wharen J., Felig P., Hagenfeldt L. J., Clin. Invest., 1976, 58, 761).
Учитывая противоположность эффектов инсулина и глюкагона на печень, а также тот факт, что глюкоза подавляет секрецию глюкагона, но стимулирует секрецию инсулина, Unger и соавт. постулировали, что общий углеводный гомеостаз управляется не концентрацией каждого из этих гормонов порознь, а молярным соотношением инсулин/глюкагон (И/Г) [88, 89]. Применимость датой гипотезы к целому организму была поставлена под серьезное сомнение Sherwin и соавт., проводившими исследования с инфузией физиологических доз глюкагона. Эти исследования показали, что повышение глюкагона в плазме до уровня 300— 400 пг/мл (сопоставимого с наблюдающимся при различных гиперглюкагонемических состояниях) не изменяет толерантности к глюкозе у здоровых лиц. Таким образом, несмотря на выраженное уменьшение соотношения И/Г (с 34:1 до 6:1), изменений толерантности к глюкозе не появляется [84]. Это означает, что глюкагон может нарушать глюкозотолерантность только либо в условиях абсолютной недостаточности инсулина, либо при введении его в фармакологических дозах, либо, наконец, при глюкагонпродуцирующей опухоли (глюкагонома). Кроме того, хотя введение глюкозы в норме подавляет секрецию глюкагона, но пока секреция инсулина остается в пределах нормы, сохранение нормальной скорости исчезновения глюкозы из крови не требует гипоглюкагонемии [90, 91].
Помимо влияния на углеводный обмен, глюкагон участвует и в регуляции кетогенеза. В печени крыс, получавших физиологические дозы глюкагона, повышается продукция кетоновых тел из жирокислотных предшественников [15]. In vivo гиперкетонемия может встречаться и при отсутствии глюкагона, как, например, у больных с удаленной поджелудочной железой [81]. Однако у больных инсулинодефицитным диабетом гиперглюкагонемия еще больше увеличивает кетогенную способность печени (см. рис. 10—8).
Эффекты глюкагона, заключающиеся в повышении уровня сахара в крови и кетоза, целиком определяются его действием на печень. При физиологических приростах уровня глюкагона не изменяются ни периферическое (внепеченочное) поглощение глюкозы, ни липолиз. Первый этап действия глюкагона на печень это — его связывание с рецепторами клеточной мембраны. Пока не ясно, однако, является ли рецепторный уровень существенным для модуляции действия этого гормона.
Вторым медиатором эффекта глюкагона служит повышение содержания цАМФ. Это происходит путем стимуляции гормончувствительной аденилатциклазы в плазматической мембране. Повышение уровня цАМФ «запускает» реакцию фосфорилирования, приводящего к повышению активности ключевого фермента гликогенолиза — фосфорилазы и одновременному торможению гликогенсинтетазы (см. рис. 10—3). Что касается глюконеогенеза, то чувствительный к глюкагону этап этого процесса расположен на уровне превращения пирувата в фосфоенолпируват (см. рис. 10—4).
Введение глюкагона снижает уровень калия и кальция в сыворотке крови, секрецию соляной кислоты и ферментов поджелудочной железы, повышает секрецию гормона роста и увеличивает сократимость миокарда. Однако все эти эффекты требуют фармакологических доз гормона.
РАЗРУШЕНИЕ
В отличие от инсулина глюкагон разрушается в основном не в печени, а в почках. Вследствие этого уровень глюкагона в плазме при уремии повышается, несмотря на отсутствие его гиперсекреции [84]. Элиминация глюкагона почками обычно превышает его фильтрацию, что указывает на роль перитубулярного поглощения в его почечном клиренсе. Снижение распада глюкагона является также основной причиной гиперглюкагонемии, наблюдаемой при кратковременном (3-дневном) голодании [84]. Хотя гиперглюкагонемия наблюдалась и при циррозе печени, особенно сопровождающемся в воротной системе гипертензией, главной причиной повышения уровня глюкагона в плазме у таких больных является не торможение распада, а повышение его секреции [92].


