Новорожденный ребенок. Естественное вскармливание. Прикорм
Новорожденный ребенок. Доношенный и недоношенный новорожденный
Период новорожденности связан с возрастанием кровотока в сосудах легких и головного мозга, изменением энергетического обмена и терморегуляции. С этого периода начинается энтеральное питание ребенка. В период новоржденности адаптационные механизмы легко нарушаются. В этот период развивается гормональный криз новорожденного, связанный с нарушением взаимодействия эндокринного аппарата матери и ребенка и родовым стрессом. Состояния, отражающие адаптацию ребенка:
1) физиологический катар кожи;
2) физиологическая желтуха;
3) физиологическая потеря веса;
4) мочекислый инфаркт.
В этот период выявляются аномалии развития, фетопатии, наследственные заболевания, болезни, обусловленные антигенной несовместимостью, проявляются родовые повреждения, внутриутробное инфицирование или инфицирование в родах. Могут возникнуть гнойно-септические заболевания, бактериальные и вирусные поражения кишечника и легких. В раннем неонатальном периоде должны быть созданы асептические условия, оптимальная температура окружающей среды, тесный контакт новорожденного с матерью. Поздний неонатальный период охватывает период с 8 по 28-й день. В этот период выявляется задержка нарастания массы тела. Резистентность организма ребенка низкая, полной адаптации еще не произошло.
В этот период также могут выявиться заболевания и состояния, связанные с патологией внутриутробного, интранатального и раннего неонатального периодов. Важным критерием благополучия ребенка следует считать оценку динамики массы тела, нервно-психического развития, состояние сна.
В важнейшую характеристику этого этапа входят интенсивное развитие анализаторов, начало развития координационных движений, образование условных рефлексов, возникновение эмоционального, зрительного и тактильного контакта с матерью.
Преимущества женского молока
Дети, находящиеся на грудном вскармливании, в 3 раза реже болеют кишечными инфекциями, в 1,5 раза – респираторными заболеваниями.
1. В молозиве и в женском молоке содержатся антитела к возбудителям кишечных инфекций – к О-антигену сальмонелл, эшерихий, шигел, энтеровирусам, респираторным инфекциям (таким как грипп, реовирусная инфекция, хламидии, пневмококки), к возбудителям вирусных заболеваний (вирусу полиомиелита, цитомегаловирусам, вирусам эпидемического паротита, герпеса, краснухи), бактериальным инфекциям, вызываемым стафилококками, стрептококками, пневмококками, столбнячному токсину).
2. В молозиве содержатся иммуноглобулины всех классов, особенно YgА (90 %). По мере лактации его содержание уменьшается, но суточное потребление остается высоким (3–4 г). Этот иммуноглобулин выполняет роль первой защиты против инвазии, подавляет адгезию бактерий, нейтрализует вирусы, препятствует аллергизации.
В сутки ребенок получает 100 мг YgМ. Плацента жвачных животных для иммуноглобулинов непроницаема. В молозиве копытных животных содержится преимущественно YgG, а YgА и YgМ – в незначительном количестве.
3. В первые 4 недели лактации в женском молоке присутствует лактоферрин (50—100 мг/л), который активирует фагоцитоз, связывая в кишечнике ионизированное железо, блокирует новообразование бактериальной флоры.
Его содержание – 15–20 % от общего белка молока. В день ребенок получает его около 1 г. В коровьем молоке содержание лактоферрина в 10–15 раз меньше.
4. В молозиве содержатся компоненты комплемента С3 (30 мг в день) и С4 (около 10 мг/день).
5. В женском молоке содержание лизоцима в 100–300 раз выше, чем в коровьем. Его действие заключается в повреждении оболочки бактерий, стимулировании образования амилазы слюны, повышении кислотности желудка.
6. В женском молоке содержится бифидус-фактор, активность которого в 100 раз выше, чем в коровьем. Этот углевод способствует образованию бифидус-флоры, молочной и уксусной кислот, что препятствует росту стафилококка, сальмонелл, шигелл, эшерихий. При естественном вскармливании соотношение в кишечнике лактобактерий и других микроорганизмов составляет 1000: 1, при искусственном – 10: 1.
7. В женском молоке обнаруживается большое количество жизнеспособных клеток – 0,5–1 млн в 1 мл молока, макрофагов – 50–80 %, лимфоцитов – 10–15 % от общего цитоза. Макрофаги молока способны синтезировать интерферон, лактоферрин, лизоцим, компоненты комплемента, они сохраняют свое значение и при кишечных инфекциях. Среди лимфоцитов в женском молоке присутствуют В-лимфоциты, синтезирующие YgА, Т-лимфоциты – хелперы, супрессоры, клетки памяти. Они продуцируют лимфокины. Нейтрофилов в молозиве – 5 х 105 в 1 мл, в дальнейшем происходит некоторое снижение. Они синтезируют пероксидазу, обладают способностью к фагоцитозу.
8. Аллергия к женскому молоку матери неизвестна, в то время как аллергия к молочным смесям у детей 1-го года составляет около 10 %.
9. Женское молоко, особенно молозиво, в отличие от коровьего, содержит гормоны гипофиза, щитовидной железы.
10. В женском молоке содержится около 30 ферментов, участвующих в гидролизе, что обеспечивает высокий уровень усвоения женского молока.
11. В женском молоке в 2 раза меньше белка, но больше углеводов (лактозы), чем в молоке животных. Количество жира одинаковое. Энергетическая ценность за счет белка в женском молоке покрывается за счет белка на 8 %, в коровьем молоке – на 20 %. Доля энергетической ценности углеводов в женском молоке 45 %, в коровьем – около 30 %, жир в обоих случаях покрывает около 50 % его энергетической ценности.
12. Женское молоко имеет меньшую зольность, чем коровье молоко.
13. Соотношение суммы количества сывороточных лактоальбуминов и лактоглобулинов к казеиногену составляет 3: 2. В коровьем молоке это соотношение 3: 2, поэтому адаптированные смеси обогащены сывороточными белками. Казеин при створаживании молока в желудке дает крупные хлопья, а альбумины – мелкие, что увеличивает поверхность для контакта с ферментами гидролиза.
В женском молоке содержатся и протеолитические ферменты.
14. Основным компонентом жира женского молока является триглицериды. У детей в силу низкой активности липазы поджелудочной железы и низкой концентрации конъюгированных желчных солей гидролиз жира затруднен. В грудном молоке содержание пальмитиновой кислоты ниже, что способствует более легкому гидролизу. Пищевая ценность триглицеридов коровьего молока ниже, чем женского, в силу большего образования свободных жирных кислот, которые выводятся. Коэффициент усвоения жира женского молока на 1-й неделе жизни составляет 90 %, коровьего – 60 %, в дальнейшем несколько повышается. Состав жира женского молока также отличен от коровьего. В составе жира женского молока преобладают ненасыщенные эссенциальные жирные кислоты, которые не синтезируются в организме человека, особенно на первом году жизни. В коровьем молоке они содержатся в крайне малом количестве. Высокое содержание эссенциальных жирных кислот имеет большое значение для развития мозга, сетчатой оболочки глаз, становления электрогенеза. В женском молоке по сравнению с коровьем большее содержание фосфатидов, которые обеспечивают замыкание привратника при переходе пищи в двенадцатиперстную кишку, что приводит к равномерной эвакуации из желудка, способствуют синтезу белка. Абсорбционный коэффициент жира женского молока составляет 90 %, для коровьего молока – менее 60 %. Объясняется этому присутствием фермента липазы в женском молоке с его большей активностью в 20–25 раз. Расщепление липазой жира молока обеспечивает активную кислотность в желудке, что способствует регуляции его эвакуаторной функции и более раннему выделению панкреатического сока. Другой причиной лучшей усвояемости жира женского молока является стереохимическое расположение жирных кислот в триглицеридах.
15. Количество молочного сахара (лактозы) в женском молоке больше, чем в коровьем, причем в женском это b-лактоза, которая медленнее усваивается в тонкой кишке и обеспечивает рост грамположительной бактериальной флоры в толстой кишке. преимущественное содержание лактозы среди сахаров женского молока имеет большое биологическое значение. Так, ее моносахарид галактоза непосредственно способствует синтезу галакто-цереброзидов мозга. Преимущественное содержание в женском молоке лактозы (дисахарида), обладающей большей энергетической ценностью, но равной моносахаридам осмолярностью, обеспечивает осмотическое равновесие, оптимальное для усвоения пищевых веществ.
16. Соотношение кальция и фосфора в женском молоке составляет 2–2,5: 1, в коровьем – 1: 1, что сказывается на их всасывании и усвоении. Коэффициент усвоения кальция женского молока составляет 60 %, коровьего – всего 20 %. Оптимальные показатели обмена наблюдаются в случае поступления с женским молоком от 0,03 до 0,05 г кальция и фосфора на 1 кг массы тела, а магния – более 0,006 г/(кг в сутки). Женское молоко богаче коровьего железом, медью, цинком, жирорастворимыми витаминами.
Значение молозива в питании новорожденных первых дней жизни. Характеристика молозива
Молозиво – клейкая густая жидкость желтого или серо-желтого цвета, которая выделяется в конце беременности и в первые 3 дня после родов. При нагревании легко створаживается. В молозиве больше белка, витамина А, каротина, аскорбиновой кислоты, витаминов В12, Е, солей, чем в зрелом молоке. Альбуминовая и глобулиновая фракции превалируют над казеином. Казеин появляется лишь с 4-го дня лактации, его количество постепенно увеличивается. До прикладывания ребенка к груди в молозиве содержание белка наивысшее. Особенно много в молозиве YgА. Жира и молочного сахара в молозиве меньше, чем в зрелом молоке.
Молозиво содержит лейкоциты в стадии жирового перерождения, макрофаги в значительно количестве, лимфоциты. В-лимфоциты молозива синтезируют секреторный YgА, который вместе с фагоцитами формирует местный иммунитет кишечника, когда происходит интенсивное бактериальное заселение организма новорожденного.
Белки молозива всасываются в неизмененном виде в силу идентичности белкам сыворотки ребенка.
Молозиво является промежуточной формой питания между периодами гемотрофного и амниотрофного питания и началом лактотрофного (энтерального) питания. Энергетическая ценность молозива в первый день составляет 1500 ккал/л, во 2-й – 1100 ккал/л, в 3-й – 800 ккал/л.
Естественное вскармливание и техника введения прикорма
Естественное вскармливание – кормление ребенка посредством прикладывания к груди его биологической матери. Оно представляет единственную форму адекватного питания для ребенка после рождения и в течение 1–1,5 лет жизни.
Первое прикладывание новорожденного в родильном доме осуществляется одновременно с процедурой первого контакта. Нормальный доношенный ребенок к моменту рождения имеет все для того, чтобы успешно сосать грудь согласно врожденной программе поиска питания в течение 120–150 мин после рождения: карабканье к груди матери, координированное действие ручек и рта в активном поиске соска с широко открытым ртом, цепкое присасывание к груди и энергичное насыщение до наступления засыпания.
Грудное вскармливание нужно начинать в течение первого часа после рождения, когда оба рефлекса ребенка (поисковый и сосательный) и чувствительность области соска (ареолы) к тактильной стимуляции у матери наивысшие. Кожный контакт после родов должен быть близким – на животе матери после неосложненных родов. При кормлении ребенок должен захватывать сосок и ареолу при энергичном «бодательном» движении головкой, поднимающим грудь, и затем как бы накладывая ее при движении груди вниз, на широко раскрытый рот, с подкладыванием под грудь опущенным, но не высунутым языком. Захват только одного соска без ареолы и последующее его сосание неэффективны и сразу приводят к образованию трещины. Эффективность сосания определяется ритмичным массажем ареолы языком ребенка. Если сосание при первом кожном контакте не состоялось, то держать ребенка у груди более 2 ч нецелесообразно. Неэффективно и прикладывание ребенка или создание кожного контакта через 2–3 ч после родов.
Хороший захват материнского соска ртом ребенка обеспечивает ему достаточную легкость сосания, хорошую рефлекторную регуляцию дыхания, сопряженного с сосанием груди. Наблюдение за кормлением должно быть ориентировано на достижении акта глотания молока, о котором можно судить и по выраженности глотательных движений, и по звуку, сопровождающему глотание.
Прикладывание ребенка к груди должно осуществляться уже с первого дня, по любому знаку голода или дискомфорта со стороны ребенка. Знаками голода могут быть активные сосательные движения губ или вращательные движения головки с различными звуковыми знаками еще до крика. Частота прикладывания может быть 12–20 и более в сутки. Перерыв между дневными кормлениями может и не достигать 2 ч, между ночными быть не более 3–4 ч.
Наиболее закономерные дефицитные состояния при естественном вскармливании.
1. Недостаточность витамина К в первые несколько дней жизни возникает вследствие его низкого содержания в женском молоке или по причине малого потребления молока в этот период. Рекомендуется однократное парентеральное введение витамина К новорожденным.
2. Недостаточность витамина D возникает вследствие его низкого содержания в женском молоке и недостаточной инсоляции. Рекомендации: 200–400 МЕ витамина D в сутки в тот период, когда нет регулярной инсоляции.
3. Необходима коррекция по йоду матери и ребенка в регионах с неоптимальной природной обеспеченностью. Рекомендации: однократное внутримышечное введение йодированного масла.
4. Дефицит железа. Из 1 л материнского молока ребенок получает около 0,25 мг железа, из других пищевых источников – примерно столько же.
При естественном вскармливании дотация железом должна осуществляться лекарственными препаратами железа или через смеси, обогащенные железом, при необходимости введения докормов.
5. Недостаточность фтора требует применения микродоз – 0,25 мг в сутки начиная с 6 месяцев и в дальнейшем.
Введение прикормов зависит от качества женского молока. Оптимальное вскармливание при хорошем питании беременной и кормящей вполне может обеспечить развитие ребенка без прикормов до 1–1,5 лет.
Отсутствие уверенности в оптимальном вскармливании требует введения густого прикорма в интервале от 4 до 6 месяцев.
Блюда прикорма и сроки их назначения при естественном вскармливании
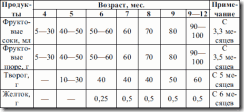
В качестве обучающего прикорма можно использовать 50–20 г тертого яблока или фруктового пюре. При хорошем глотании, хорошей переносимости и отсутствии аллергической реакции его можно давать регулярно на прикорм и перенести на начало кормления. Наиболее подходящий возраст – между 16—24-й неделей жизни, длительность этого прикорма – 2–3 недели (см. табл. 4).
Показанием к введению основного (или энергетически значимого прикорма) является явное проявление неудовлетворенности ребенка получаемом объемом молока при таком состоянии его физиологической зрелости, когда эта неудовлетворенность уже может быть компенсирована именно густым прикормом. У некоторых детей могут формироваться объективные признаки недостаточности питания даже при отсутствии беспокойства и крика: дети становятся апатичными, снижается двигательная активность, происходит замедление темпа весовых прибавок. Условия введения прикорма:
1) возраст более 5–6 месяцев;
2) сложившаяся адаптация к продвижению и глотанию густой пищи при использовании обучающего прикорма;
3) состоявшееся или текущее прорезывание части зубов;
4) уверенное сидение и владение головкой;
5) зрелость функций желудочно-кишечного тракта.
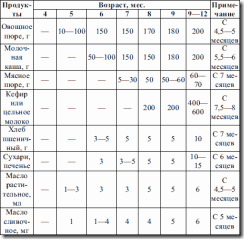
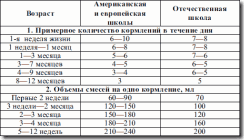
Таблица 4. Примерная схема естественного вскармливания детей 1-го года жизни (Институт питания РАМН, 1997 г.)
Сначала вводится пробная доза прикорма – 1–2 ч. л. и затем при хорошей переносимости происходит быстрое наращивание до 100–150 мл пюре из фруктов или овощей или каши без соли и сахара на основе гречневой крупы или риса.
Этапы расширения прикорма:
1) обучающий прикорм;
2) одно овощное пюре (из картофеля, моркови, капусты) или фруктовое пюре (из бананов, яблок). Лучше использовать продукты, выпущенные производством;
3) каши безглютеновые (из рисовой, кукурузной, гречневой круп);
4) дополнение овощного пюре мясным фаршем, рыбой или мясом птицы из мясных консервов для детского питания, расширение овощей и фруктов, кроме цитрусовых. Срок адаптации – 1–1,5 месяца;
5) каши на пшеничной муке;
6) заменители коровьего молока для детского питания, неадаптированные молочные продукты (молоко, кефир, йогурт, творог), цитрусовые и их соки, яичный желток вкрутую;
7) начало «кусочкового» кормления: печенье, кусочки хлеба, нарезанные фрукты, паровые котлеты.
Общее суточное количества молока (грудного или в смеси) ни в каком периоде первого года жизни не должно быть меньше 600–700 мл, его следует распределять равномерно в течение дня.
К концу первого года жизни вместо смесей группы «follow up» для молочного компонента рациона целесообразно использовать заменители коровьего молока для детей 2—3-го года жизни «Энфамил Юниор» фирмы «Мид Джонсон».
При хорошей переносимости блюд прикорма и аппетите ребенка объем одной порции кормления может к III–IV кварталу первого года составить 200–400 г.
Питание кормящей матери. Гипогалактия
1. Питание и режим кормящей женщины
Желательно, чтобы темпы похудения кормящей женщины были бы гораздо медленнее, чем темпы прироста массы во II–III триместрах беременности. Быстрое похудение может привести к преждевременному прекращению лактации, изменению качественного состава молока. Поддержка и обеспечение грудного вскармливания должны начинаться задолго до родов. Необходимо, чтобы к моменту даже планируемой беременности состояние питания женщины было вполне удовлетворительным. Женщина должна иметь нормальные характеристики индекса Кетле по соотношениям массы тела и роста, не иметь клинических проявлений пищевых дефицитов. Питание беременной женщины должно быть сбалансированным. Для нормальной пищевой обеспеченности могут быть использованы специальные молочные смеси – нутрицевтиков типа «Энфамама» («Мид-Джонсон»), «Думил Мама плюс» (фирма «Данон»), «Фемилак-1» и «Фемилак-2» (фирма «Нутритек»). Особые требования предъявляются к питанию женщин, страдающих желудочно-кишечными заболеваниями. Так, даже при идеальном рационе умеренная степень мальабсорбции жира приведет к недообеспечению плода, а позднее – к дефициту в содержании в молоке матери эссенциальных полиненасыщенных жирных кислот с угрозой нарушения формирования мозговых структур и проводящих путей сердечной мышцы.
2. Формы и степени гипогалактии, ее причины, меры предупреждения
Гипогалактия – сниженное выделение молока. Она наблюдается у 6–8 % родильниц, может быть результатом морфологической или функциональной неполноценностью молочной железы, иногда может быть следствием недостаточности сосательного рефлекса у новорожденного. Гипогалактия бывает первичной и вторичной. Первичная обусловлена гормональными нарушениями (сахарным диабетом, диффузным токсическим зобом). Вторичная может быть вызвана различными заболеваниям матери, кроме эндокринных, осложнениями беременности, родов и послеродового периода, нарушениями режима, нерациональным питанием, физическим и психическим перенапряжением. Пониженной секреции способствуют заболевания молочных желез – маститы, трещины соска. По времени возникновения различают раннюю гипогалактию (в первые 10 дней после родов) и позднюю. В зависимости от дефицита молока по отношению к суточной потребности ребенка выделяют степени:
1) дефицит не более 25 % – I степень;
2) 50 % – II степень;
3) 75 % – III степень;
4) свыше 75 % – IV степень.
У молодых первородящих женщин в первые 3 дня после родов может наблюдаться временная секреторная недостаточность. Рекомендуются лечение основного заболевания, массаж, тепловые обертывания молочных желез, прием апилака, глютаминовой кислоты. Профилактика заключается в устранении причин, вызывающих гипогалактию, создании оптимального режима и диеты беременной и кормящей женщины, организации правильного режима кормления ребенка, полном опорожнении молочной железы после кормления. При неправильной форме сосков нужно применять накладки.
Искусственное вскармливание. Смешанное вскармливание
1. Искусственное и смешанное вскармливание
Искусственное вскармливание – питание из бутылочки смесями – заменителями женского молока, даже при наличии однократного прикладывания к груди или суммарного объема молока матери до 50—100 мл вне зависимости от наличия или отсутствия прикормов.
Искусственное вскармливание афизиологично для ребенка, оно неизбежно генерирует существенные биологические особенности и изменения спектра заболеваемости в последующей жизни старших детей, подростков и взрослых.
Согласно Декларации, принятой на совещании ВОЗ/ЮНИСЕФ в 1979 г., «грудное вскармливание является естественным и идеальным способом питания грудного ребенка.
Поэтому общество несет ответственность за поощрение грудного вскармливания в защиту кормящих матерей от любых воздействий, способных повредить грудному вскармливанию».
Смешанное и искусственное вскармливание должно проводиться только по жизненным показаниям, только при неспособности матери к адекватной лактации и высоком риске хронического голодания ребенка.
У 4—10 % рожениц выявляется неспособность к адекватной лактации.
В таких условиях общество должно создавать банки нативного женского молока.
Но нельзя считать современные заменители женского молока обязательно опасными для жизни.
В настоящее время смешанное и искусственное вскармливание осуществляется на основе адаптированных продуктов – сухих и жидких молочных смесей промышленного производства (см. табл. 5).
Таблица 5. Государственный стандарт России нутриентных смесей СанПиН 2.3.2.560-96
Пробиотики – пищевые добавки, содержащие живые бактериальные культуры, применяют с целью модификации собственной микрофлоры желудочно-кишечного тракта. Их вводят через ферментативные молочные продукты, используют главным образом штампы молочнокислых бактерий и бифидум-флоры.
Пребиотики – неперевариваемые или неметаболизируемые организмом ребенка компоненты пищевых продуктов, чаще пищевые волокна, олиго– и полисахариды, иммуноглобулины. Они способствуют поддержанию микрофлоры желудочно-кишечного тракта.
Синбиотики – добавки, включающие в себя сочетание про– и пребиотиков для лучшей биологической усвояемости нутриенов. Они обеспечивают устойчивость желудочно-кишечного тракта по отношению к патогенной флоре.
Для первого и второго полугодий жизни используются смеси «Энфамил» фирмы «Мид Джонсон», «Лактофидус» фирмы «Данон», выпускаемые в России «Бебилак-1» и «Бебилак-2».
Немолочные продукты для искусственного вскармливания детей первого года жизни содержат продукты на основе сои, их пищевая ценность не уступает смесям на основе коровьего молока. Они особенно показаны детям с риском аллергических заболеваний.
Промышленность выпускает и гипоаллергенные смеси, смеси для детей, склонных к срыгиванию, неустойчивому стулу или кишечным коликам, смеси при риске возникновения анемии.
Техника искусственного вскармливания
Желательно использование одновременно только одной смеси при смешанном вскармливании и не более двух смесей – при искусственном.
Подкисленные смеси могут сочетаться с пресными или сладкими, составляя 1/3—1/2 суточного объема питания.
При необходимости относительно раннего перехода на смешанное вскармливание (ранее 3–5 месяцев), целесообразно увеличить число прикладываний к груди для стимуляции лактации и После прикладывания осуществлять в течение нескольких недель неполный докорм смесью, а затем уже возвращаться к исходному числу кормлений с полным докормом. При устойчивом, но ограниченном объеме лактации (200–400 мл) при смешанном вскармливании проводят чередование прикладывания к груди с кормлениями смесью.
Для смешанного и искусственного вскармливания целесообразна двухступенчатая система расчета питания: определение объема питания и выбор смесей, обеспечивающих необходимое количество ингредиентов в данном объеме (см. табл. 6).
Таблица 6. Искусственное вскармливание детей первого года жизни
Смеси практически удовлетворяют потребности в солях и витаминах. Повышенная осмолярность смесей может потребовать повышенной потребности в жидкости. Ее компенсируют неподслащенной водой после кормления или в промежутках между кормлениями. Введение прикормов при искусственном вскармливании необходимо для стимуляции навыков жевания и глотания гутой пищи. После 8–9 месяцев прикормы дополняют молочное питание по белкам, углеводам и энергии. Овощное пюре и каши домашнего приготовления могут ухудшить степень сбалансированности рациона.
Питание детей
1. Современные принципы рационального питания здоровых детей старше 1 года жизни
Питание детей раннего возраста (1–1,5 года; 1,5–3 года)
Питание в этих группах различается по:
1) объему суточного рациона;
2) величине разовых порций;
3) кулинарной обработке пищи.
Развитие жевательного аппарата позволяет вводить более твердую пищу, но ребенок быстро устает от процесса жевания. После первого года жизни пищу можно разнообразить, приближая ее по составу и вкусу к пище взрослых (см. табл. 7). После 1 года пищу можно размельчать вилкой, а мясо и рыбу пропускать через мясорубку 1 раз. К 2 годам у ребенка 20 молочных зубов, и полужидкую пищу необходимо заменять более плотной. В питании детей старше 1 года по-прежнему большое место занимают молоко и молочные продукты (600 мл в сутки). Кроме творога, уже можно добавить неострый сыр, который богат жиром, солями кальция и фосфора, сметану в небольшом количестве. К 2 годам молочные продукты, кроме молока, можно употреблять через 1–2 дня, молоко ежедневно. К 3 годам можно приготовить творожную запеканку (100–120 г творога и 20–25 г сметаны). Потребность в нутриентах у детей 2–3 лет мало отличается от таковых у грудных детей. В питании детей 1–3 лет обычно используют говядину и телятину, допустимы нежирная свинина, молодая баранина, мясо кролика, курицы. До 3 лет нельзя давать мясо утки, гуся, до 2 лет – сосиски, колбасу, сардельки, так как в этих продуктах содержится большое количество трудноусвояемых жиров. В то же время субпродукты содержат ценные микроэлементы (Fe, Pb, Cu, Ca), полезные для организма. Рыба содержит легкоперевариваемые белки. Для питания пригодны сорта многих морских и речных рыб (исключение составляют жирные и деликатесные сорта – треска, хек, карп, окунь).
Мясо и рыбу включают в меню ежедневно. Мясо 5–6 раз в неделю. Рыбу 1–2 раза. Обязателен хлеб разных сортов. После 2 лет, кроме манной, гречневой овсяной, рисовой круп, можно вводить пшено, ячневую, кукурузную, перловую крупы. Можно вводить пастилу, мармелад, варенье, фруктовую карамель, мед. Потребность ребенка 1–3 лет в сахаре составляет 40–50 г. Фрукты и овощи содержат витамины, железо, растительный белок, органические кислоты, ферменты.
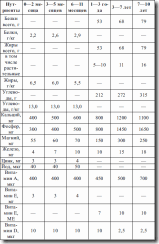
Таблица 7. Примерный объем блюд для детей от 1 года до 3 лет
Питание детей дошкольного возраста
Оптимальное соотношение белков, жиров, углеводов составляет 1: 1: 4. Животные белки должны составлять не менее 65 % общего белка, растительные жиры – 15 % от общего количества жиров, пектиновые вещества и клетчатка – не менее 3 % от суточного количества углеводов. Молока для детей дошкольного возраста требуется не менее 500–600 мл в сутки, часть суточной нормы рекомендуется давать в виде кисломолочных продуктов. Белковая часть рациона обеспечивается за счет творога, мяса, рыбы, птицы (до 150 г в сутки) и яиц (в среднем 0,5 яйца в сутки). Жировая часть рациона обеспечивается за счет указанных продуктов и за счет сливочного (25 г) и растительного (9—10 г) масла. Потребность детей в углеводах в основном удовлетворяется за счет овощей и фруктов, а не хлеба и круп, сахара. В сутки положено до 500 г различных овощей (доля картофеля составляет не более половины), 150–200 г свежих овощей и столько же натуральных фруктовых или овощных соков. Хлеба ребенку-дошкольнику достаточно 150–170 г в сутки, общее количество круп и макаронных изделий не должно превышать 40–50 г в сутки, количество сахара и кондитерских изделий – до 50–60 г. У детей 3–7 лет желудок освобождается от пищи примерно через 3,5–4 ч. В связи с этим устанавливается режим питания с промежутками между приемами пищи в среднем 4 ч, обычное число приемов пищи – 4, для ослабленных детей – 5 раз. Наиболее физиологичным для детей дошкольного возраста считается такой режим, при котором завтрак начинается в 7.30—8.00 ч, обед – в 11.30–12.00 ч, полдник – в 16.00–16.30 ч, ужин – в 19.00–20.00 ч. При 5-разовом кормлении ребенок должен получить стакан кефира или фрукты непосредственно перед сном или рано утром. Отклонения от принятого режима не должны превышать 15–20 мин. Важно не давать ребенку какую-либо пищу в промежутках между кормлениями. Не рекомендуются использовать в качестве питья сладкие соки, сладкий чай.
Недопустимы между кормлениями сладости, кондитерские изделия. Под правильным режимом питания понимается также количественное и качественное распределение продуктов. В отличие от детей раннего возраста, которым рекомендуется более равномерное деление суточного объема и калорийности пищи, детям 3–7 лет это деление неравномерно. Калорийность завтрака и ужина должна составлять по 25 % суточной калорийности рациона, обед – 35–40 %, полдник – 10–15 %. Суточный объем пищи в этом возрасте находится в пределах 1800–2000 мл. Превышение этих объемов снижает аппетит.
Не следует допускать увеличения объемов первых блюд у детей с пониженным аппетитом. Правильный режим питания детей предусматривает также соответствующее распределение продуктов в течение суток. Продукты, богатые животными белками и жирами, дольше задерживаются в желудке ребенка и требуют большого количества пищеварительных соков, поэтому их следует включать в рацион питания в первую половину дня, когда ребенок находится в более активном состоянии. На ужин рекомендуются легкоусваиваемые продукты. Таким образом, на завтрак и обед рекомендуются блюда, содержащие мясо, рыбу, яйца, на ужин – молочно-растительные продукты. На обед рекомендуется дать закуску, лучше в виде салата из сырых овощей, оказывающих сокогонное действие, не слишком объемное первое блюдо, полноценное мясное или рыбное высококалорийное блюдо с гарниром, преимущественно из овощей, на сладкое – лучше всего фруктовый сок, свежие фрукты, компот или кисель. На завтрак, как и на ужин, детям дошкольного возраста можно давать различные каши, предпочтительнее гречневую и овсяную. Каши лучше готовить с овощами или фруктами, молочные каши чередовать с блюдами из различных овощей в виде овощных рагу, запеканок, котлет, винегретов, салатов. Если на завтрак дается каша, то на ужин должны быть овощи.
На завтрак и ужин рекомендуются различные блюда из творога, особенно в сочетании с фруктами. На завтрак желательны блюда из мяса и рыбы (сосиски, сардельки, отварная или жареная рыба), блюда из яиц. В качестве питья лучше всего горячее молоко или кофейный напиток на молоке. На ужин в качестве питья лучше давать кефир или другой кисломолочный напиток, его можно также давать через 1,5–2 ч после ужина, перед сном. Полдник обычно состоит из какого-либо кисломолочного напитка и хлебобулочных или кондитерских изделий. Хорошо включать свежие фрукты или ягоды.
При их отсутствии можно использовать консервированные фрукты.
Питание детей школьного возраста (6—17 лет)
Нормирование питания школьников сложно в силу того, что в этом возрасте формируется широкая вариабельность конституциональных свойств метаболизма, стереотипов двигательной активности и стереотипов пищевого поведения.
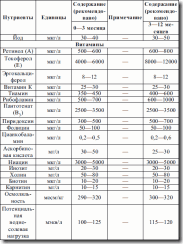
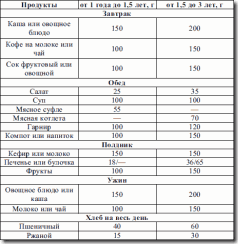
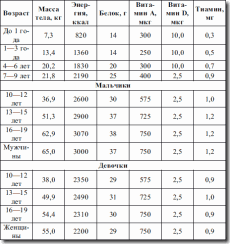
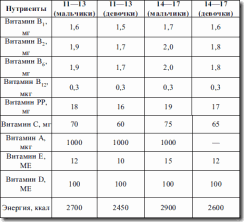
Именно в группе школьников наибольшая частота заболеваний органов пищеварительной системы (таких как гиповитаминозы, недостаточность железа, кальция, избыточность питания) (см. табл. 9, 10, 11, 12). Особая проблема – школьные завтраки, которые должны быть достаточно калорийны и насыщены микронутриентами для обеспечения умственной и физической работоспособности ребенка (см. табл. 8).
Таблица 8. Содержание школьных завтраков
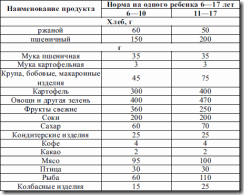
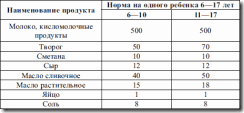
Таблица 9. Набор продуктов для детей 6—17 лет
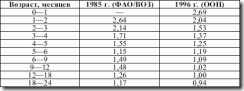
Таблица 10. Рекомендуемые уровни потребления (по данным ВОЗ)
Таблица 11. Рекомендуемые нормы потребления веществ и энергии для детей до 10 лет
(утв. Коллегией МЗ РФ 31.05.1991 г.)
Таблица 12. Рекомендуемые нормы потребления веществ и энергии для детей 10–17 лет
(утв. Коллегией МЗ РФ 31.05.1991 г.)
Особенности обмена веществ у детей. Семиотика нарушений
1. Основной обмен у детей
У ребенка первоначальное повышение основного обмена происходит до 1,5 лет, затем основной обмен продолжает неуклонно повышаться в абсолютном выражении и закономерно снижается в расчете на единицу массы тела.
Суммарная энергия, поступившая с пищей, распределяется на обеспечение основного обмена, специфически-динамическое действие пищи, потери тепла, связанные с экскрецией, двигательную активность и рост. В структуре распределения энергии различают:
1) Е поступившая (из пищи) = Е депонированная + Е использованная;
2) Е абсорбированная = Е поступившая – Е выведенная с экскрементами;
3) Е метаболизируемая = Е поступившая – Е обеспечения (жизни) и активности, или основных затрат;
4) Е основных затрат равна сумме энергий:
а) основного обмена;
б) терморегуляции;
в) согревающего эффекта пищи (СДДП);
г) затрат на активность;
д) затрат на синтез новых тканей.
Е депонированная – это энергия, затраченная на отложение белка и жира. Гликоген не учитывается, так как его отложение незначительное.
Е депонированная = Е метаболизируемая – Е основных затрат;
Е стоимости роста = Е синтеза новых тканей + Е депонированная в новой ткани.
Главные возрастные различия заключаются в отношении между затратами на рост и на активность, причем затраты на рост имеют наиболее существенное значение для маловесного новорожденного и в течение первого года жизни, у взрослого человека они отсутствуют. Физическая активность требует значительных затрат энергии даже у новорожденного и грудного ребенка, где ее выражением являются сосание груди, беспокойство, плач и крик. При беспокойстве ребенка расход энергии возрастает на 20–60 %, а при крике – в 2–3 раза. При повышении температуры тела на 1 °C повышение основного обмена составляет 10–16 %.
Энергозатраты роста
У детей много энергии затрачивается на пластический обмен (рост). Для накопления 1 г массы тела организму необходимо затратить приблизительно 29,3 кДж, или 7 ккал.
Энергетическая стоимость роста = Е синтеза + Е депонирования в новой ткани.
У недоношенного маловесного ребенка Е синтеза составляет от 0,3 до 1,2 ккал на 1 г, прибавленной к массе тела, у доношенного – 0,3 ккал на 1 г массы тела.
Общая энергия стоимости роста до 1 года = 5 ккал на 1 г новой ткани, после 1 года – 8,7—12 ккал на 1 г новой ткани, или около 1 % суммы калорий питания. Наиболее интенсивен рост во внутриутробном периоде развития. Темп роста продолжает оставаться высоким и в первые месяцы жизни, о чем свидетельствует значительная прибавка массы тела. У детей первых 3 месяцев жизни доля пластического обмена в расходовании энергии составляет 46 %, затем на первом году жизни она снижается, с 4 лет (особенно в пубертантном периоде) при значительном увеличении роста пластический обмен вновь увеличивается. В среднем у детей 6—12 лет на рост расходуется 12 % энергетической потребности. На трудно учитываемые потери (фекалии, пищеварительные соки и секреты, вырабатываемые в стенке пищеварительного тракта, слущивающийся эпителий кожи, волосы, ногти, пот) затрачивается у детей старше года 8 % энергетических затрат. Расход энергии на активность и поддержание постоянства температуры тела изменяется с возрастом ребенка. В течение первых 30 мин после рождения температура тела у новорожденного снижается почти на 2 °C, что вызывает значительный расход энергии. У детей раннего возраста на поддержание постоянной температуры тела при температуре окружающей среды ниже критической (28–32 °C) организм ребенка вынужден тратить 48—100 ккал/(кг х сутки). С возрастом увеличивается абсолютная затрата энергии на эти компоненты. Доля расхода на постоянство температуры тела у детей первого года жизни тем ниже, чем меньше ребенок, затем вновь происходит понижение расхода энергии, так как поверхность тела, отнесенная на 1 кг массы тела, вновь уменьшается. В то же время увеличивается расход энергии на активность. У детей в возрасте 6—12 лет доля энергии, расходуемая на физическую активность, составляет 25 % энергетической потребности, а у взрослого – 33 %. Специфически-динамическое действие пищи изменяется в зависимости от характера питания. Сильнее оно выражено при богатой белками пище, менее – при приеме жиров и углеводов. У детей второго года жизни динамическое действие пищи составляет 7–8 %, у детей более старшего возраста – более 5 %. Расходы на реализацию и преодоление стресса в среднем составляют 10 % от суточного энергетического расхода (см. табл. 13). Даже умеренная недостаточность энергии питания (4–5 %) может стать причиной задержки развития ребенка, делая пищевую энергетическую обеспеченность условием адекватности роста и развития.
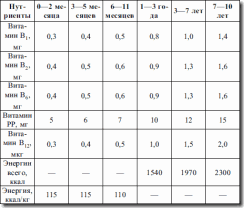
Таблица 13. Рекомендации по энергетической ценности питания детей (МЗ России, 1991 г.)
Примеры использования общих возрастных стандартов.
1. Расчетный метод определения основного обмена:
1) до 3 лет; 3—10 лет;10–18 лет;
2) мальчики: Х = 0,249 – 0,127; Х = 0,095 + 2,110; Х = 0,074 + 2,754;
3) девочки: Х = 0,244 – 0,130; Х = 0,085 + 2,033; Х = 0,056 + 2,898.
2. Дополнительные расходы:
1) компенсация повреждений – основной обмен умножается на:
а) при малой хирургии – 1,2;
б) при скелетной травме – 1,35;
в) при сепсисе – 1,6;
г) при ожогах – 2,1;
2) специфически-динамическое действие пищи: + 10 % от основного обмена;
3) физическая активность: прибавляется процент от основного обмена:
а) прикованность к постели – 10 %;
б) сидит в кресле – 20 %;
в) палатный режим больного – 30 %;
4) затраты на лихорадку: на 1 °C среднесуточного повышения температуры тела +10–12 % от основного обмена;
5) прибавка массы тела: до 1 кг в неделю (еще прибавляется 300 ккал/день).
Расчет энергообеспечения ориентирован на ликвидацию дефицита углеводов и жиров при обеспечении необходимыми сопутствующими микронутриентами, такими как калий, фосфаты, витамины группы В (особенно тиамин и рибофлавин), антиоксиданты.
Особенности белкового обмена и потребность в белке детей различного возраста. Семиотика нарушений
Белки выполняют в организме различные функции:
1) пластические функции – распад белка с высвобождением аминокислот, в том числе незаменимых;
2) белки – составная часть различных ферментов, гормонов, антител;
3) белки участвуют в поддержании кислотно-щелочного состояния;
4) белки – источник энергии, при распаде 1 г белка образуется 4 ккал;
5) белки осуществляют транспорт метаболитов.
По разнице между азотом пищи и его выделением и мочой, и фекалиями судят о его потреблении для образования новых тканей.
У детей после рождения или маловесных несовершенство усвоения любого пищевого белка может приводить к неутилизации азота. В противоположность взрослым у детей положительный азотистый баланс: количество поступившего азота с пищей всегда превышает его выведение. Уровень ретенции азота соответствует константе роста и скорости синтеза белка.
Свойства пищевых белков, учитываемые при нормировании питания
1. Биодоступность (всасываемость) рассчитывается по формуле:
(N поступивший – N выделенный с калом) х 100 / N поступивший.
2. Чистая утилизация (NPU, %) рассчитывается по формуле:
N пищи – (N стула + N мочи) х 100 / N пищи.
3. Коэффициент эффективности белка – прибавка в массе тела на 1 г съеденного белка в эксперименте.
4. Аминокислотный скор рассчитывается по формуле:
(Данная аминокислота в данном белке в мг х 100) / Данная аминокислота в эталонном белке в мг.
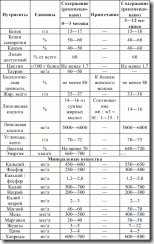
Идеальный белок – женское молоко с утилизацией 94 % и скор 100, и целое яйцо с утилизацией 87 % и скор 100 (см. табл. 14).
Таблица 14. Скорость синтеза белка в различные возрастные периоды
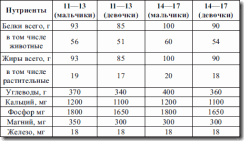
Таблица 15. Рекомендуемое потребление белка для детей (МЗ России, 1991 г.)
Таблица 16. Безопасные уровни потребления белка у детей раннего возраста, г/(кг в сутки))
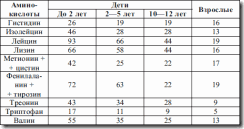
Безопасный уровень потребления белка – количество, необходимое для удовлетворения физиологических потребностей и поддержания здоровья у детей – выше, чем у взрослых. Усвоение азота организмом зависит как от количества, так и от качества белка – содержания жизненно необходимых аминокислот. Ребенку необходимо в 6 раз больше аминокислот, чем взрослому (см. табл. 16).
Если у взрослых незаменимыми являются 8 аминокислот, то у детей в возрасте до 5 лет их 13. При чрезмерной белковой перегрузке у детей более легко, чем у взрослых, возникают аминоацидемии, что может проявиться задержкой развития, особенно нервно-психического. Дети более чувствительны к голоданию, чем взрослые, дефицит питания приводит к частым инфекциям. Длительная недостаточность белка в рационе питания детей первых 3 лет жизни может вызвать необратимые изменения, сохраняющиеся пожизненно. Определение в плазме содержания общего белка и его фракций отражает процессы его синтеза и распада (см. табл. 17).
Содержание общего белка в сыворотке новорожденного ниже, чем у матери. На протяжении первого года жизни происходит снижение общего белка в сыворотке крови. Особенно низкие показатели наблюдаются у детей в возрасте 2–6 недель (50,8 г/л), с 6 месяцев отмечается постепенное повышение его уровня, в младшем школьном возрасте они ниже, чем у взрослых.
Таблица 17. Потребность в эссенциальных аминокислотах (мг на 1 г белка)
Фракции белка также более низкие, синтез альбумина составляет 0,4 г/кг/сутки, у новорожденного процентное содержание альбумина относительно выше, чем у матери. На первом году жизни происходит снижение содержания альбумина. Динамика содержания γ-глобулина аналогична таковой альбумина. В течение первого полугодия жизни особенно низкие показатели γ-глобулина, что связано с его распадом, синтез собственных глобулинов происходит медленно. Соотношение глобулиновых фракций α-1 – 1, α-2 – 2, β– 3, γ– 4 части. При острых воспалительных заболеваниях изменения белковой формулы крови характеризуются увеличением α-глобулинов при нормальном содержании γ-глобулинов и уменьшенном количестве альбуминов.
При хроническом воспалении имеет место повышение γ-глобулина при нормальном или слегка повышенном содержании α-глобулина, уменьшении альбумина.
Подострое воспаление характеризуется одновременным увеличением α-, γ-глобулинов при снижении содержания альбуминов.
Появление гипергаммаглобулинемии указывает на хронический период болезни, гиперальфаглобулинемия – на обострение. У детей содержание аминокислот приближается к таковым значениям у взрослых. У новорожденных наблюдается физиологическая азотемия с 9 до 70 ммоль/л, к 5—12-му дню уровень достигает такового у взрослого (28 ммоль/л). У недоношенных детей степень азотемии тем выше, чем меньше масса ребенка.
Содержание белка в пище значительно влияет на уровень остаточного азота крови. У взрослого продукты азотистого обмена выводятся с мочой в виде нетоксической мочевины, синтез которой осуществляется в печени. У детей в возрасте до 3 месяцев выделяется 0,14 г/кг в сутки, у новорожденного значительное количество в общем азоте мочи составляет мочевая кислота. Ее избыточное содержание в моче является причиной мочекислых инфарктов почек, которые наблюдаются у 75 % новорожденных.
Дети раннего возраста выводят азот белка в виде аммиака, содержание которого больше, чем у взрослых. В этом возрасте функция печени недостаточна. В этих условиях избыточная белковая нагрузка может привести к появлению токсических метаболитов в крови.
Врожденные заболевания, в основе которых лежит нарушенный метаболизм белков
Аминоацидопатия – дефицит ферментов, участвующих в обмене белков, их более 30 форм.
Клинические проявления:
1) нервно-психические нарушения – отставание нервно-психического развития в виде олигофрении;
2) судорожный синдром, который может появиться в первые недели жизни;
3) изменения мышечного тонуса в виде гипотонии или гипертонии;
4) задержка развития речи;
5) расстройства зрения;
6) изменения кожи (нарушения пигментации кожи: альбинизм, непереносимость солнца, пеллагрическая кожа, экзема, ломкость волос;
7) желудочно-кишечные симптомы (рвота);
8) поражение печени до развития цирроза с портальной гипертензией и желудочно-кишечными кровотечениями;
9) почечная симптоматика (гематурия, протеинурия);
10) анемия, лейкопения, тромбоцитопатии, повышенная агрегация тромбоцитов.
Заболевания, в основе которых лежит нарушение синтеза белков:
1) отсутствие образования конечного продукта – гемофилия (отсутствие синтеза антигемофильного глобулина), афибриногенемия (отсутствие в крови фибриногена);
2) накопление промежуточных метаболитов – фенилкетонурия;
3) второстепенные метаболические пути, могущие становиться основными и перегруженными, а образующиеся в норме метаболиты могут накапливаться в необычно высоких количествах – гемоглобинопатии, которые клинически проявляются спонтанным или вызванным каким-либо фактором гемолиза эритроцитов, увеличением селезенки. Недостаточность сосудистого или тромбоцитарного фактора Виллебранда вызывает повышенную кровоточивость.
Особенности углеводного обмена у детей. Семиотика нарушений
Углеводы являются основным источником энергии: 1 г углеводов выделяет 4 ккал, они входят в состав соединительной ткани, являются структурными компонентами клеточных мембран и биологически активных веществ (ферментов, гормонов, антител).
У детей первого года жизни содержание углеводов составляет 40 %, после 1 года оно возрастает до 60 %. В первые месяцы жизни потребность в углеводах покрывается за счет материнского молока, при искусственном вскармливании ребенок также получает сахарозу или мальтозу. После введения прикорма в организм попадают полисахариды (крахмал, гликоген), что способствует выработке амилазы поджелудочной железой начиная с 4 месяцев.
Моносахариды (глюкоза, фруктоза, галактоза) подвергаются резорбции на поверхности кишечных ворсинок слизистой оболочки кишечника, причем с затратой энергии макроэргической связи АТФ. Активность лактазы наиболее низкая среди дисахараз, поэтому чаще наблюдается лактазная недостаточность. Нарушения абсорбции лактозы (молочного сахара), особенно при грудном вскармливании, клинически проявляется диареей, для которой наряду с частым жидким стулом (более 5 раз в сутки) характерны пенистые испражнения кислой реакции. Может развиться дегидратация.
В более позднем возрасте происходит репрессия лактазы, чем объясняется то, что значительное большинство взрослых не переносят натурального молока, а кисломолочные продукты усваивают хорошо. Реже наблюдается врожденная мальабсорбция сахарозы и изомальтозы, что проявляется диареей у детей, находящихся на искусственном вскармливании.
Причины дисахаридазной недостаточности:
1) следствие воздействия повреждающих факторов (таких как энтериты, недостаточность питания, лямблиоз, иммунологическая недостаточность, целиакия, непереносимость белков коровьего молока, гипоксия, желтуха);
2) незрелость щеточной каймы;
3) следствие хирургического вмешательства.
При избытке в продуктах питания глюкозы и галактозы они подвергаются превращению в печени в гликоген. Синтез гликогена начинается на 9-й неделе внутриутробного развития, его быстрое накопление происходит перед рождением, что обеспечивает энергетическую потребность новорожденного первых дней жизни, когда ребенок получает мало молока. К 3-й неделе жизни концентрация гликогена достигает таких же значений у взрослых, но запасы гликогена расходуются быстрее, чем у взрослых. Соотношение интенсивности процессов гликогенеза и гликогенолиза определяет уровень гликемии. Центральным звеном регуляции гликемии является функциональное объединение нервных центров, расположенных в отдельных отделах ЦНС, и эндокринных желез (поджелудочной, щитовидной желез, надпочечников).
В зависимости от дефицита тех или иных ферментов, участвующих в метаболизме гликогена, выделяют различные формы гликогеноза.
I тип – гепаторенальный гликогеноз, болезнь Гирке, характеризуется недостаточностью глюкозо-6-фосфатазы, самый тяжелый вариант. Клинически проявляется после рождения или в грудном возрасте. Характеризуется гепатомегалией, гипогликемическими судорогами, комой, кетозом, селезенка никогда не увеличивается. В дальнейшем происходят отставание в росте, диспропорция телосложения – живот увеличен, туловище удлинено, ноги короткие, голова большая. В перерывах между кормлениями отмечаются бледность, потливость, потря сознания в результате гипогликемии.
II тип – болезнь Помпе, в основе которой лежит недостаточность кислой мальтазы. Клинически проявляется после рождения, такие дети быстро умирают. Наблюдаются гепато– и спленомегалия, мышечная гипотония, сердечная недостаточность.
III тип – болезнь Кори, обусловленая врожденным дефицитом амило-1,6-глюкозидазы – ограниченный гликогенолиз без тяжелой гипогликемии и кетоза.
IV тип – болезнь Андерсена – результат образования гликогена неправильной структуры. Наблюдаются желтуха, гепатомегалия, формируется цирроз печени с портальной гипертензией, осложненный профузными желудочно-кишечными кровотечениями.
V тип – мышечный гликогеноз развивается в связи с дефицитом мышечной фосфорилазы, может проявиться на 3-м месяце жизни, когда обнаруживается, что дети не способны длительно сосать грудь. Наблюдается ложная гипертрофия поперечно-полосатых мышц.
VI тип – болезнь Герца – обусловлен дефицитом печеночной фосфорилазы. Клинически наблюдаются гепатомегалия, отставание в росте, течение благоприятное. Содержание глюкозы в крови – показатель углеводного обмена. В момент рождения гликемия соответствует таковой у матери, с первых часов отмечается падение сахара за счет недостатка контринсулярных гормонов и ограниченность запасов гликогена. К 6-му дню содержание гликогена повышается, но его уровень ниже, чем у взрослого.
После первого года жизни повышение сахара отмечается к 6 годам и к 12 годам, что совпадает с усилением роста детей и высокой концентрацией соматотропного гормона. Суточная доза глюкозы должна составлять от 2 до 4 г/кг массы тела. У детей отмечается более тяжелое течение сахарного диабета, чаще он проявляется в период особенно интенсивного роста. Клинически проявляется жаждой, полиурией, похуданием, повышением аппетита, обнаруживаются гипергликемия и глюкозурия, часто кетоацидоз. В основе заболевания лежит недостаточность инсулина. В сыворотке крови новорожденного и ребенка первого года жизни содержится большое количество молочной кислоты, что указывает на преобладание анаэробного гликолиза (при аэробных условиях расщепления по гликолитической цепи преобладает пировиноградная кислота).
Процесс компенсации избытка лактата заключается в увеличении активности фермента лактатдегидрогеназы, превращающей молочную кислоту в пировиноградную с последующим ее включением в цикл Кребса. У детей по сравнению с взрослыми большее значение имеет пентозный цикл – путь расщепления глюкозы, начинающийся с глюкозо-6-фосфата с более коротким и быстрым образованием большого количества энергии.
Активность ключевого фермента этого цикла – глюкозо-6-фосфатдегидрогеназы – по мере роста снижается.
Несфероцитарная гемолитическая анемия – результат нарушения пентозного цикла расщепления глюкозы. Гемолитические кризы провоцируются приемом медикаментов.
Тромбоастения – результат нарушения гликолиза в тромбоцитах, клинически проявляется повышенной кровоточивостью при нормальном количестве тромбоцитов.
Галактоземия и фруктоземия – результат дефицита ферментов, превращающих галактозу и фруктозу в глюкозу.
Первые симптомы галактоземии выявляются после начала кормления детей молоком, особенно женским, содержащим большое количество лактозы. Появляется рвота, плохо увеличивается масса тела, наблюдаются гепатоспленомегалия, желтуха, катаракта, возможны асцит и расширение вен пищевода, в моче – галактозурия. Из питания необходимо исключить лактозу.
Фруктоземия клинически проявляется аналогично галактоземии, но в более легкой степени (наблюдаются рвота, снижение аппетита, когда детям начинают давать фруктовые соки, подслащенные каши, т. е. при переходе на искусственное вскармливание. В более старшем возрасте дети не переносят мед, содержащий чистую фруктозу.
Особенности жирового обмена. Семиотика нарушений жирового обмена
Обмен жиров включает обмен нейтральных жиров, фосфатидов, гликолипидов, холестерина и стероидов. Жиры в организме человека быстро обновляются. Функция жиров в организме:
1) участвуют в энергетическом обмене;
2) являются составным компонентом оболочек клеток нервной ткани;
3) участвуют в синтезе гормонов надпочечников;
4) защищают организм от чрезмерной теплоотдачи;
5) участвуют в транспортировке жирорастворимых витаминов.
Особое значение имеют липиды, входящие в состав клеток, их количество составляет 2–5 % от массы тела без жира. Меньшее значение имеет жир, находящийся в подкожной клетчатке, в желтом костном мозге, брюшной полости. Жир используется в качестве пластического материала, о чем свидетельствует интенсивность его накопления в период критического роста и дифференцировки. Наименьшее количество жира наблюдается в период 6–9 лет, с началом полового созревания вновь отмечается увеличение жировых запасов.
Жиры синтезируются только в организме плода. Синтез жира происходит преимущественно в цитоплазме клеток. Синтез жирных кислот требует наличия гидрогенизированных никотинамидных ферментов, главным источником которых является пентозный цикл распада углеводов. Интенсивность образования жирных кислот будет зависеть от интенсивности пентозного цикла расщепления углеводов.
На запасной жир большое значение оказывает характер вскармливания ребенка. При грудном вскармливании масса тела детей и содержание жира у них меньше, чем при искусственном. Грудное молоко вызывает транзиторное повышение холестерина в первый месяц жизни, что служит стимулом к синтезу липопротеинлипазы. Избыточное питание детей раннего возраста стимулирует образование в жировой ткани клеток, что в дальнейшем проявится склонностью к ожирению.
Различия в химическом составе триглицеридов и жировой ткани у детей и взрослых
У новорожденных в жире содержится относительно меньше олеиновой кислоты и больше пальмитиновой, что объясняет более высокую точку плавления жиров у детей, что следует учитывать при назначении средств для парентерального применения. После рождения резко возрастает потребность в энергии, одновременно прекращается поступление веществ из материнского организма, в первые часы не покрываются даже потребности основного обмена. В организме ребенка углеводных запасов хватает на короткое время, поэтому жировые запасы начинают использоваться сразу, что отражается повышением в крови концентрации неэстерифицированных жирных кислот (НЭЖК) при одновременном снижении уровня глюкозы. Одновременно с возрастанием НЭЖК в крови новорожденных через 12–24 ч начинается увеличение концентрации кетоновых тел, причем отмечается прямая зависимость уровня НЭЖК, глицерина, кетоновых тел от калорийности пищи. Новорожденный покрывает свои энергетические затраты за счет обмена углеводов.
По мере увеличения количества молока, которое получает ребенок, повышения его калорийности до 40 ккал/кг падает концентрация НЭЖК. Концентрация липидов, холестерина, фосфолипидов, липопротеинов у новорожденных низкая, но через 1–2 недели она возрастает, что связано с их поступлением из пищи. Принятые с пищей жиры подвергаются расщеплению и резорбции под влиянием липолитических ферментов желудочно-кишечного тракта и желчных кислот в тонкой кишке. Из-за нерастворимости жиров в крови их транспорт осуществляется в виде липопротеинов.
Превращение хиломикронов в липопротеины происходит под воздействием липопротеинлипазы, кофактором которой является гепарин. Под влиянием липопротеинлипазы происходит отщепление свободных жирных кислот из триглицеридов, которые связываются с альбумином и легко усваиваются. У новорожденных количество α-протеинов значительно больше, b-протеинов – меньше, к 4-му месяцу приближается к значениям у взрослых. В первые часы и дни жизни снижена реэстерификация жирных кислот в стенке кишечника. У детей первых дней жизни нередко наблюдается стеаторея, постепенно в фекалиях снижается количество свободных жирных кислот, что отражает лучшее всасывание жира в кишечнике. У недоношенных новорожденных активность липазы составляет всего 60–70 % активности, обнаруживаемой у детей старше 1 года, у доношенных новорожденных она значительно больше.
Всасывание жира определяется не только активностью липазы, но и желчными кислотами. У недоношенных новорожденных детей выделение желчных кислот печенью составляет лишь 15 % того количества, которое образуется в период полного развития ее функций у детей 2 лет. У доношенных новорожденных эта величина повышается до 40 %. У доношенных детей всасывание жиров из грудного молока осуществляется на 90–95 %, у недоношенных – на 85 %.
При искусственном вскармливании эти показатели снижаются на 15–20 %. Расщепление триглицеридов до глицерина и жирных кислот происходит под влиянием тканевых липаз.
Глицерин фосфорилируется и включается в гликолитическую цепь.
Жирные кислоты подвергаются окислению в митохондриях клеток и подвергаются обмену в цикле Кноопа—Линена, сущность которого состоит в том, что при каждом обороте цикла образуется одна молекула ацетилкоэнзима А. Но организм предпочитает использовать в качестве источника энергии углеводы из-за больших возможностей аутокаталитической регуляции прироста энергии в цикле Кребса. При катаболизме жирных кислот происходит образование промежуточных продуктов – кетоновых тел (b-оксимасляной кислоты, ацетоуксусной кислоты, ацетона). Кетогенность диеты определяется формулой:
(Жиры + 40 % белков) / (углеводы + 60 % белков).
Продукты обладают кетогенным свойством, если это соотношение превышает 2. Склонность к кетозу особенно проявляется в возрасте 2—10 лет. Новорожденные дети более устойчивы к развитию кетоза. Клинически кетоз проявляется ацетонемической рвотой, которая возникает внезапно и может продолжаться несколько дней, характерен запах ацетона изо рта, в моче определяется ацетон. Если кетоацидоз осложняет сахарный диабет, то обнаруживаются гипергликемия и глюкозурия. Содержание общих липидов в крови увеличивается с возрастом, только в течение первого года жизни оно возрастает в 3 раза. У новорожденных относительно высокое содержание нейтральных липидов (лецитина).
Нарушения обмена липидов могут происходить на различных этапах метаболизма
1. Синдром Шелдона развивается при отсутствии панкреатической липазы. Клинически проявляется целиакоподобным синдромом со значительной стеатореей, масса тела увеличивается медленно, встречается относительно редко. Обнаруживаются эритроциты с измененной структурой оболочки и стромы.
2. Синдром Золлингера—Эллисона наблюдается при гиперсекреции соляной кислоты, которая инактивирует панкреатическую липазу.
3. Абеталипопротеинемия – нарушение транспорта жира. Клиника сходна с целиакией (наблюдаются диарея, гипотрофия), в крови содержание жира низкое.
4. Гиперлипопротеинемии.
I тип является результатом дефицита липопротеинлипазы, в сыворотке крови содержится большое количество хиломикронов, она мутная, образуются ксантомы, больные часто страдают панкреатитом с приступами острых болей в животе; ретинопатией.
II тип характеризуется повышением в крови b-липопротеи-нов низкой кислотности со значительным повышением уровня холестерина и нормальным или слегка повышенным содержанием триглицеридов. Клинически определяются ксантомы на ладонях, ягодицах, периорбитально, рано развивается атеросклероз.
III тип – повышение флотирующих b-липопротеинов, высокое содержание холестерина, умеренное повышение триглицеридов. Обнаруживаются ксантомы.
IV тип – повышение пре-b-липопротеинов с увеличением триглицеридов, нормальным или слегка повышенным содержанием холестерина, хиломикроны не увеличены.
V тип отличается повышением липопротеинов низкой плотности. Клинически проявляется болями в животе, хроническим рецидивирующим панкреатитом, гепатомегалией. Гиперлипопротеинемии генетически обусловлены, относятся к патологии переноса липидов.
5. Внутриклеточные липоидозы. У детей наиболее часто встречаются болезнь Нимана—Пика (отложение в ретикулоэндотелиальной системе сфингомиелина) и болезнь Гоше (гексозоцереброзидов). Главное проявление этих болезней – спленомегалия.
Особенности водно-солевого обмена и синдромы его нарушения
Ткани и органы ребенка содержат значительно больше воды, чем у взрослого, по мере роста ребенка содержание воды уменьшается. Общее количество воды на третьем месяце внутриутробного развития составляет 75,5 % от массы тела. К рождению у доношенного новорожденного – 95,4 %. После рождения организм постепенно теряет воду, у детей первых 5 лет вода составляет 70 % от массы тела, у взрослого – 60–65 %. Наиболее интенсивно новорожденный теряет воду в период физиологической убыли массы тела за счет испарения при дыхании, с поверхности кожи, экскреции с мочой и меконием, причем потеря 8,7 % воды в этот период не сопровождается клиническим обезвоживанием. Хотя общее количество воды на 1 кг массы тела у детей больше, чем у взрослого, на единицу поверхности тела содержание жидкости у детей значительно меньше. На содержание воды в организме влияют характер питания и содержание жира в тканях, при преобладании углеводов в питании увеличивается гидрофильность тканей, жировая ткань бедна водой (содержит не более 22 %). Химический состав внутриклеточной жидкости и внеклеточной (плазмы крови, интерстициальной жидкости) различен. Интерстициальная жидкость отделена от крови полупроницаемой мембраной, ограничивающей выход белка за пределы сосудистого русла. Каждые 20 мин между кровью и интерстициальной жидкостью проходит количество воды, равное массе тела. Объем циркулирующей плазмы обменивается в течение 1 мин. Объем плазмы с возрастом относительно уменьшается. С возрастом не только уменьшается общее количество воды, но происходит и изменение в содержании внутри– и внеклеточной жидкости. Водный обмен у детей протекает более интенсивно, чем у взрослых. У детей раннего возраста отмечается большая проницаемость клеточных мембран, фиксация жидкости в клетке и межклеточных структурах более слабая. Особенно это касается межуточной ткани. У ребенка внеклеточная вода более подвижна. Высокая проницаемость клеточных мембран определяет равномерное распределение в организме не только жидкости, но и введенных парентерально веществ.
Потребность в воде у детей значительно больше, чем у взрослых.
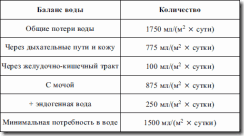
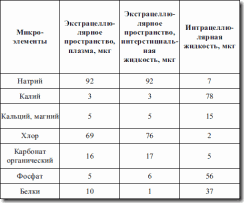
Таблица 18. Общий баланс воды в физиологическом состоянии ребенка
Состав минеральных солей и их концентрация определяют осмотическое давление жидкости, важнейшие катионы – одновалентные: натрий, калий; двухвалентные: кальций, магний. Им соответствуют анионы хлора, карбоната, ортофосфата, сульфата и др. В целом имеется некоторый избыток оснований, так что рН = 7,4. Электролиты оказывают основное влияние на распределение жидкостей. Такие осмотически активные вещества, как глюкоза и мочевина, в распределении жидкости в организме имеют небольшое значение, так как свободно проникают через сосудистую и клеточную мембраны (см. табл. 19).