Сосудистые осложнения сахарного диабета у детей
В пособии изложены современные положения, касающиеся проблемы сосудистых осложнений сахарного диабета у детей. Представлены современные взгляды на этиологию, патогенез формирования сосудистых осложнений сахарного диабета у детей, клинические признаки и методы диагностики при различных их проявлениях, современные методы терапии и диспансерного наблюдения.
Пособие ориентировано на активизацию самостоятельной работы и формирование профессиональных навыков у студентов и врачей-интернов.
Сахарный диабет – группа метаболических заболеваний, характеризующихся гипергликемией, которая является следствием дефектов секреции инсулина, действия инсулина или обоих этих факторов (ВОЗ, 1999).
Инсулинзависимый сахарный диабет (ИЗСД) является одним из наиболее распространенных эндокринных заболеваний в детском возрасте. Дети с ИЗСД составляют около 5 % всех больных диабетом.
По современным представлениям ИЗСД - аутоиммунное заболевание, развивающееся на фоне генетической предрасположенности при воздействии факторов внешней среды. Ведущими внешними факторами, способствующими развитию диабета у детей, являются: вирусная инфекция, отсутствие или уменьшение сроков естественного вскармливания, наличие в пище токсических агентов, таких как нитрозоамин, различные виды стресса. ИЗСД у детей характеризуется широкой вариабельностью в отношении клинической манифестации, длительности фазы ремиссии, возможности достижения метаболической компенсации и режимов инсулинотерапии.
Сахарный диабет является одной из самых важнейших не только медицинских, но и социальных проблем. Распространенность заболевания среди населения различных стран и этнических групп составляет от 1 до 3 %. Исследовательская группа ВОЗ отмечает, что инсулинзависимым сахарным диабетом (ИЗСД) страдает 1 из каждых 500 детей и 1 из 200 подростков; один из наиболее выраженных пиков заболеваемости приходится на возраст 7-11 лет. Избыточная масса тела, диета с низким содержанием «Защищенных» углеводов и высоким содержанием жиров, а также гиподинамия, наряду с наследственными факторами, способствует росту заболеваемости диабетом в популяции.
В настоящее время в Украине принята следующая классификация осложнений сахарного диабета:
1. Острые осложнения:
- Диабетический кетоацидоз; кетоацидотическая кома;
- Гиперосмолярная кома;
- Гипогликемия; гипогликемическая кома;
- Молочнокислая (лактоацидотическая кома);
2. Хронические осложнения:
- ангиопатии (ретинопатия, нефропатия, ангиопатия ног);
- невропатия (периферическая, центральная, автономная);
- синдром Мориака, синдром Нобекура;
- поражения кожи (дермопатия, липоидный некробиоз, липодистрофия, хронический паронихий);
- синдром диабетической кисти (хайропатия, контрактура Дюпюитрена);
- синдром диабетической стопы, сустав Шарко.
МКБ-10 приняты такие шифры осложнений при сахарном диабете:
Е 10.2 – Диабетическая нефропатия
Е 10.3 – Диабетическая ретинопатия
Е 10.4 – Диабетическая невропатия
Е 10.5 – Диабетическая ангиопатия
Е 10.6 – Другие уточненнные осложнения
Е 10.7 – Множественнные осложнения
Е 10.8 – Неуточненные осложнения
Е 10.9 – Сахарный диабет без осложнений
Интересным является тот факт, что диабетическая кома является причиной смерти не более 1-2% больных, в то время как частота летальных исходов от сосудистых нарушений достигает 65-80%. Распространенность диабетических ангиопатий, по данным ряда авторов, составляет 90-97%.
Актуальность проблемы диабетических ангиопатий наглядно подтверждается тем, что среди больных инсулинзависимым сахарным диабетом в возрасте до 20 лет смертность в 7 раз превышает среднюю смертность среди населения в целом, а после достижения 20-летнего возраста среднегодовой риск смертности в 20 раз превышает таковой по сравнению с общей популяцией.
Патогенез формирования сосудистых осложнений сахарного диабета у детей
Дефицит инсулина или инсулиновая резистентность, являющиеся причиной сахарного диабета, способствуют развитию окислительного стресса, который, в свою очередь, прямо и опосредованно приводит к развитию сосудистых осложнений
В 1987 г. S. Wolff с сотрудниками одними из первых показали, что основная роль в развитии сосудистых осложнений диабета принадлежит неферментативному аутоокислительному гликозилированию и окислительному стрессу, вызванному нарушением углеводного обмена. Указанные нарушения способствуют усилению процессов пероксидации липидов и изменению качественных характеристик липопротеидов с их накоплением в пенистых клетках, являющихся основой атеросклеротического поражения крупных сосудов. Модифицированные липопротеиды также принимают участие в повреждении эндотелиальных клеток, способствуя развитию микроангиопатии.
К сожалению, до настоящего времени отсутствуют методы, позволяющие непосредственно определять уровень окислительного стресса в организме. В этой связи состояние окислительного стресса и вызванные им нарушения и различные повреждения белков организма определяются косвенно по содержанию различных гликоокисленных продуктов, к которым относятся белковые карбонилы, липидные пероксиды и различные вещества, реагирующие с тиобарбитуровой кислотой.
Свободнорадикальное окисление липидов является неотъемлемой частью таких жизненно важных процессов, как перенос электрона флавиновыми элементами, обновление состава липидов биомембран, окислительное фосфорилирование в митохондриях, митогенез, проведение нервного импульса и др. Продуктами перекисного окисления липидов (ПОЛ) являются предшественники простагландинов и их производных - тромбоксанов и простациклина. Постоянно протекающие в клеточных мембранах реакции пероксидации, способствуют обновлению их липидного состава и поддержанию соответствующей активности всех липидзависимых мембрано-связанных ферментов, к которым относятся практически все ферментные системы организма. Процессы ПОЛ представляют собой цепную реакцию и включают инициирование, удлинение, разветвление, обрыв цепей окисления. Основная роль в инициировании перекисных реакций принадлежит активным формам кислорода, таким как супероксидрадикал, синглетный кислород, гидроксил-радикал. Избыточное образование продуктов ПОЛ оказывает повреждающее действие на уровне клеток, что проявляется повреждением мембран эритроцитов, лизосом, эндотелиальных клеток. При этом изменяется структура мембран клеток, вплоть до их разрыва. Цитотоксичность связана с накоплением перекисей липидов в липопротеидах высокой плотности (ЛПВП).
Диабетическая нефропатия
Диабетическая нефропатия (ДН), или гломерулярная микроангиопатия, - специфическое поражение почек, прежде всего сосудов клубочков. Однако в клинической практике более распространен термин «диабетическая нефропатия». Это название более оправдано, так как, во-первых, практически не бывает изолированного поражения капилляров клубочков без вовлечения других сосудов более крупного калибра и клубочков, и канальцев. Во-вторых, трудно определить преобладание поражения того или иного отдела нефрона. Частота развития и прогрессирования ДН связана с типом сахарного диабета, длительностью его течения, возрастом манифестации. ДН развивается приблизительно у 40-50% больных сахарным диабетом 1 типа. Риск развития нефропатии выше у больных, у которых сахарный диабет манифестировал в пубертатном возрасте, в сравнении с детьми, у которых дебют заболевания имел место в возрасте до 10 лет. Ранее полагали, что в первые 5 лет после манифестации сахарного диабета ДН не развивается. Однако современные диагностические возможности позволили выявлять специфические изменения в клубочках почек у больных сахарным диабетом 1 типа с длительностью менее 5 лет. ДН – одно из наиболее грозных сосудистых осложнений сахарного диабета, влекущих за собой раннюю инвалидность и смерть больных от терминальной почечной недостаточности.
Определение.
Диабетическая нефропатия – это специфическое поражение сосудов почек при сахарном диабете, которое сопровождается формированием узелкового или диффузного гломерулосклероза, терминальная стадия которого характеризуется развитием хронической почечной недостаточности.
Патогенез.
Морфологической основой ДН является нефроангиосклероз почечных клубочков, чаще диффузный, реже узелковый. Узелковый гломерулосклероз считается специфичным для сахарного диабета, поскольку впервые был описан Киммелстилом и Уилсоном (1936) по материалам аутопсии почки больного диабетом.
Предложено несколько патогенетических теорий, но наиболее популярными являются метаболическая, гемодинамическая и генетическая.
Метаболическая и гемодинамическая предполагают, что роль пускового механизма принадлежит гипергликемии, которая сопровождается каскадом биохимических нарушений, таких как:
- повышенное гликирование мембранных и других белков;
- активация сорбитолового шунта обмена глюкозы;
- нарушение транспорта различных катионов. Указанные сдвиги участвуют в формировании микроангиопатий различной локализации.
Гипергликемия приводит к активации протеинкиназы С, которая усиливает процессы пролиферации клеток, образование различных цитокинов, тканевых факторов роста. При этом нарушается синтез протеингликанов на базальных мембранах сосудов клубочков, повреждается эндотелий. Гипергликемия вызывает нарушения внутрипочечной гемодинамики, приводящие к склеротическим изменениям в почках. Длительная гипергликемия сопровождается гиперфильтрацией (высокой скоростью клубочковой фильтрации (СКФ)) и внутриклубочковой гипертензией. Внутриклубочковая гипертензия возникает и удерживается в связи с расширением приносящей артериолы и нормальным или повышенным тонусом выносящей. Дилятации приносящей артериолы способствуют гипергликемия, глюкагон, простациклин, оксид азота, а констрикции выносящей – прессорные факторы (ангиотензин II, катехоламины, тромбоксан А2, эндотелин), при этом развивается системная артериальная гипертензия (АГ), усугубляющая нарушения почечной гемодинамики.
Длительное прессорное воздействие внутри капилляров клубочков сопровождается постепенным нарушением сосудистых и паренхиматозных почечных структур, повышается проницаемость базальных мембран для белков и липидов. Белок попадает в мочу, кроме того, протеин и липиды откладываются в межкапиллярных пространствах, происходит процесс склерозирования клубочков, атрофируются почечные канальцы. Результатом этих процессов является нарушение фильтрации мочи. Постепенно гиперфильтрация сменяется гипофильтрацией. Прогрессирующая протеинурия и гипофильтрация сопровождаются нарушением выделительной функции почек с развитием азотемии.
Генетическая теория связывает развитие ДН с предрасположенностью к АГ. Возможны различия структуры генов разных ферментов, в частности, полиморфизм гена ангиотензинпревращающего фермента. В то же время, у части больных, у которых СД годами недостаточно компенсирован, ДН не развивается. Это позволяет предполагать, что есть генетические факторы, обладающие протекторным действием для сосудов почек в отношении как гипергликемии, так и ее гемодинамических последствий.
Клиническая картина при диабетической нефропатии
Стадии развития и естественное течение ДН более детально изучены при сахарном диабете I типа, что связано, вероятно, с тем, что инсулинозависимый тип сахарного диабета имеет более точную дату своего дебюта. В последние годы по мере совершенствования методик исследования функционального состояния почек, а также расширения возможностей анализа морфологических изменений почечной ткани на светооптическом и ультраструктурном уровнях, изменились и представления о механизмах формирования ДН и стадиях ее развития. Было предложено дополнительно выделить «доклиническую» (скрытую) стадию ДН, при которой отсутствуют клинические симптомы осложнения и выявляються только функциональные почечные нарушения.
Последовательность развития изменений в почках и стадии диабетической нефропатии представлены в таблице 1.
Таблица 1
Стадии развития диабетической нефропатии
(Mogensen C.E.)
|
Стадии ДН |
Основные характеристики |
Время от начала развития СД |
I – стадиягиперфункции почек |
Гиперфильтрация – увеличение СКФ Гиперперфузия- увеличение ПК Гипертрофия почек Нормоальбуминурия ( < 30 мг в сутки ) |
Дебют СД |
Продолжение табл. 1.
II - стадия начальныхструктурных измененийв почках |
Утолщение базальноймембраны клубочков Расширение мезангия Гиперфильтрация Нормоальбуминурия ( < 30 мг в сутки ) |
> 2 лет |
III – стадия начальной ДН |
Микроальбуминурия (от 30 мг до 300 мг в сутки) Нормальная или умеренно повышенная СКФ нестойкое повышение АД |
> 5 лет |
IV – стадия выраженной ДН |
Протеинурия (более 500 мг/сут) Артериальная гипертензия Снижение СКФ Склероз 50-70% клубочков |
> 10 - 15 лет |
|
V – стадия уремии |
СКФ < 10 мл/минТотальный гломерулосклероз Артериальная гипертензия Нарушение азотвыделительной функции почек (увеличение креатинина, мочевины) Симптомы интоксикации |
> 15 - 20 лет |
Стадия гиперфункции почек характеризуется появлением первых функциональных нарушений в работе почек, которые клинически никак не проявляются. Экскреция белка с мочой в норме, отечного синдрома нет, системное артериальное давление также остается в пределах нормальных значений. Однако при детальном изучении функционального состояния почек можно выявить начальные изменения. Самые ранние функциональные нарушения работы почек при сахарном диабете обнаруживаются уже в дебюте заболевания. Эти изменения характеризуются развитием гиперфильтрации и гиперперфузии. Установлено, что у больных СД 1 типа в первые недели-месяцы после появления гипергликемии СКФ повышается на 20-40% по сравнению с нормой.
Повышение СКФ в дебюте диабета, безусловно, связано с реакцией почек на стойкую гипергликемию. При этом, чем выше уровень глюкозы крови, тем выше СКФ. Однако прямая зависимость между гликемией и СКФ сохраняется только при умеренно высоких значениях сахара крови ( до 13-14 ммоль/л); при более высоком уровне гликемии СКФ начинает линейно снижаться. Поэтому нередко при выраженной декомпенсации сахарного диабета, при явлениях кетоацидоза обнаруживаются низкие значения СКФ и даже повышается креатинин сыворотки крови. Хорошая компенсация углеводных нарушений (достижение околонормогликемии) приводит к нормализации СКФ.
В то же время запоздалое начало инсулинотерапии у больных СД 1 типа (спустя несколько месяцев от начала диабета) уже не способно вернуть к норме ни увеличенный объем почек, ни повышенную СКФ. Однако у 25% больных СД 1 типа даже идеальная компенсация сахарного диабета сопровождается лишь незначительным снижением СКФ, оставаясь на высоком уровне на долгие годы вплоть до появления протеинурии. Именно эта когорта больных относится к группе высоко риска в отношении будущего развития клинической стадии ДН. Следовательно, длительная гипергликемия приводит к необратимым изменениям размера и функций почек.
Стадия начальных структурных изменений
Эта стадия также относится к бессимптомным (латентным) стадиям ДН. Экскреция белка с мочой и уровень АД по-прежнему остается в пределах нормы; СКФ и почечный кровоток повышены, как и на первой стадии ДН. Однако постепенно, вследствие тех патологических механизмов, которые были запущены воздействием гипергликемии, почечная ткань начинает претерпевать первые структурные изменения. Эти изменения характеризуются утолщением базальных мембран капилляров клубочков и увеличением объема мезангиального матрикса.
Стадия начальной диабетической нефропатии
Эта стадия последняя в ряду латентных стадий ДН. Как и предыдущие стадии она характеризуется высокой СКФ и почечного кровотока, отсутствием белка в общеклинических рутинных анализах мочи, нормальным или чуть повышенным уровнем АД. Однако именно эта стадия является решающей в судьбе больного сахарным диабетом, так как решается вопрос – разовьется или нет клиническая стадия диабетическая нефропатия, будет ли нефропатия прогрессировать и дальше до своей терминальной стадии или это прогрессирование будет остановлено.
Кардинальная черта этой стадии – появлении микроальбуминурии (МАУ). Микроальбуминурией называют состояние, которое характеризуется повышенной экскрецией с мочой альбумина (в пределах 30 – 300 мг/сут или 20-200 мкг/мин). При СД 1 типа МАУ появляется обычно не ранее чем через 3-5 лет от начала заболевания. Повышенная экскреция альбумина с мочой является предвестником развития клинически выраженной диабетической нефропатии и появление ее ассоциируется с 20-кратным возрастанием риска прогрессирования поражения почек. Если у больного СД выявляется МАУ, то при отсутствии должного лечения существует высокая вероятность того, что в дальнейшем показатель экскреции альбумина с мочой будет постоянно повышаться приблизительно на 15% в год, что приведет к появлению протеинурии через 8-10 лет. Установлено, что при появлении МАУ начинается постепенное повышение уровня АД (приблизительно на 3% в год), не всегда улавливаемое рутинными одноразовыми измерениями. Поскольку на стадии МАУ фильтрационная функция почек не нарушена, даже напротив – повышена, то в этой связи трудно объяснить артериальную гипертензию почечными нарушениями. Повышенное АД можно рассматривать как один из факторов поражения почек или, наоборот, что повышение АД и увеличенная экскреция альбумина с мочой могут быть сочетанными проявлениями общего процесса, ответственного за развитие ДН.
Состояния, сцепленные с наличием МАУ:
- плохой контроль глюкозы в крови;
- повышенное АД;
- атерогенный липидный профиль;
- инсулинорезистентность тканей;
- повышенная выявляемость:
- ретинопатии;
- нейропатии;
- поражение периферических сосудов;
- левожелудочковой гипертрофии;
- клинически не выявляемой ишемической болезни сердца.
Стойкая компенсация углеводных нарушений, а также применение препаратов, нормализующих почечную гемодинамику и биохимический состав базальных мембран клубочков почек, могут остановить патологический процесс в почках на стадии микроальбуминурии. Именно поэтому так важно своевременно диагностировать раннюю доклиническую стадию диабетической нефропатии и предпринять все возможные профилактические меры для предупреждения ее дальнейшего прогрессирования.
Стадия выраженной диабетической нефропатии
Появление постоянной протеинурии, выявляемой в общеклинических анализах мочи, свидетельствует о наступлении развернутой стадии ДН. При этом экскреция альбумина с мочой превышает 300 мг/сут, а экскреция белка в рутинных исследованиях превышает 0,5 г/сут. С момента появления протеинурии у больных начинается неуклонное снижение СКФ со скоростью от 0,1 до 2,4 мл/мин в мес, что приводит к развитию терминальной почечной недостаточности в среднем через 5-7 лет от момента появления протеинурии. Увеличение протеинурии до 3,5 г/сут и более может привести к развитию классического нефротического синдрома. Протеинурическая стадия ДН характеризуется быстрым ростом уровня АД. У 80-90% больных с момента проявления протеинурии уровень АД в среднем повышается на 7% в год.
J.A.Breyer и соавт. ( 1996) предположили, что факторами, ускоряющими развитие хронической почечной недостаточности у больных диабетом, являются:
- дебют диабета в пубертатном возрасте;
- наследственная отягощенность по сахарному диабету;
- артериальная гипертензия;
- высокая протеинурия;
- гиперлипидемия;
- наличие отечного синдрома;
- низкий гематокрит.
Протеинурическая стадия ДН характеризуется нарастанием тяжести и других микро – и макрососудистых осложнений сахарного диабета. Частота ретинопатии у больных с протеинурией достигает почти 100%. Столь содружественное прогрессирование ДН и ретинопатии позволило клиницистам выделить симптомокомплекс, названный «почечно-ретинальным синдромом». На стадии протеинурии достаточно быстро прогрессирует и диабетическая нейропатия, быстро развивается сердечно-сосудистая патология. На вопрос об обратимости функциональных и структурных изменений почек на этой стадии ДН всеми исследователями дается однозначный ответ – протеинурическая стадия необратима. Установлено, что к моменту появления протеинурии уже 50% клубочков почек склерозировано и не функционирует. Эти морфологические изменения не подвергаются обратному развитию. Возможно лишь только замедлить прогрессирование ДН до стадии почечной недостаточности.
Стадия уремии
На этой стадии фильтрационная функция почек продолжает неуклонно снижаться, приводя к нарастанию концентрации в крови токсических азотистых шлаков. Биохимическими маркерами сниженной СКФ являются повышение креатинина и мочевины сыворотки крови, гиперкалиемия и гиперфосфатемия. Суммарная характеристика этой стадии представлена в табл 2.
Таблица 2
Клинико-морфологическая характеристика V стадии ДН
(Дедов І.І., Шестакова М.В., 2000)
|
Клинико-лабораторные обследования |
Специальные методы обследования |
Структура почечной ткани |
|
Протеинурия у 100% больных Ретинопатия у 100% больных Потеря зрения у 30-40% больных Периферическая и автономная полинейропатия у 100% больных ↑ АД у 90-100 % больных Дислипидемия у 80-100% больных Анемия Ренальная остеодистрофия |
↓ ↓ почечный кровоток Размер почек в норме Альбуминурия > 300 мг/сут ↑ Креатинин, мочевина крови Гиперкалиемия Гиперфосфатемия Гипокальциемия |
Склероз > 80% клубочков Артериологиалиноз Тубулоинтерстициальный фиброз |
Через 3-4 года после появления ХПН развивается терминальная стадия ХПН. Особенностью течения ХПН при СД является то, что больные погибают при гораздо более низких показателях азотемии. Поэтому у таких больных целесообразно начинать лечение программным диализом при уровне креатинина 300 ммоль/л.
Нефросклеротическая стадия характеризуется тяжелой гипопротеинемией, гиперлипидемией, анемией, лейкоцитозом, изогипостеурией (в терминальной фазе олигурией и анурией).
При прогрессировании ХПН может развиться феномен Дана-Заброды – видимое улучшение течения СД, заключающееся в уменьшении гипергликемии и глюкозурии, главным образом, в связи с понижением активности инсулиназы и замедлении выведения почками инсулина.
Морфология почек при сахарном диабете
При сахарном диабете нарушается строение всех структурных компонентов почек – клубочков, канальцев и артериол. В табл.3 представлены основные морфологические изменения ткани почек при световой и электронной микроскопии.
При СД 1 типа развиваются три основных вида гистологических изменений клубочков почек:
- узелковый гломерулосклероз;
- диффузный гломерулосклероз;
- экссудативные изменения.
Характерные гистологические изменения ткани почек при ДН
|
Световая микроскопия |
Электронная микроскопия |
изменения клубочков с увеличением объема мезангия
изменения клубочков
|
мембраны капилляров клубочков
мезангиального матрикса
базальной мембраны ( оголение мембраны) |
Узелковый интеркапиллярный гломерулосклероз (рис.2) развивается у 15-30% больных сахарным диабетом. Характеризуется отложением овальных гомогенных гиалиноподобных масс (узелков) на периферии клубочков. Узелки содержат липиды, фибрин и замурованные мезангиальные клетки. По мере прогрессирования заболевания узелки увеличиваются в размерах и сдавливают близлежащие капилляры, что приводит к облитерации клубочков. Вследствие сдавления капилляров клубочков нарушается кровоснабжение канальцевого аппарата почек, приводящее к атрофии канальцев и развитию интерстициального фиброза. Следствием этого процесса является сморщивание почек. Поэтому узелковый гломерулосклероз, как правило, обнаруживают при уже развившейся почечной недостаточности.
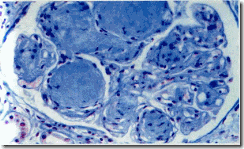
Рис. 2. Узелковый интеркапиллярный гломерулосклероз.
(Ув. х320) (по данным [4])
Диффузный интеркапиллярный гломерулосклероз (рис.3) развивается у 90% больных СД 1 типа. Характеризуется диффузным увеличением мезангиального матрикса, умеренной пролиферацией мезангиальных клеток и неравномерным утолщением БМК. При прогрессировании заболевания утолщенная БМК и увеличенный в объеме мезангиум приводят к сдавлению капилляров, постепенно облитерируя весь клубочек. На этой стадии нередко можно обнаружить перигломерулярный фиброз. Диффузный гломерулосклероз развивается, как правило, не ранее чем через 10 лет от начала заболевания.
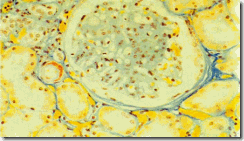
Рис. 3. Диффузный интеркапиллярный гломерулосклероз (Ув.х320) (по данным [4])
Экссудативные изменения (рис.4) характеризуются, как правило, двумя морфологическими вариантами:
· отложением эозинофильных гомогенных округлых масс между слоями базальной мембраны капсулы Боумена
( интрамембранозная «капсулярная капля»);
· отложением эозинофильных масс. Содержащих фибриновые волокна и липидные включения, в виде полумесяца или « шапочки» в пространстве капсулы, прилежащих к капиллярным петлям клубочка («фибриновая шапочка»).
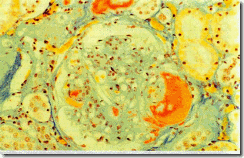
Рис. 4. Экссудативные изменения клубочка. Фибриновая «шапочка».
(Ув.х320) (по данным [4])
Экссудативные изменения хотя и можно достаточно часто обнаружить при сахарном диабете, однако они не патогномоничны для диабета и могут встречаться при других заболеваниях почек.
Диагностика диабетической нефропатии
Обязательные методы исследования:
· исследование МАУ трехкратно;
· определение уровня протеинурии ( в общем анализе мочи или в суточной моче);
· исследование мочевого осадка ( эритроциты, лейкоциты);
· определение уровня креатинину и мочевины сыворотки крови;
· определение СКФ.
Надежным тестом развития ДН является определение МАУ от 30 до 300 мг в сутки в утренней порции мочи, которое проводится с помощью радиоиммунного анализа, иммунными или турбиметрическими методами. Экспресс-диагностику осуществляют с помощью тест-полосок для мочи. В начале проводят исследование в разовой порции мочи. Если выявляется МАУ, превышающая 20 мг/л, исследуют суточную мочу. При концентрации альбумина более 30 мг в сутки необходимо повторное исследование через 6 и 12 нед. Если данные подтверждаются при каждом исследовании, можно заподозрить начальные стадии ДН.
Категории больных, которым необходимо проводить ежегодный скрининг ДН, перечислены в табл. 4.
Таблица 4
Больные сахарны диабетом, нуждающиеся в проведении ежегодного скрининга на МАУ
|
Категории больных |
Начало скринирования |
|
Больные СД 1типа, заболевшие в раннем возрасте |
Ежегодно с возраста 10-12 лет |
|
Больные СД 1 типа, заболевшие в пубертатном возрасте (10-15 лет) |
1 раз в год через 5 лет с при с момента диагностики болезни |
Для получения реальных результатов альбуминурии следует учитывать следующие правила:
- проводить исследования мочи на фоне компенсации углеводного обмена;
- исследовать мочу не реже 3 раз в течение месяца;
- исключить высокобелковую диету в день сбора мочи;
- избегать тяжелых физических нагрузок в день сбора мочи;
- не применять мочегонные препараты в день сбора мочи;
- исключить инфекцию мочевыводящих путей и /или другие заболевания почек;
- учитывать уровень диастолического АД;
- исключить сердечную недостаточность;
- не исследовать мочу на фоне лихорадки.
Ранним маркером ДН, уступающим все же МАУ в надежности, является нарушенная внутрипочечная гемодинамика, в частности гиперфильтрация. Она диагностируется на основании повышения СКФ более 140 мл/мин (проба Реберга). Проба Реберга может быть неинформативной в дебюте диабета, при его декомпенсации, при использовании высокобелковой диеты.
Лечение и профилактика диабетической нефропатии
Стратегию в лечении диабетической нефропатии можно условно подразделить на 3 этапа:
- Первичная профилактика ДН – направлена на предупреждение развития патологии почек у больных с нормоальбуминурией.
- Вторичная профилактика ДН – лечение больных с МАУ для предупреждения развития выраженной протеинурической стадии ДН.
- Третичная профилактика – включает лечебные мероприятия у больных сахарным диабетом с протеинурией и имеет целью затормозить снижение фильтрационной функции почек и прогрессирование ХПН.
Стратегия лечения диабетической нефропатии представлена в таблице 5.
Таблица 5
Стратегия лечения ДН
|
Механизм развития ДН |
Лечебные мероприятия |
|
Гипергликемия |
Тщательный контроль гликемии |
|
Артериальная гипертензия |
Антигипертензивные препараты |
|
Внутриклубочковая гипертензия |
Ингибиторы ангиотензинпревращающего фермента (ІАПФ), блокаторы ренинангиотензина, блокаторы кальциевых каналов |
|
Гиперлипидемия |
Антилипидемические препараты |
|
Оксидативный стресс |
Антиоксиданты |
|
Повышение полиолового обмена |
Ингибиторы альдоредуктазы |
Целью первичной профилактики является предупреждение появления МАУ у больных СД с нормоальбуминурией, но относящихся к группе высокого риска развития МАУ. Необходимо проводить воздействие на модифицируемые (т.е. поддающиеся лечению) факторы риска, такие как уровень компенсации углеводного обмена, состояние внутрипочечной гемодинамики (гиперфильтрация, функциональный почечный резерв), нарушения липидного обмена, курение.
Так, при нормальной экскреции альбумина с мочой необходимо:
-тщательная коррекция углеводного обмена (гликолизированный гемоглобин не выше 7-7,5%);
- артериальное давление не выше 110/70 мм рт.ст.
- холестерин ниже 4,5 ммоль/л;
- триглицериды ниже 1,7 ммоль/л.
Исходя из главенствующей роли нарушений внутрипочечной гемодинамики в развитии ДН, наиболее оптимальными патогенетическими средствами, препятствующими быстрому прогрессированию ДН, являются препараты, способные устранить внутриклубочковую гипертензию. Это ингибиторы ангиотензинпревращающего фермента. Эти препараты назначают при наличии признаков внутриклубочковой гипертензии даже при нормальном уровне АД.
Основными принципами вторичной профилактики ДН (при микроальбуминурии) являются:
1. идеальная (оптимальная) компенсация углеводного обмена - поддержание HBA1c< 7%;
2. диета с ограничением животного белка (до 0,9-1,2 г/кг в сутки) и соли;
3. коррекция артериального давления (при повышенном АД – среднетерапевтические дозы, при нормальном АД – в минимальных дозах):
· ИАПФ пролонгированного действия 1 раз в день вечером (обладают антигипертензивным антипротеинурическим и нефропротекторным действиями и на стадии микроальбуминурии позволяют предупредить протеинурию почти у 55% больных СД);
· Избегать назначения тиазидовых диуретиков и неселективных β-адреноблокатров (повышают инсулинорезистентность и уровень триглицеридов, большинство – снижают сердечный выброс и тем самым ухудшают почечную гемодинамику);
· Наряду с ИАПФ с целью нефропротекции назначают и селективные антагонисты имидазолиновых рецепторов (моксонидин, физиотенз)
- коррекция внутрипочечной гемодинамики:
· ИАПФ, даже при нормальном АД
· Антагонисты имидазолиновых рецепторов (моксонидин, физиотенз).
4. ацетилсалициловая кислота, постоянно, на ночь: детям старше 12 лет – 325 мг 1 раз в 3 дни или 100 мг;
5. Сулодекcид (повышает уровень гепарансульфата в мембранах почечных клубочков, восстанавливает селективную проницаемость почечного фильтра и предупреждает развитие склеротических процессов в ткани почек) внутримышечно 1 раз в течение 5 дней, 2 дня перерыв, всего 3 недели или 10 дней в/м, затем 2 недели в капсулах.
Основными принципами третичной профилактики ДН (при наличии протеинурии) являются:
- идеальная (оптимальная) компенсация углеводного обмена (см. выше);
- коррекция артериального давления в постоянном режиме (см. выше) – препараты выбора ИАПФ, на этой стадии предупреждают развитие хронической почечной недостаточности у 50-55% больных СД; при необходимости комбинируют с препаратами других групп: петлевые диуретики, блокаторы кальциевых каналов, препараты центрального действия ( моксонидин);
- диета с ограничением животного белка (до 0,8-0,9 г/кг в сутки), желательно замещение животного жира растительным; разрешено расширение углеводного рациона для покрытия энергозатрат;
- коррекция липидного обмена при повышении холестерина > 6,5 ммоль/л и триглицеридов > 2,2 ммоль/л присоединение гиполипидемических препаратов (предпочтение – никотиновой кислоте);
- Сулодексид – в/м 1 раз в сутки 10 дней, после чего – по 2-3 капсулы 2 раза в сутки – 14 дней;
- ибустрин (ингибитор синтеза тромбоксана Н2) – увеличивает СКФ и уменьшает суточную протеинурию – 1т 2 раза ( 400 мг/сут) – 3 мес.
На стадии ХПН потребность в инсулине резко снижается, так как при выраженном поражении почек снижается активность почечной инсулиназы, участвующей в деградации инсулина. Поэтому экзогенно введенный инсулин медленно метаболизируется, долго циркулирует в крови, вызывая гипогликемии. Все изменения дозы инсулина производятся только при обязательном контроле сахара крови.
Принципы лечения больных с ДН на стадии ХПН аналогичны таковым при лечении ХПН у больных с заболеваниями почек.



 СКФ
СКФ