АНТИДОТЫ И ИХ ХАРАКТЕРИСТИКА
Антидоты представляют собой лекарственные средства или особые составы, применение которых в профилактике и лечении отравлений обусловлено их специфическим антитоксическим действием. Антидоты обезвреживают яды и устраняют вызываемые ими токсические эффекты.
Применение антидотов лежит в основе профилактических или терапевтических мер по нейтрализации токсических эффектов химических веществ. Поскольку многие химические вещества обладают множественными механизмами токсического действия, в некоторых случаях приходится одновременно вводить различные антидоты, применять терапевтические средства, устраняющие не причины, а только отдельные симптомы отравления. Более того, поскольку глубинные механизмы действия большинства химических соединений изучены недостаточно, лечение отравлений ограничивается симптоматической терапией. Опыт, накопленный в клинической токсикологии, показывает, что некоторые препараты, в частности витамины и гормоны, можно отнести к универсальным антидотам, благодаря положительному профилактическому и терапевтическому, действию, которое они оказывают при различных отравлениях. Объясняется это тем, что в основе отравления лежат общие патогенетические механизмы. Общепризнанной классификации антидотов до сих пор не существует. Наиболее рациональная система классификаций основывается на сведении антидотов в основные группы в зависимости от механизма их антитоксического действия: физического, химического, биохимического или физиологического. Исходя из условий, при которых антидоты вступают в реакцию с ядом, проводят разграничение между антидотами местного действия, реагирующими с ядом до его всасывания тканями организма, и антидотами резорбтивного действия, реагирующими с ядом после его поступления в ткани и физиологические жидкости.
Следует отметить, что антидоты физического действия применяются исключительно для профилактики интоксикации, а антидоты резорбтивного действия служат как для профилактики, так и для лечения отравлений.
Антидоты физического действия
Эти антидоты оказывают защитное действие, главным образом, за счет адсорбции яда. Благодаря своей высокой поверхностной активности адсорбенты связывают молекулы твердого вещества и препятствуют его поглощению окружающей тканью.
Однако молекулы адсорбированного яда могут позже отделиться от адсорбента и вновь попасть на ткани желудка. Это явление десорбции. Поэтому при применении антидотов физического действия исключительно важно сочетать их с мерами, направленными на последующее выведение адсорбента из организма. Это можно добиться промыванием желудка или применением слабительных, если адсорбент уже попал в кишечник. Предпочтение следует отдавать солевым слабительным (например, сульфату натрия), являющимся гипертоническими растворами, стимулирующими поступление жидкости в кишечник, что практически исключает поглощение твердого вещества тканями. Жировые слабительные (например, касторовое масло) могут способствовать адсорбции жирорастворимых химических веществ, в результате чего возрастает количество яда, поглощенного организмом. Наиболее типичными антидотами этой группы являются активированный уголь и каолин. Они дают большой эффект при остром отравлении алкалоидами (органическими веществами растительного происхождения, например атропином) или солями тяжелых металлов.
Антидоты химического действия
В составе механизма их действия лежит непосредственно реакция между ядом и антидотом. Химические антидоты могут быть как местного, так и резорбтивного действия.
Местное действие. Если физические антидоты оказывают малоспецифический антидотный эффект, то химические обладают довольно высокой специфичностью, что связано с самим характером химической реакции. Местное действие химических антидотов обеспечивается в результате реакции нейтрализации, образования нерастворимых соединений, окисления, восстановления, конкурентного замещения и образования комплексов. Первые три механизма действия имеют особую важность и изучены лучше других.
Хорошим примером нейтрализации ядов служит использование щелочей для противодействия случайно проглоченным или попавшим на кожу сильным кислотам. Нейтрализующие антидоты применяются и для осуществления реакций, в результате которых образуются соединения, имеющие низкую биологическую активность. Например, в случае попадания в организм сильных кислот рекомендуется провести промывание желудка теплой водой, в которую добавлен оксид магния (20 г\л).
В случае отравления плавиковой или лимонной кислотой больному дают проглотить кашицеобразную смесь хлорида кальция и оксида магния. При попадании едких щелочей следует провести промывание желудка однопроцентным раствором лимонной или уксусной кислоты. Во всех случаях попадания в организм едких щелочей и концентрированных кислот следует иметь в виду, что рвотные средства противопоказаны. При рвоте происходят резкие сокращения желудочных мышц, а поскольку эти агрессивные жидкости могут поразить желудочную ткань, возникает опасность прободения.
Антидоты, образующие нерастворимые соединения, которые не могут проникнуть через слизистые оболочки или кожу, обладают избирательным действием, т.е. эффективны только в случае отравления определенными химическими веществами. Классическим примером антидотов такого типа может служить 2,3-димеркаптопропанол, образующий нерастворимые, химически инертные сульфиды металлов. Он дает положительный эффект при отравлении цинком, медью, кадмием, ртутью, сурьмой, мышьяком.
Таннин (дубильная кислота) образует нерастворимые соединения с солями алкалоидов и тяжелых металлов. Токсиколог должен помнить, что соединения таннина с морфином, кокаином, атропином или никотином обладают различной степенью стабильности.
После приема любых антидотов этой группы необходимо производить промывание желудка для выведения образовавшихся химических комплексов.
Последние годы привлекает к себе внимание местное применение тиосульфата натрия. Он используется в случаях отравления мышьяком, ртутью, свинцом, цианистым водородом, солями брома и йода.
В случаях попадания в организм опия, морфина, аконита или фосфора широко применяется окисление твердого вещества. Наиболее распространенным антидотом для этих случаев является перманганат калия, который применяется для промывания желудка в виде 0,02-0,01-процентного раствора. Этот препарат не дает эффекта при отравлении кокаином, атропином и барбитуратами.
Резорбтивное действие. Резорбтивные антидоты химического действия можно подразделить на две основные подгруппы: а) антидоты, вступающие во взаимодействие с некоторыми промежуточными продуктами, образующимися в результате реакции между ядом и субстратом; б) антидоты, непосредственно вмешивающиеся в реакцию между ядом и определенными биологическими системами. В этом случае химический механизм часто бывает связан с биохимическим механизмом антидотного действия.
Следовательно, лечение антидотами протекает в трех основных направлениях:
1) нейтрализация яда в кровотоке немедленно после его поступления в организм;
2) фиксация яда в кровотоке с целью ограничения его количества, поступающего в ткани;
3) нейтрализация яда, поступающего в кровь, после диссоциации цианометгемоглобина и комплекса цианида и субстрата.
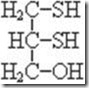
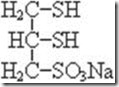
Комплексообразующие соединения включают также антидоты, молекулы которых содержат свободные меркаптогруппы SH. Большой интерес в этом плане представляют димеркаптопром (БАЛ) и 2,3-димеркаптопропансульфат (унитиол). Молекулярная структура этих антидотов сравнительна проста:
 ;
;  .
.
БАЛ Унитол
В обоих этих антидотах имеются две SH-группы, близкие к друг другу. Они реагируют с металлами и неметаллами.
![]() .
.
Здесь можно выделить следующие фазы:
а) реакция ферментных SH-групп и образование малоустойчивого комплекса;
б) реакция антидота с комплексом;
в) высвобождение активного фермента благодаря образованию комплекса металл-антидот, выводящегося с мочой.
Для лечения отравлений никелем, молибденом и некоторыми другими металлами эффективных антидотов не существует.
Антидоты биохимического и физиологического действия
Эти препараты отличаются высокоспецифичным антидотным эффектом. Для данного класса типичны антидоты, применяемые при лечении отравлений фосфорорганическими соединениями, являющимися основными компонентами инсектицидов. Даже очень небольшие дозы фосфорорганических соединений подавляют функцию холинэстеразы в результате ее фосфорилирования, что приводит к накоплению ацетилхолина в тканях. Поскольку ацетилхолин имеет огромное значение для передачи импульсов как в центральной, так и в периферической нервной системе, его чрезмерное количество ведет к нарушению нервных функций, и следовательно, к серьезным патологическим изменениям.
Антидоты, восстанавливающие функцию холинэстеразы, принадлежат к производным гидроксамовых кислот и содержат оксимную группу R–СН=NОН. Практическое значение имеют оксимные антидоты 2-ПАМ (пралидоксим), дипироксим (ТМБ-4) и изонитрозин. При благоприятных условиях эти вещества могут восстановить функцию фермента холинэстеразы, ослабляя или ликвидируя клинические признаки отравления, предотвращая отдаленные последствия и способствуя успешному выздоровлению.
Практика однако показала, что наилучшие результаты достигаются в тех случаях, когда биохимические антидоты применяются с антидотами физиологического действия. К антидотам физиологического действия относятся все лекарственные средства, вызывающие физиологические реакции, противодействующие яду (например, возбуждающие действие при парализующих ядах).
РАСЧЕТНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ ПДК ВРЕДНЫХ ВЕЩЕСТВ В ВОЗДУХЕ РАБОЧЕЙ ЗОНЫ И АТМОСФЕРНОМ ВОЗДУХЕ НАСЕЛЕННЫХ МЕСТ
Принципы расчета ПДКР.З.
Ускорение способов оценки токсичности вредных промышленных веществ и установление для них ориентировочных значений ПДК продиктовано стремлением устранить разрыв, который существует между числом новых химических веществ, внедряемых в промышленное производство, и реальными возможностями их изучения и установления для них обоснованных ПДК. Среди путей к этой цели одним из наиболее перспективных является математический метод, позволяющий прогнозировать токсическое действие химических соединений как по их физико-химическим свойствам, так и по результатам простейших и кратковременных токсикологических исследований. Несомненно, что расчетные методы не могут полностью подменить экспериментальные обоснования ПДК, проводимые в лабораторных условиях. В особенности это относится к нормированию веществ, обладающих выраженным специфическим действием. Однако для многих химических соединений рассчитанные по формулам ориентировочные значения ПДК весьма близки к узаконенным. Дальнейшее совершенствование математических методов установления ПДК с привлечением к регрессионному анализу разнообразных исходных показателей еще более повысит его значение в прогнозировании допустимых пределов нахождения во внешней среде химических веществ.
Для установления значения ПДК рекомендуется проводить расчеты по нескольким уравнениям.
Для вычисления среднего значения ПДК его величина представляется в виде среднего геометрического логарифма ПДК, рассчитанных по отдельным уравнениям. Одновременно целесообразно провести расчеты ПДК для ранее нормированных соединений, что позволяет подтвердить обоснованность прогнозов. В случае значительных расхождений величин ПДК, рассчитанных по отдельным уравнениям или «выпадении» полученной величины из ряда нормированных соединений исследуемого гомологического ряда, целесообразно привлечение дополнительных расчетов, основанных на определении порогов с помощью метода фракционного голодания или использования митохондриальной тест-системы. При выборе окончательного значения ПДК следует учитывать все имеющиеся сведения о токсических свойствах изучаемого вещества (прогнозируемые величины, аналогия с ранее нормированными соединениями, особенности токсического действия).
Основные параметры токсикометрии, используемые при расчетах
Основные обозначения и единицы измерения
В приведенных ниже формулах используются следующие параметры токсикометрии.
ПДКр.з – предельно допустимая концентрация вредного вещества в воздухе рабочей зоны, мг/м3. Эта концентрация не должна вызывать у работающих при ежедневном вдыхании в пределах 8 часов в течение всего рабочего стажа заболеваний или отклонений в состоянии здоровья, обнаруживаемых современными методами исследований непосредственно в процессе работы или в отдаленные сроки. Рабочей зоной считается пространство, высотой до 2 м над уровнем пола или площадки, на которой находятся места постоянного или временного пребывания рабочих.
ПДКсс – среднесуточная концентрация вредного вещества в воздухе населенных мест, мг/м3.
ПДКмр – максимальная разовая концентрация вредного вещества в воздухе населенных мест, мг/м3.
ПКсг.р – пороговая концентрация, вызывающая изменения в характеристике безусловного сгибательного рефлекса у кроликов при 40-минутном воздействии, мМ\кг.
CL50 – среднесмертельная концентрация вещества, мг/м3, мг/л. Значения CL50 выражают также в мг-молекулах на литр (мМ/л). Для перевода мг/л в мМ/л необходимо разделить исходное значение CL50 на молекулярную массу вещества.
CL100 – абсолютная смертельная концентрация вещества, мг/м3, мг/л.
DL50 – среднесмертельная доза вещества, мг/кг. Значения DL50 выражают также в мг/молекулах на килограмм (мМ/кг) и в мг-атомах на килограмм (мА/кг). Для перевода мг/кг в мМ/кг надо разделить исходное значение DL50 на молекулярную массу вещества. Для перевода мг/кг в мА/кг надо разделить исходное значение DL50 на молекулярную массу вещества и умножить на число атомов металла, входящих в молекулу вещества.
DL50К – среднесмертельная доза вещества при нанесении на кожу, мг/кг.
Limac – порог острого действия, мг/м3, мг/л.
Limch – порог хронического действия, мг/м3, мг/л.
КВИОас – коэффициент возможности ингаляционного отравления при остром действии.
КВИОсh – коэффициент возможности ингаляционного отравления при хроническом действии.
Zbioi – зона биологического действия.
Расчет ПДКР.З. по показателям токсичности
Рекомендуемые ниже формулы для расчета ПДК вредных веществ в воздушной среде рабочей зоны выведены на основании регрессивного анализа. Узаконенные ПДКР.З. сопоставлялись с различными показателями их токсичности и некоторых физико-химических свойств этих веществ.
Формулы для расчета ПДКР.З., учитывающие показатели токсичности, вывели также Е.И. Люблина и А.А. Голубев. Эти значения ПДК ближе к узаконенным, чем ПДК, полученные при использовании физико-химических констант. Для газов и паров органических соединений ими предложены следующие формулы:
lg ПДКР.З. = lg ПКсг.р + 1,7 + lg M (1)
lg ПДКР.З. = 0,91 lg CL50 + 0,1 lg M (2)
lg ПДКР.З. = lg DL50 – 2,0 + lg M (3)
Наибольшее приближение к узаконенным значениям ПДКР.З. дают формулы (1) и (3). Эти уравнения могут быть заменены еще более простыми:
ПДКР.З. = 50 ПКсг.р (4)
ПДКР.З. = 0,01 DL50 (5)
Упомянутые авторы предложили множественную линейную регрессию, учитывающую три исходных показателя (ПКсг.р, CL50 и М):
lg ПДКР.З. = 0,25 lg ПКсг.р + 0,71 lg CL50 + 0,25 + lg M (6)
Анализ значений ПДК, полученных по формуле (6), показывает, что в подавляющем большинстве они существенно не отличаются от соответствующих узаконенных величин. Исключение составляют лишь те вредные вещества, которые содержат метильные группы, так как первые члены ряда нередко имеют значительные отклонения от закономерностей, характерных для последующих химических соединений.
Значения ПДК аэрозолей металлов, их оксидов или других малорастворимых соединений могут быть получены при использовании следующей формулы:
lg ПДКР.З. = 0,85 lg DL50 – 3,0 + lg M – lg N (7)
где N – число атомов металла в молекуле вещества, а DL50 выражена в мА/кг.
Определение ПДКР.З., веществ, относящихся к изученным в токсикологическом плане классам или группам химических соединений
Для некоторых конкретных органических соединений, находящихся в воздухе в виде паров либо смеси паров и аэрозолей, рекомендуются уравнения, объединенные в таблице.
|
Класс или группа соединения |
Уравнения |
|
Углеводороды предельные алифатические |
ПДКР.З. = 0,001 CL50 (8) |
|
Углеводороды с непредельной связью в открытой цепи |
ПДКР.З. = 0,0004 CL50 (9) |
|
Хлоруглеводороды предельные алифатические |
ПДКР.З. = 0,0005 CL50 (10) |
|
Хлоруглеводороды непредельные |
ПДКР.З. = 0,0002 CL50 (11) |
|
Хлорбензолы, хлорксилолы, хлорнафталины |
ПДКР.З. = 0,0025 CL50 (12) |
|
Бромуглеводороды без предельных связей в открытой цепи |
ПДКР.З. = 0,00025 CL50 (13) |
|
Спирты непредельные алифатические с атомами F или без них, фенолы без непредельных связей в боковых цепях |
lg ПДКР.З. = 0,286 lg CL50 – 0,75 + lg M (14) |
|
Спирты непредельные алифатические с одной двойной связью |
lg ПДКР.З. = 0,286 lg CL50 – 1,01 + lg M (15) |
|
Спирты непредельные алифатические с двумя или одной тройной связью |
lg ПДКР.З. = 0,286 lg CL50 – 1,35 + lg M (16) |
|
Простые эфиры предельные алифатические |
ПДКР.З. = 0,001 CL50 (17) |
Расчет ПДКР.З. по физико-химическим показателям веществ
При отсутствии данных о токсичности химических соединений расчет ориентировочных значений ПДК может быть произведен по их физико-химическим константам. Расчеты по этим показателям по формулам (18)-(24) дают большее несовпадение последних с узаконенными величинами ПДК, чем при расчете по токсикологическим показателям. Следует отметить, что производить расчеты по формулам (18)-(24) можно лишь для тех органических веществ, физико-химические константы которых укладываются в следующие границы:
Молекулярная масса М от 30 до 300
Плотность r, г\см3 от 0,6 до 2,0
Температура кипения tкип, °С от – 100 до +300
Температура плавления tпл, °С от – 190 до +180
Показатель преломления nD от 1,3 до 1,6
В основании формул находится одна из физико-химических констант:
lg ПДКР.З. = – 0,058 s + 1,12 + lg M (18)
lg ПДКР.З. = – 10 nD + 14,2 + lg M (19)
lg ПДКР.З. = – 0,012 1 tпл – 1,2 + lg M (20)
lg ПДКР.З. = – 0,01 М + 0,4 + lg M (21)
lg ПДКР.З. = – 0,01 tкип + 0,6 + lg M (22)
lg ПДКР.З. = – 0,48 lg r – 1,0 + lg M (23)
lg ПДКР.З. = – 2,2 r + 1,6 + lg M (24)
Для получения более достоверных результатов необходимо произвести расчет по нескольким показателям, а затем найти среднее логарифмическое значение ПДКР.З.. В качестве исходных переменных величин целесообразно брать поверхностное натяжение s и температуру плавления tпл. Менее точные значения ПДКР.З. получаются при учете поверхностного натяжения s и плотности r и, наконец, еще менее точные – при использовании плотности r и температуры плавления tпл.
Для веществ с резко выраженными специфическими и неспецифическими свойствами ориентировочные значения ПДКР.З. значительно отклоняются от узаконенных. Для веществ неспецифического действия, т. е. обладающих, как правило, низкой химической активностью, расчетные величины оказываются заниженными, а у веществ с преимущественно специфическим действием и выраженной химической активностью рассчитанные ПДКР.З. оказываются подчас весьма завышенными. Последнее обстоятельство наиболее опасно, так как может ориентировать исследователей на принятие значений ПДК, представляющих опасность для работающих.
Приведем поправки, которые необходимо вносить при расчете ПДКР.З. для некоторых групп химических соединений:
lg ПДКР.З.
Насыщенные алифатические углеводороды + 0,5
Насыщенные кетоны, спирты, простые и сложные эфиры
жирного ряда + 0,5
Циклические насыщенные углеводороды с бензольным
кольцом (за исключением бензола и первых членов ряда) + 0,5 Соединения с тройной связью в прямой цепи – 0,5
Амины жирного ряда – 1,0
Анилин и его производные – 1,0
Ангидриды кислот – 1,0
Циклические соединения, содержащие в боковой цепи группу NO2 – 1,0
Соединения с группой NO2 в прямой цепи – 1,0
Соединения с двойной или тройной связью вместе с активными
элементами или группой (Cl, Br, F, NO2, ОН) в прямой цепи – 1,0
Вещества, содержащие эпоксигруппу – 1,5
Фосфорорганические соединения – 1,5
Альдегиды – 1,5
Соединения, отщепляющие группу CN – 2,0
Расчет ПДКР.З. по биологической активности химических связей
Для расчета ПДК веществ, находящихся в одних и тех же гомологических рядах с уже нормированными веществами, предложено применять математическую зависимость. Предложенное уравнение учитывает гомологический ряд соединений, его молекулярный вес и биологическую активность Ji (в л/мМ) химических связей атомов в молекуле нормируемого вещества:
ПДКР.З. = 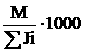 . (25)
. (25)
В табл. 4 приведены значения Ji для разных рядов соединений, вычисленные как средние величины из данных по нормированным гомологам. Для определения SJi нормируемого соединения необходимо наряду с использованием связи конкретного гомологического ряда включать и связи, общие для многих гомологических рядов (например, –С–Н, –С–С и др.).
Наличие дифференцированных величин J в различных рядах (даже и для одних и тех же связей) позволяет учитывать специфику действия веществ.
Таблица 4
Значения биологической активности химических связей
нормированных соединений различных гомологических рядов
|
Химические связи |
л/мМ |
Ряды соединений |
|
|
0,8 |
Предельные, непредельные, циклические, нециклические углеводороды |
|
|
51,4 |
Предельные нециклические углеводороды |
|
(сопряженная связь) |
242,4 |
Непредельные нециклические углеводороды |
|
(связь обычная) |
451,8 |
Непредельные нециклические углеводороды |
|
|
2097,1 |
Непредельные нециклические углеводороды с тройной связью |
|
|
318864,8 |
Неорганические амины |
|
|
4817,6 |
Гетероциклические соединения |
|
|
9635,2 |
Гетероциклические соединения |
|
|
1400,0 |
Оксид углерода |
|
|
213,8 8753,8 |
Предельные кетоны Циклические непредельные кетоны |
|
|
21273,9 |
Предельные альдегиды (у карбонильной группы) |
|
|
112517,8 |
Предельные альдегиды (у карбонильной группы) |
|
|
8507,9 – 21648,2 100223,6 – 5214,5 |
Органические кислоты Одноатомные предельные спирты Непредельные спирты Ароматические спирты |
|
|
68,1 6535,3 10306,9 |
Алифатические простые эфиры Сложные эфиры предельных спиртов Сложные эфиры непредельных спиртов |
|
|
1644538,3 |
Алифатические изоцианиды и ароматические изоцианиды |
|
|
2230,0 |
Оксиды азота |
|
|
4460,6 |
Оксиды азота |
|
|
– 6242,7 154446,6 119027,8 27970,0 77851,5 66442,0 |
Нитросоединения алифатического ряда Нитросоединения алифатического ряда из тетранитрометана Циклические мононитросоединения Ароматические мононитросоединения Ароматические динитросоединения Ароматические тринитросоединения |
|
|
283.8 |
Аммиак |
|
|
97856,8 |
Цианиды |
|
|
6113,5 1565,7 3266,2 35914,6 97551,4 33302,0 16680,8 |
Первичные алифатические амины Вторичные алифатические амины Третичные алифатические амины Алифатические диамины Циклические амины Ароматические амины Амиды |
ОРГАНИЗАЦИЯ И СОДЕРЖАНИЕ ТОКСИКОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Стадии токсикологической оценки производства
Проблема защиты биосферы должна решаться комплексно при участии представителей самых разных специальностей, прежде всего химиков и технологов, токсикологов и экологов, а также специалистов смежных отраслей.
Создание производства нового, необходимого для народного хозяйства вещества всегда подразумевает одновременную работу химиков и токсикологов. Токсикологическая оценка технологического процесса в химической, нефтехимической, фармацевтической и других отраслях промышленности является одной из важнейших сторон профилактической токсикологии. Токсикологическая экспертиза (первичная токсикологическая оценка), стандартизация сырья и продуктов по признакам биологической опасности, токсикологическое ограничение (гигиеническое нормирование) содержания веществ в объектах внешней среды, а также другие аналитические методы служат основой для суждения об опасности технологического процесса в целом. Токсикологическая оценка структуры химического технологического процесса является частью общей гигиенической оценки. В отличие от последней анализу подвергаются, главным образом, химические факторы производственной среды: исходные, промежуточные и конечные продукты, возможные побочные вещества. Схема стадий технической разработки и токсикологической оценки технологии представлена в табл. 5.
Таблица 5
Схема стадий разработки технологического процесса
и его токсикологической оценки
|
Стадии химической и технологической разработки |
Стадии токсикологической оценки |
Содержание токсикологических исследований |
|
1. Теоретический проект технологической схемы 2. Лабораторная разработка технологической схемы 3. Полузаводская установка 4. Проектирование заводского производства 5. Заводское производство (применение) |
А. Предварительная токсикологическая оценка Б.Токсикологическая экспертиза В.Токсикологическая паспортизация Г. Полная токсикологическая оценка Д. Дополнительные токсикологические исследования Е. Натурные исследования |
Анализ литературы о токсичности и опасности предполагаемого сырья, реагентов, катализаторов, полупродуктов, продуктов и побочных веществ. Расчет параметров токсикометрии на основе известныхсопоставлений химической структуры, химических и физическихсвойств с биологическим действием, интерполяций и экстраполяций в рядах соединений. Острые и подострые опыты на животных. Токсикологические испытания технологических образцов. Хронические опыты на животных. Изучение отдаленных эффектов. Обследование работающих. Формулирование медико-технических требований для проектирования заводского производства. Изучение механизмов действия, ранней и дифференциальной диагностики, экспериментальная терапия и др. Исследование условий труда (быта), состояния здоровья работающих. Статистические (эпидемиологические) исследования. Клиническая апробация экспериментальной профилактики, диагностики, терапии. Корректировка медико-технических требований к производству. |
Предварительная токсикологическая оценка
Токсикологическая оценка технологического процесса начинается с рассмотрения возможных теоретических схем синтеза вещества, изучения кинетики соответствующих реакций. На базе данных литературы о токсичности и опасности предполагаемых исходных, промежуточных, конечных продуктов и примесей даются конкретные рекомендации по замене более токсичных и более опасных веществ менее токсичными и менее опасными. В случае отсутствия данных приблизительные значения получают либо путем их вычисления (известные корреляции между химической структурой, физическими и химическими свойствами, с одной стороны, силой и характером биологического действия, с другой, экстраполяции или интерполяции в рядах близких по строению соединений), либо экспериментальным путем (наиболее простые острые опыты), хотя проведение последних предусмотрено на II стадии токсикологической оценки.
Полная токсикологическая оценка
Полная токсикологическая оценка технологического процесса предполагает исчерпывающую оценку его компонентов. Она, как и токсикологическая паспортизация, приурочивается к полузаводскому производству или опытному варианту применения нового вещества.
Наиболее важен хронический эксперимент на животных – этап наиболее трудоемкий и наиболее ценный с точки зрения токсикологии. Сроки хронического эксперимента на разных направлениях профилактической токсикологии весьма различны – от трех месяцев непрерывного ингаляционного воздействия до двух лет прерывистого воздействия. Для того чтобы иметь лучшие основания для переноса результатов опыта на человека, следует подчеркнуть, что опыты должны одновременно ставиться на нескольких видах лабораторных животных, главным образом, на мелких грызунах и кошках (собаках); предлагаются также карликовые породы свиней.
Выводы этих экспериментов очень ответственны, ибо завышение санитарных стандартов на содержание веществ (ПДК), как известно, приводит к еще не полностью оцененному ущербу для здоровья людей, а занижение – к неоправданным экономическим потерям.
Проблема видовых различий в чувствительности к ядам, иными словами, проблема использования данных эксперимента на животных, в санитарной практике во многом остается нерешенной.
Хронический эксперимент должен проводиться в хорошо оборудованных учреждениях. Большую экономию времени и средств может дать совмещение хронического эксперимента разной длительности для решения задач профессиональной и коммунальной гигиены. Практическими результатами всех этих исследований, помимо указанных ранее, являются ПДК, программы периодических медицинских осмотров и др.
Токсикологическая паспортизация
С целью обобщения данных для формулирования медико-технических требований к проектированию заводского производства (применения) веществ предложен единый документ – токсикологический паспорт, который предполагается как составная часть для включения в регламенты, ТУ и ГОСТ на новые вещества и процессы.
Необходимые данные получают во время отработки технологических режимов на полузаводских установках. В это время возможно дать биологическую характеристику реальному сырью, реальной продукции и побочным соединениям (например, остаткам мономеров, растворителям, катализаторам и т. п. соединениям в пластмассах; побочным газообразным и аэрозольным выбросам при термической и термоокислительной деструкции; кубовым остаткам и др.).
Первичный токсикологический паспорт
Данные первичного токсикологического паспорта должны дать полную характеристику вещества, достаточную для обоснованных токсикологических мероприятий.
Ниже приведен бланк токсикологического паспорта нового соединения.
Первичный токсиколого-гигиенический паспорт нового соединения
(название соединения)
I. Область применения вещества:
II. Условия применения вещества:
III. Сведения о физико-химических свойствах и способы химического определения:
1. Эмпирическая формула вещества.
2. Структурная формула вещества.
3. Молекулярный вес.
4. Удельный вес.
5. Точка кипения.
6. Точка плавления.
7. Упругость пара в миллиметрах ртутного столба при 20 °.
8. Насыщающая воздух концентрация в миллиграммах на литр при 20 °.
9. Поверхностное натяжение.
10. Коэффициент преломления.
11. Температура воспламенения.
12. Химическая реакционная способность (гидролиз, окисляемость, способность к полимеризации и т. д.).
13. Растворимость в воде, масле, органических растворителях (весовые проценты).
14. Содержание примесей (наименование веществ) в процентах.
15. Для пылей – дисперсность аэрозоля.
16. Для полимерных материалов:
а) количество остаточного мономера;
б) добавки (наименование, количество их) в процентах;
в) продукты термоокислительной деструкции при различных температурах.
17. Метод химического определения вещества в воздухе, воде и других средах.
IV. Сведения о токсичности вещества с указанием методов исследований в соответствии с «Временными методическими указаниями к постановке экспериментальных исследований с целью установления ПДК вредных веществ в воздухе производственных помещений»:
1. Основные параметры токсичности при различных путях введения (летальность – CL50, DL50, частично смертельные или эффективные концентрации и дозы).
2. Способность к кумуляции.
3. Характер токсического действия в подостром опыте.
4. Действие на кожные покровы и слизистые оболочки глаз и дыхательных путей.
5. Порог запаха и раздражающего действия для человека.
6. Порог вредного действия при однократной экспозиции и однократном введении.
7. Расчет ориентировочной предельно допустимой концентрации по токсическим дозам или концентрациям.
V. Дополнительные сведения о физико-химических свойствах и токсичности данного вещества (экспериментальные и клинико-гигиенические наблюдения).
VI. Список литературы.
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И ИХ СОЕДИНЕНИЙ КАК ТОКСИКАНТОВ
Металлы обнаруживают широкое токсикологическое действие. Они легко взаимодействуют с белковыми макромолекулами, так как ионы металлов высокореакционноспособны, а в белках имеются многочисленные функциональные группы. Некоторые из металлов (например, свинец) оказывают явно выраженное действие на многочисленные органы-мишени примерно в одинаковых дозах. В таких случаях наиболее чувствительный орган (его называют критическим) бывает трудно идентифицировать. Другие металлы имеют более ограниченную токсическую область, и различие чувствительности к ним отдельных органов значительно более заметна. Так, например в случаях кадмия, почка – явно критический орган (хотя и другие органы могут пострадать от кадмия). Металлы отличаются и по схеме метаболизма (например, ртуть в организме подвергается метилированию, превращаясь в очень токсическое соединение: метилртуть).
Большинство людей подвергается действию не одного определенного металла, а смеси мутагенов из окружающей среды. Поэтому чрезвычайно трудно бывает порой установить связь между нарушением здоровья человека и каким-то одним из многих компонентов, находящихся в окружающей среде. Однако можно сделать единственный главный вывод: условия работы в промышленности этих металлов, а также проживания в специфических по металлам местностях может приводить к тяжелым патологиям у человека, и поэтому содержание этих металлов должно строго контролироваться.
Попав в живую клетку, соединение металла первоначально осуществляет некоторую простейшую химическую реакцию, играя роль пускового фактора, на которую затем следует патологический отклик все более сложных биологических молекул и ансамблей молекул, и как конечный результат – введение металла влияет на организм в целом.
Представители всех групп металлов в дозах, превышающих минимальные, отчетливо ядовиты для организма, но если для металла I группы организм более или менее резистентен, то есть имеет определенные молекулярные механизмы, компенсирующие перепады в количествах попадающих в него металлов, то для металлов II и III групп таких механизмов нет, и уже очень небольшие избыточные дозы оказываются фатально неприемлемы.
В целом в отношении почти всех металлов можно утверждать, что они опасны и часто ядовиты. Однако очень быстро выясняется, что активность металлов как ядов в сильнейшей степени зависит от формы, в которой они попадают в живой организм, то есть от физических и химических свойств металлического соединения и, как следствие, от химических реакций, в которые они вступают в организме.
Основа токсического действия лежит в самом общем случае во взаимодействии между металлами и биологически активными белками. И механизм токсичности аналогичен механизму, ответственному за действие металлов. Отрицательный эффект взаимодействия токсичных металлоионов с биологически активными макромолекулами связан следующими процессами:
- вытеснением необходимых металлов из их активных мест токсическим металлом;
- связыванием части макромолекулы, необходимой для нормальной жизнедеятельности организма;
- сшиванием с образованием биологических агрегатов, вредных для организма.
Главными физико-химическими факторами, влияющими на ответ организма по отношению к токсикантам, являются температура, растворенный кислород, рН, жесткость и щелочность воды, присутствие хелатирующих агентов и других загрязнителей в воде. В общем случае чувствительность к металлам понижается с увеличением рН и жесткости воды, а также с падением парциального давления кислорода. Возрастные размеры, питательный статус, акклиматизация – все это важные переменные, определяющие чувствительность животных и растений. Крупные экземпляры более устойчивы к отравлению.
Токсическое действие металлов на организм вызывается и тем, что ионы этих металлов вступают во взаимодействие с различными рецепторами, например с сульфидными SH-группами белков, ферментов, аминокислот. Блокирование SH-групп приводит к подавлению активности ферментов и, как следствие, к нарушениям в организме.
Рассмотрим простейшие химические процессы и по возможности укажем, как они сказываются на свойствах и функционировании биологически важных молекул.
Можно рассмотреть несколько аспектов:
1) целый ряд металлов входит в различные процессы метаболизма, иными словами, эти металлы являются жизненно важными для живых организмов. Так, например, железо и медь являются переносчиками кислорода в организме, натрий и калий регулируют клеточное осмотическое давление, магний, калий и другие активизируют энзимы – биологические катализаторы.
2) много металлов в виде строго конкретных соединений нашло применение в медицине и биологии, в частности, в качестве лекарственных и диагностических средств. Таким образом, для них найдены не только безвредные, но даже и полезные формы существования в живых организмах.
3) некоторые металлы, будучи крайне нежелательными для организмов, проникают туда из естественных природных источников, прежде всего, с водой и пищей, а также из-за промышленного загрязнения окружающей среды.
Транспорт металлов в живую клетку
Для того чтобы металл был вовлечен в химические превращения в клетке и оказал вредное или полезное действие, он должен попасть в клетку. Рассмотрим несколько самых простых способов проникновения катионов металлов в клетку на примере катионов натрия Na+ и калия К+, наиболее слабо связанных с транспортирующими их химическими молекулами. Ионы Na+ и К+ играют важнейшие роли в живых организмах: определяют осмотическое давление по обе стороны мембраны и обеспечивают положительные противоионы для таких анионов, как HPO42-, HCO3-, органических молекул, многие из которых и выступают как анионы.
Основу оболочки клетки создает липидная мембрана местами пронизанная инофорными каналами. Простейшие молекулы липидов представляют собой длинный алкильный радикал (алкановый "хвост") и фосфатную группировку ("головка") на конце. Катион металла Na+, K+, попав к стенке клетки, реализует обычно один из двух путей проникновения в клетку. По ионофорной трубке, взаимодействуя с атомами кислорода полиэфирной стенки, катион, как по рельсам, может попасть внутрь клетки.
Если радиус катиона и его природа не позволяют ему проникнуть в отверстие канала, существует другой способ попадания металла в клетку. Молекулы углеводов, а также некоторые лекарственные препараты дают гидрофобные липорастворимые комплексы, которые просачиваются сквозь мембрану клетки. В настоящее время практически для всех металлов периодической системы известны такие прочные гидрофобные липорастворимые комплексы. В частности, например, молекула диметилртути неполярна, имеет гидрофобные метильные группы и благодаря этому просачивается сквозь мембрану.
Биологические молекулы как эффективные ловушки (лиганды) для связывания металлов
Все основные типы биологических молекул, входящие в состав клетки, являются великолепными лигандами для ионов металлов.
По сути дела, для любого металла в клетке обнаруживаются соответствующие ему лиганды. В зависимости от природы металла образуются комплексы существенно различной прочности.
Например ион бериллия, подавляет активность многих ферментов, активируемых ионом Mg2+ в результате замещения ионов магния в его комплексах с ферментами, нуклеиновыми кислотами и другими биолигандами, содержащими фосфатные группы:

Высокопрочные тетраэдрические комплексы бериллия (sp3-гибридизация орбиталей) с фосфатами хорошо растворимы по сравнению с менее прочными октаэдрическими комплексами магния (sp3d2-гибридизация орбиталей). В результате реакции замещения введенный в организм бериллий выводит из организма в виде прочного комплекса фосфор (фосфатные группы). В свою очередь, это приводит к уменьшению содержания кальция в организме. Таким образом, в результате попадания бериллия в организм возникает заболевание «бериллиевый рахит». Так как приведенная выше реакция является обратимой, введение большого избытка солей магния приводит к смещению равновесия влево (принцип Ле Шателье) и восстановлению активности фермента.
Магний и бериллий являются антагонистами, т. е. добавление одного элемента приводит к вытеснению другого. Именно поэтому при отравлении солями бериллия вводят избыток солей магния. Вследствие токсичности соединения бериллия в медицинской практике в качестве лекарственных средств не применяются.
Соединения бериллия токсичны и вызывают ряд заболеваний (бериллиевый рахит, бериллиоз и т.д.). Особенно токсичны летучие соединения бериллия. Как уже было рассмотрено, отрицательное влияние иона Be2+ на физиологические процессы можно объяснить его химическими свойствами (способностью образовывать прочные связи с биолигандами и хорошей растворимостью фосфатов бериллия).
Наиболее выражено химическое сродство к SН-группам у ртути. Очевидно, это связано с тем, что комплексообразующие свойства ртути выше, и она образует более прочные связи с серой.
Токсичность ртути связана с агглютинацией (склеиванием) эритроцитов, ингибированием ферментов. Например сулема HgCl2, вызывает изменение размеров, осмотическую хрупкость и снижение деформируемости эритроцитов, которая необходима для их продвижения по капиллярам.
Известно, что токсические свойства элементов зависят от той химической формы, в какой они попадают в организм. Наиболее токсичны те формы, которые растворяются в липидах и легко проникают через мембрану в клетку.
Неорганические соединения ртути под действием ферментов микроорганизмов превращаются в метилртуть. Из-за того, что СНзНg+ растворяется в липидах, она накапливается в организме, в том числе и в мозге. Постепенно концентрируясь, метилртуть вызывает необратимые разрушения в организме и смерть.
Токсичность кадмия связана с его сродством к нуклеиновым кислотам. В результате его присоединения к ДНК нарушается ее функционирование.
Хроническая интоксикация кадмием и ртутью может нарушить минерализацию костей. Это связано с близостью ионных радиусов Cd2+, Hg2+ и Са2+. Поэтому токсичные элементы могут замещать кальций. Это приводит к образованию апатита несовершенной структуры вследствие искажения параметров кристаллического компонента костной ткани. В результате снижается прочность костей.
Соединения Zn, Cd, Hg могут вызывать нарушение белкового обмена, что проявляется в выделении белков плазмы через почки (протеинурия).
Избыток бopa вреден для организма человека. Имеются данные, что большой избыток бора угнетает амилазы, протеиназы, уменьшает активность адреналина. Предполагается, что снижение активности адреналина, являющегося производным полифенола, связано с его взаимодействием с ортоборной кислотой.
Таллий – относится к весьма токсичным элементам. Ион Т1+ склонен, подобно Ag+, образовывать прочные соединения с серосодержащими лигандами:
Тl+ + R–SH ® R–S–Tl + Н+.
Вследствие этого он очень токсичен, так как подавляет активность ферментов, содержащих тиогруппы -SH. Даже весьма незначительные количества соединений Тl+ при попадании в организм вызывают выпадение волос.
Свинец и его соединения относятся к ядам, действующим преимущественно на нервно-сосудистую систему и непосредственно на кровь. Химизм токсического действия свинца весьма сложен. Ионы Рb2+ являются сильными комплексообразователями по сравнению с катионами остальных р-элементов IVA-группы. Они образуют прочные комплексы с биолигандами.
Ионы РЬ2+ способны взаимодействовать и блокировать сульфгидрильные группы -SH белков, в молекулах ферментов, участвующих в синтезе порфиринов, регулирующих синтез гема и других биомолекул:
R–SH + РЬ2+ + HS–R ® R–S–Pb–S–R + 2H+.
Токсическое действие соединений серебра, как и в случае меди, обусловлено главным образом тем, что ионы серебра взаимодействуют с тиольными серо- и азотсодержащими группами белков, нуклеиновых кислот и других биоорганических веществ.
В водном растворе существуют только комплексные соли золота, например Na3[Аu(S2O3)2], и различные тиоловые бионеорганические комплексы.
Механизм токсического действия соединений золота аналогичен механизму токсического действия соединений меди и серебра. В соответствии с общим правилом для тяжелых металлов одной группы токсичность возрастает с увеличением атомного номера в ряду: Cu ® Ag ® Аu.
Токсичность соединений IIБ-группы увеличивается от цинка к ртути. Водорастворимые соединения оказывают раздражающее действие на кожу. При попадании внутрь организма вызывают отравление.
В целом на введение чуждого металла или избыточного количества металла, участвующего в процессах метаболизма, в клетке откликается хотя бы один класс биологических молекул. При этом свойства связанных с металлом и несвязанных с металлом биологических молекул различаются столь сильно, что говорить о металлах, к которым живая клетка оказалась бы безразличной, просто не приходится. Различия в структуре и составе клеток, встречающихся в организме, приводят к тому, что металлы распределяются между всеми тканями равномерно.
ОПРЕДЕЛЕНИЕ ТОКСИЧНЫХ КАТИОНОВ, АНИОНОВ И ТОКСИЧНЫХ ОРГАНИЧЕСКИХ ВЕЩЕСТВ МЕТОДОМ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
В лабораторном практикуме предлагается провести качественные реакции обнаружения токсичных катионов, анионов и токсичных органических веществ.
Если в растворе присутствует только одна соль, то её токсичный анион или катион можно обнаружить с помощью каких-либо характерных реакций. Выполнять опыты можно пробирочным или капельным методами. Если же раствор представляет собой сложную смесь ионов, то обнаружение одного из них является более трудной задачей, так как присутствующие в растворе посторонние ионы, вступая в реакцию с реагентом, мешают обнаружению. В этом случае анализ сложных ионов проводят систематическим или дробным методами, известными из курса аналитической химии. Предлагается также обнаружить токсичные органические вещества (анилин, бензол, ацетон).
В лабораторном практикуме предлагается провести опыты по биотестированию летучих неорганических (аммиак) и органических веществ (бензол, ацетон).
Обнаружение токсичных катионов металлов
Обнаружение катионов свинца
Свинец известен давно, и о его токсичности знали уже греческие и арабские ученые. Высокий уровень отравления свинцом отмечался у римлян, поскольку они хранили вина и готовили пищу в свинцовой посуде. Часто от отравления свинцом страдали художники, так как они пользовались свинцовыми красками. Повышенное содержание свинца представляет опасность и для детей, так как они часто соприкасаются с игрушками, окрашенными свинцовыми красителями, играют с использованными батарейками. Свинец плохо смывается с рук и попадает в пищу. Отравление наступает и из-за загрязненного воздуха выхлопными газами автомобилей, которые содержат продукты сгорания тетраэтилсвинца Pb(C2H5)4. Он длительное время добавляется для повышения октанового числа топлива. Адсорбированный свинец аккумулируется в костях, откуда он потом высвобождается по причине остеохондроза. Хроническое отравление приводит постепенно к нарушениям в работе почек, нервной системы, анемии. Считают, что ионы свинца прочно связываются с лигандами, имеющими сульфгидрильные группы.
В настоящее время главными источниками загрязнения окружающей среды свинцом являются: аккумуляторы, керамика, краски, бензин.
Обнаружение токсичного катиона свинца можно выполнить разными способами.
1. Реакция с хроматом калия.
Pb-ионы образуют с K2CrO4 желтый осадок.
Pb2+ + CrO2-4 ® PbCrO4 ¯.
Реакцию следует проводить в слабокислой среде при рН < 7. В щелочной среде осадок растворяется.
PbCrO4 + 4 OH– ® [Pb(OH)4]2– + CrO42–.
Проведению реакции мешает Ag+, Hg2+2, Bi3+ , Ba2+, Sr2+.
2. Реакция с сульфат-ионами.
Pb2+-ионы образуют с серной кислотой или с растворимыми сульфатами белый осадок:
Pb2+ + SO42- ® PbSO4 ¯.
Реакцию следует проводить при рН<7. PbSO4 нерастворим в разбавленных кислотах, но растворим в концентрированной кислоте с образованием гидросульфата Pb(HSO4)2 . В растворах щелочей PbSO4 также растворяется с образованием [Pb(OH)4]2-. Выполнению реакции мешают Ba2+, Ca2+, Hg22+.
3. Реакция с иодидом калия.
Pb2+-ионы образуют с иодидом калия желтый осадок.
Pb2+ + 2J- ® PbJ2 ¯.
Эта реакция катионов Pb2+ позволяет открыть его в присутствии катионов всех аналитических групп.
Обнаружение ионов Ba2+
Один и тот же элемент в зависимости от состояния может быть токсичным и нетоксичным. Так, например, ионы Ba2+ очень токсичны.
Механизм действия солей бария заключается в том, что ионы Ba2+, имея одинаковый радиус с ионом K+, конкурируют с ним в биохимических процессах. В результате такой взаимозамещаемости возникает гипокалемия. Ионы бария могут проникать в костные ткани, вызывая эндемические заболевания (например, болезнь па-пинг). В то же время нерастворимая соль бария BaSO4 не является токсичной и широко используется как контрастное вещество в рентгенологической практике.
1. Реакция с хроматом калия.
Ba2+ ионы с хроматом и дихроматом калия дают желтый осадок, не растворимый в уксусной кислоте.
Ba2+ + CrO4 2- ® BaCrO4 ¯.
При действии дихромата калия количественное осаждение проводят в присутствии ацетата натрия, который связывает ионы водорода, образуя уксусную кислоту:
2Ba2+ + Cr2O42- + H2O ® BaCrO4 + 2H+;
H+ + CH3COO- ® CH3COOH.
Реакцию осаждения BaCrO4 следует проводить в слабокислой среде (рН = 3-6).
2. Реакция с сульфатом натрия.
2-3 капли исследуемого раствора помещают в пробирки, прибавляют 2-3 капли сульфата натрия, при наличии ионов Ba2+ выпадает белый осадок сульфата бария.
Ba2+ + SO42- ® BaSO4 ↓.
Обнаружение катионов цинка
У человека ион Zn2+ входит в состав свыше 20 металлоферментов, включая участвующие в метаболизме нуклеиновых кислот. Большая часть ионов цинка находится в крови (эритроцитах). Большая часть Zn2+ в теле человека находится в его мускулатуре, а самая высокая в половой железе – простате.
Избыток цинка способен замедлить развитие скелета. Высокие концентрации цинка вызывают рвоту и диарею. Имеются сведения по поводу цинкового отравления пищей, приготовленной или хранимой в гальванизированных емкостях, а кадмий, сопровождающий цинк в такой посуде, также способствует нарушению здоровья. Главными источниками загрязнения окружающей среды являются гальваническое производство и производство сплавов.
Выполнение опытов.
1. Реакция с гексацианоферратом (II) калия K4[Fe(CN)6]
Zn2+ - ионы с гексацианоферратом (II) калия образуют белый осадок:
3 Zn2+ + 8 K+ + 2 [Fe(CN)6]4- ® ¯ K2Zn3[Fe(CN)6]2 + 6 K+.
Реакцию проводят в кислой среде (рН < 7). Реакции мешают Fe3+, Cu2+, Cd2+, Hg2+, Ag+ и другие ионы.
2-3 капли исследуемого раствора помещают в пробирку, прибавляют каплю раствора гексацианоферрата (II) калия. В случае присутствия Zn2+ - ионов выпадает белый осадок.
2. Реакция с дитизоном (дифенилтиокарбазоном).
NH – NH – C6H5
/
S = C
\
N = N - C6H5
Zn2+ - ионы с дитизоном в растворе четыреххлористого углерода или хлороформа дают ярко-красное окрашивание.
3. Реакция с гексацианоферратом (III) калия K3[Fe(CN)6].
Zn2+ - ионы с гексацианоферратом (III) калия образуют желтый осадок:
Zn2+ + 3 K+ + [Fe(CN)6]3- ® ¯ KZn[Fe(CN)6] + 2 K+.
Реакцию следует проводить в кислой среде (рН < 7). Выполнению реакции мешают Fe3+, Fe2+, Cu2+, Cd2+- ионы.
Обнаружение катионов стронция
При избытке ионов Sr2+ возникает эндемическая болезнь. Это заболевание было обнаружено у населения, проживающего у реки Уровы в Восточной Сибири. Характерными особенностями болезни являются размягчение и искривление костей. Анализ почвы этой местности показал повышенное содержание в ней стронция. Вследствие этого в костной ткани происходило вытеснение ионов кальция ионами стронция, который не способен выполнять функции ионов Ca2+.
Образующийся при ядерных взрывах радиоактивный изотоп 90Sr вызывает лучевую болезнь. Накопление 90Sr в организме человека способствует развитию лейкемии и рака костей. Применение кислоты – этилендиаминтетраацетата (ЭДТА) для удаления ионов 90Sr2+ из организма приводит к дополнительному вымыванию кальция из костей. Поэтому в настоящее время в этих целях используют не кислоту, а ее комплекс Na2CaЭДТА.
Обнаружение катионов стронция можно обнаружить реакцией с серной кислотой, растворимыми сульфатами. (Na2SO4, K2SO4, (NH4)2SO4).
Sr2+ + SO42- ® SrSO4 ↓.
Обнаружение катионов кадмия
При отравлении кадмием у людей может возникнуть болезнь «итан-итан» (в переводе с японского языка «ох-ох»). Человек заболевает остеомаланией, возникает сильнейшая боль от множественных переломов. Отравление наступает в результате питания рисом, который поливали водой, загрязненной кадмием, свинцом и цинком, попавшими туда из цинковых разработок. Как следствие происходит загрязнение катионами металлов зерна в этом районе.
Главными источниками загрязнения окружающей среды кадмием являются гальваническое производство, производство сплавов, изготовление табачных изделий.
Катион кадмия можно обнаружить реакцией с сероводородом или его солями.
Cd2+ + S2- ® CdS ¯.
Обнаружение катионов кобальта
Кобальт известен как необходимый компонент витамина В12. Недостаток его в организме имеет следствием анемию и остановку роста. Избыток Co2+ уменьшает способность щитовидной железы аккумулировать йод, т.е. зобная болезнь может быть следствием приема избыточного количества солей кобальта при анемии.
Обнаружение катионов кобальта можно осуществить с помощью следующих реакций:
1. Реакция с нитритом калия KNO2.
Co2+ - ионы в уксусной среде образуют с нитритом калия желтый кристаллический осадок гексанитро-кобальтата (III). калия.
Эту реакцию можно представить следующим образом:
Co(NO3)2 + 7 KNO2 + 2 CH3COOH ® K3[Co(NO2)6] ¯ + NO + 2 KNO3 + + 2 CH3COOK + H2O;
Co2+ - e ® Co3+; (окисление, восстановитель)
NO2- + e + 2H+ ® NO + H2O; (восстановление, окислитель)
Co3+ + 6 NO2- + 3 K+ ® K3[Co(NO2)6].
Суммарно в ионной форме:
Co2- + 7 NO2- + 3 K+ + 2 H+ ® K3[Co(NO2)6] ¯ + NO + H2O
Реакцию следует проводить в уксусной среде при рН=3.
2. Реакция с роданид-ионами.
Co2+ - ионы SCN- - ионами образуют комплексные [Сo(SCN)4]2+ - ионы синего цвета. Реакция идет быстро и до конца в присутствии избыточного количества SCN- - ионов в слабокислой среде, при рН = 4–8. Реакции мешают Fe3+ – ионы, придающие кроваво-красную окраску раствору.
Обнаружение катионов никеля
Обычно уровень никеля в окружающей среде невелик. Никелевые сплавы и стали представляют собой главный источник кожного поражения. О токсичности никеля ходят противоречивые сведения. Однако преобладает гипотеза, что ион никеля – канцероген, а недоступность и, возможно, внутриклеточная доставка его являются определяющими факторами. Именно на летучести карбонила никеля основан процесс очистки этого металла, а Ni(CO)4 липофилен, и это в известной степени определяет его токсичность. Он вызывает поражение легких (это его основная мишень).
Главными источниками загрязнения окружающей среды никелем являются аккумуляторы, производство сплавов, гальваническое производство.
Характерных общеаналитических реакций на катионы никеля не имеется. Обнаружение не всегда производится специфическими реакциями, из которых наиболее распространенной и общепринятой является реакция Чугаева.
В результате этой реакции образуется внутрикомплексная соль диметилглиоксимата никеля, обладающая характерной ало-красной окраской.
Эта реакция протекает легко в аммиачной среде, когда никель предварительно переведен в комплексный ион - аммиакат. Проводится она следующим образом. К небольшой порции раствора соли никеля приливают раствор NH3 до полного растворения образующегося вначале осадка основной соли никеля, затем – несколько капель диметилглиоксима. В результате из раствора выпадает ало-красный осадок комплексной соли.
NiCl2 + 6 NH4OH = [Ni(NH3)6]Cl2 + 6 H2O;
[Ni(NH3)6]Cl2 + 2 (CH3CNOH)2 + 4 H2O =
= (CH3СNО)2 Ni(HONCCH3)2 + 2 NH4 Cl + 4 NH4OH.
Остальные катионы шестой группы не мешают открытию Ni2+ этой реакцией. Если же в растворе содержится значительное количество катионов меди, то эти катионы, образуя с избытком раствора NH3 интенсивно лазурно-синюю окраску раствора, маскируют осадок диметилглиоксилата никеля, так как ало-красная окраска его выступает при этом не рельефно, особенно при малых концентрациях Ni2+. Однако при некотором навыке в работе катионы никеля обнаруживаются этим реактивом сравнительно легко при наличии Cu2+ в растворе, так как яркий ало-красный цвет комплексной соли никеля можно заметить и на фоне лазурной окраски раствора. Если же при этом возникает неуверенность в наличии катиона никеля, то ионы Cu2+ рекомендуется из раствора удалить. Для этого к раствору смеси катионов шестой группы приливают едкой щелочи и нагреванием переводят гидроксид меди Cu(OH)2 в окись меди CuO (черного цвета), которая в растворе NH3 практически нерастворима. После этого осадок отфильтровывают, промывают на фильтре два-три раза и обрабатывают раствором NH3. При этом основная часть переходит в раствор в форме соответствующих аммиакатов.
Из катионов других групп этой реакции мешают только катионы двухвалентного железа, которые с диметилглиоксимом дают красное окрашивание. Однако Fe2+ легко превратить в Fe3+ окислением перекисью водорода.
Обнаружение катионов алюминия
Катион Al3+ вызывает неврологическое заболевание и энцефалопатию (некоторые авторы связывают болезнь Альцгеймера именно с избытком Al3+ в мозгу). Отравление алюминием может вызвать и специфические костные заболевания.
Главными источниками загрязнения окружающей среды алюминием являются кабельное производство, сточные воды алюминиевого производства, алюминийсодержащие лекарственные препараты. Водопроводная вода содержит либо природный алюминий, либо попавший в результате использования его солей, например, Al2(SO4)3 в качестве коагулянта в процессе водоочистки.
Катионы алюминия можно обнаружить следующими реакциями:
1. Реакция с водным раствором NH3 × H2O.
Al3+ - ионы с растворами NH3 × H2O образуют малорастворимый гидроксид алюминия Al(OH)3 белого цвета, растворимый в избытке едких щелочей:
Al3+ + 3OH- ® Al(OH)3 ¯;
Al(OH)3 + OH- ® [Al(OH)4]- ® AlO2- + 2 H2O
или
Al(OH)3 + 3 OH- ® [Al(OH)6]3- ® AlO33- + 3 H2O.
Гидроксид алюминия, согласно указанным уравнениям реакции, ведет себя в отношении щелочей как кислота. Поэтому взаимодействие Al(OH)3 со щелочами может быть представлено также в следующем виде:
H3AlO3 + 3 OH- ® 3 H2O + AlO33-.
Na3AlO3 + 3 NH4Cl ® Al(OH)3 + 3 Na+ + 3 NH3 + 3 Cl-.
2. Реакция с ализарином или его производными.
Ализарин и некоторые его производные образуют в аммиачной среде с катионом Al3+ труднорастворимое соединение ярко-красного цвета, называемое алюминиевым лаком.
Так, Al(OH)3 с ализарином S (с натриевой солью 1,2-диоксиантрахинон-3-сульфокислоты) образует внутрикомплексную соль красного цвета, нерастворимую в уксусной кислоте.
Ионы Bi3+, Fe3+, Cu2+ мешают этой реакции, так как тоже образуют окрашенные осадки.
3. Реакция с алюминоном.
В этом случае образуется комплексное соединение алюминия с алюминоном, окрашенное в кислых средах в красный цвет.
Обнаружение катионов меди
Медь является необходимым кофактором для нескольких ферментов, катализирующих разнообразные окислительно-восстановительные реакции. Дефицит ее приводит к анемии, плохому состоянию костной и соединительной тканей, а также к потере пигментации волос. Возможно, что прием Zn2+, например, в пилюлях, может вызывать медный дефицит.
Медь в обоих валентных состояниях, Cu(I) и Сu(II), хорошо связывает сульфгидрильную группу в глутатионе и серосодержащих белках. Сu (II) окисляет незащищенную сульфгидрильную группу до дисульфидной, сама восстанавливаясь до Cu(I), поэтому организм должен связать Си (II) прежде, чем состоится окисление сульфгидрильной группы.
Значительное количество меди, попавшей в желудочно-кишечный тракт, раздражает нервные окончания в желудке и кишечнике и вызывает рвоту. А хронический избыток меди ведет к остановке роста, гемолизу и низкому содержанию гемоглобина, а также к нарушению тканей в печени, почках, мозге. Отмечается недостаток церулоплазмина у большинства пациентов, страдающих болезнью Вильсона, – врожденным дефектом метаболизма. Такие пациенты обнаруживают в печени наряду с ее дисфункцией повышенные уровни меди.
Главными источниками загрязнения окружающей среды медью являются кабельное производство, электроника, гальваническое производство.
Обнаружение катионов меди можно провести с помощью следующих реакций:
1. Реакция с водным раствором аммиака NH4OH.
Катионы меди Cu2+ в избытке раствора аммиака переходят в комплексный ион [Cu(NH3)4]2+ лазурно-синего цвета. Особенно интенсивная окраска с нитратом меди. Если избыток NH4OH прилить к сульфату меди, то окраска аммиаката меди получится бледной, но при добавлении HNO3 она усиливается.
2. Реакция с роданидом калия или аммония.
С роданидом калия или аммония катионы Сu2+ образуют черный осадок роданида двухвалентной меди Cu(CNS)2, который с течением времени постепенно белеет вследствие разложения его на родан (CNS)2 и роданид одновалентной меди CuCNS. Осадок роданидов меди Cu(CNS)2 и CuCNS в избытке KCNS нерастворим. Другие катионы шестой группы не мешают открытию Сu2+ этой реакцией, т.к. катионы кадмия и кобальта осадка при этом не образуют, а осадки роданидов никеля и ртути в избытке реактива легко растворяются.
Предельная открываемая концентрация катионов Сu2+ этой реакцией меньше 1 мг/л.
3. Реакция с иодидом калия.
Йодид калия восстанавливает ионы двухвалентной меди с образованием осадка йодида одновалентной меди Cu2J2 (белого цвета), который выделяющимся при этом свободным йодом окрашивается в бурый цвет:
CuSO4 + 2 KJ = CuJ2 ↓ + K2SO4;
и далее
2 CuJ2 = Cu2J2 ↓ + J2.
4. Восстановление Сu2+ до металлической меди.
Если раствор, содержащий катионы меди, подкислить серной кислотой и поместить в него алюминиевую, цинковую или железную пластинку, через некотороевремя пластинка покроется красноватым налетом металлической меди: Cu2+ +Zn = Сu ↓ + Zn2+.
5. Реакция с гексаноцианоферратом (II) калия K4[Fe(CN)6].
Cu2+ – ионы с гексацианоферратом (II) калия образуют темно-красный осадок Cu2[Fe(CN)6].
6. Реакция с тиосульфатом натрия.
Сu2+ - ионы с тиосульфатом натрия в кислой среде при нагревании образуют черный осадок Cu2S:
2 Cu2+ + 3 S2O32- + Н2O ® Cu2S ↓ + S4O62- + SO42- + 2 H+;
Cu2+ + e- ® Cu1+;
2 S2O32- → S4O62- + 2e-.
10-15 капель исследуемого раствора помещают в пробирку, прибавляют 2н. раствор серной кислоты до явно кислой реакции (рН = 2) и 2-3 кристаллика тиосульфата натрия, полученную смесь нагревают почти до кипения. В случае присутствия Cu2+-ионов образуется черный осадок. Проведению реакции мешают Hg2+-ионы.
Обнаружение катионов ртути
Ртуть – один из наиболее хорошо изученных токсикантов. Основной путь поступления в организм – ингаляционный. Возможны острое и хроническое отравления ртутью, однако наиболее часто встречаются хронические отравления, вызванные длительным поступлением в организм небольших количеств ртути. Выведение ртути из организма происходит очень медленно, поэтому при поступлении даже очень небольших количеств происходит накопление ее в организме. При этом поражаются многие жизненно важные органы и системы: печень, почки, нервная и эндокринная системы.
Потенциальными источниками ртутного загрязнения могут быть бытовые и промышленные ртутьсодержащие приборы (термометры, тонометры), промышленные ртутьсодержащие отходы (люминесцентные лампы, отслужившие свой срок), полезные ископаемые, содержащие ртуть (например, уголь), производство щелочи, хлора, добыча золота, электроника, катализаторы.
Опасные соединения ртути обнаруживаются во всех трех средах обитания живых организмов. Анализ круговорота показал, что в нем значительное место занимает метилртуть, то есть простейшее органическое соединение ртути, чрезвычайно опасное для живых организмов. Интересно, что метилртуть образуется из природных соединений, поступающих в живые организмы. Так, один из коферментов метилирует ртуть, давая MeHg+.
Органические производные ртути, такие как хлорид метилртути CH3HgCl, высокотоксичны из-за их летучести. Микроорганизмы в загрязненной воде, содержащей ртуть, легко переводят неорганические соединения ртути в монометилртуть CH3Hg+. И большая часть ртути в организме рыб находится именно в этой форме, которая может сохраняться годами. Высокие уровни CH3Hg+, по-видимому, для рыб не столь токсичны, как для человека, у которого при вдыхании паров или поступлении с пищей ионы CH3Hg+ активно абсорбируются и попадают в эритроциты, печень и почки, оседают в мозге (в том числе и мозге плода), вызывая серьезные кумулятивные необратимые нарушения центральной нервной системы. В человеческом организме время полужизни ртути составляет от нескольких месяцев до нескольких лет. Токсический эффект может быть скрытым, и симптомы отравления могут проявиться только лишь через несколько лет.
Катионы ртути обнаружить с помощью следующих опытов:
1. Реакция образования сульфида ртути HgS.
Если к раствору солей ртути прилить соляной или серной кислоты и через этот раствор, подогретый до 60-80 °С, пропустить сероводород или прилить к нему сероводородной воды, или же добавить к нему раствор тиосульфата натрия Na2S2O3 , прокипятить, то во всех случаях из раствора выпадает черный осадок HgS.
Эта реакция настолько чувствительна, что ею открываются ничтожные следы катионов ртути. Из катионов шестой и других аналитических групп этой реакции мешают катионы Cu2+, Bi3+, Ag+, Pb2+ которые с указанными реактивами в кислой среде тоже образуют черные осадки соответствующих сульфидов. Однако в отличие от Hg2+ сульфиды меди, висмута, серебра и свинца сравнительно легко переходят в раствор при действии на них разбавленной азотной кислотой при нагревании. Таким образом, если к осадку HgS, CuS, Bi2S3 и PbS прилить разбавленной HNO3, то после 5-10 – минутного нагревания (не до кипения) в осадке останется только сульфид ртути.
2. Реакция с иодидом калия.
С иодидом калия катионы Hg2+ образуют ярко-красный осадок иодида ртути HgJ2. Однако последний в избытке KJ чрезвычайно легко растворяется, переходя при этом в очень устойчивую комплексную соль состава K2[HgJ4]:
Hg(NO3)2 + 2 KJ = HgJ2 ¯ + 2 KNO3;
HgJ2 + 2 KJ = K2[HgJ4].
Водный раствор K2[HgJ4] бесцветный. Константа неустойчивости йодно-ртутного комплекса чрезвычайно мала (5×10-31), а произведение растворимости HgJ2 равно 6,8 × 10–13. Следовательно, из растворов солей двухвалентной ртути при действии на них раствором KJ практически получить осадок HgJ2 не представляется возможным, так как в момент своего образования он тотчас же переходит в более устойчивый комплексный ион [HgJ4]2–. Однако применяя микроспособы, эта реакция может быть использована для открытия Hg2+ в присутствии почти всех катионов любой аналитической группы.
Обнаружение катионов хрома
Хром встречается в окружающей среде главным образом в виде элементного хрома, соединений трехвалентного Cr(III), либо шестивалентного Cr(VI). Хромовая руда – хромит содержит 38% этого металла. Соединение хрома чрезвычайно широко используется в промышленности: производство сплавов, гальваническое производство (хромирование), использование в качестве протравы в текстильной промышленности при окраске тканей, дубильное производство, использование в качестве катализаторов.
В окружающей среде трех- и шестивалентный хром легко взаимно превращаются.
В лабораторной практике трехвалентый хром можно обнаружить по образованию гидроксида хрома зеленого цвета по реакции.
Cr3+ + 3OH– → Cr(OH)3
Шестивалентный хром с дифенилкарбазидом дает комплексное соединение красно-фиолетового цвета.
Обнаружение токсичных анионов (нитрит- и нитрат-ионов)
Нитриты могут накапливаться в больших количествах в воде, почве и пищевых продуктах из-за интенсивного использования азотосодержащих соединений в качестве удобрений, а также из-за выхлопных газов автомобилей и работы промышленных предприятий (например, текстильного, фармацевтического, лакокрасочного).
Нитраты служат консервантами в пищевой промышленности, в производстве взрывчатых веществ, для получения ракетного топлива, пиротехнических средств и в производстве красителей.
Серьезную опасность для человека представляют нитраты и нитриты, применяемые для консервирования продуктов.
В желудочно-кишечном тракте часть нитратов всасывается в неизменном виде, другая часть в зависимости от микроорганизмов, рН и т.д. претерпевает различные процессы биотрансформации, например, она восстанавливается в еще более токсичное вещество: нитриты, аммиак, гидроксиламин. В желудочно-кишечном тракте из нитритов могут образовываться нитрозоамины, которые обладают высокой мутагенной и канцерогенной активностью.
Обнаружение анионов NO2- и NO3- проводят с помощью окислительно-восстановительных реакций.
Обнаружение нитрит-иона
1. Реакция с иодидом калия.
NO2– – ионы окисляют йод ионы в кислой среде в элементарный йод. Выделившийся йод окрашивает крахмал в синий цвет:
2 J– + 2 NO2– + 4 H+ = J2 + 2 NO + 2 H2O.
2. Реакция с перманганатом калия.
NO2– – ионы в кислой среде восстанавливают MnO4- - ионы до Mn2+ - ионов:
5 NO2 + 2 MnO4– + 6 H+ = 5 NO3– + 2 Mn2+ + 3 H2O.
В присутствии NO2– - ионов малиновая окраска MnO4- - ионов обесцвечивается.
Реакции нитрат-иона
1. Реакция с металлическим цинком.
NO3– – ионы восстанавливаются металлическим цинком в щелочной среде до аммиака:
NO3- + 4 Zn + 7 OH- = NH3 + 4 ZnO22- + 2 H2O.
Выделяемый аммиак окрашивает фильтровальную бумагу, смоченную фенолфталеином, в красный цвет.
Обнаружение токсичных органических веществ (анилина, фенола, ацетона)
Анилин – бесцветная маслянистая жидкость, с плотностью 1,02220/4 г/см3, с температурой кипения 184,4 °С, плохо растворяется в воде, хорошо в этаноле, эфире, бензоле. Анилин оказывает парализующее действие на сосудистую и нервную системы, отравляет кровь.
Главными источниками загрязнения окружающей среды анилином являются сточные воды производства красителей, некоторых фармпрепаратов и промежуточных органических веществ.
Анилин можно обнаружить тремя путями:
1) через образование основного азокрасителя путем диазотирования и азосочетания;
2) через образование симм.триброманилина;
3) через образование анилинового черного красителя путем окисления анилина.
1. Образование азокрасителя идет в две стадии. На первой стадии путем диазотирования анилин превращается в соответствующую соль диазония – фенилдиазонийхлорид. На второй стадии при помощи реакции азосочетания с диметиланилином получают азокраситель.
Диазотирование анилина проводят с помощью азотистой кислоты, которую получают из её солей при взаимодействии с минеральными кислотами (например, взаимодействием нитрит натрия NaNO2 c HСl). Процесс ведут при низкой температуре так как азотистая кислота при комнатной температуре разлагается, а соль диазония тоже устойчива только при низкой температуре.
Ход реакции:
![]() ;
;
![]() ;
;
солянокислый анилин
![]() .
.
хлористый фенилдиазоний
б) образование основного азотокрасителя идет с помощью реакции азосочетания.
Его получают при низкой температуре. Можно азокраситель синтезировать непосредственно на бумаге или ткане методом ледяного крашения.
(C6H5–N≡N)+ Cl- + C6H5–N(CH3)2 → C6H5–N=N–C6H4–N(CH3)2 + HCl.
2. Окисление анилина.
Реакцию проводят взаимодействием анилина с сильным окислителем – хромовой смесью, представляющей собой смесь бихромата калия с серной кислотой. Смесь при этом окрашивается в темно-зеленый цвет и, наконец, становится черной в результате окисления анилина и образования анилиночерного красителя.
3. Образование симм.триброманилина.
Реакцию проводят с раствором бромной воды. В пробирку с 0,5 мл анилина добавляют 5 мл воды, взбалтывают и прибавляют равный объем бромной воды. Выделяется 2,4,6-триброманилин в виде масла, быстро затвердевающего. Легкость образования триброманилина объясняется подвижностью атомов водорода в 2,4,6-положениях, обусловленном наличием аминогруппы в бензольном ядре.
Реакция чувствительная (0,9 мкг в пробе) и положена в основу одного из методов количественного определения анилина. Как качественная реакция она не специфична для анилина, так как муть или мелкий осадок с бромной водой могут давать и фенолы, и другие соединения. Поэтому наряду с данным методом обнаружения анилина рекомендуется пользоваться и другими.
Фенол – твердое кристаллическое вещество с характерным запахом, плохо растворим в воде, хорошо растворим в хлороформе, этиловом спирте, маслах. На воздухе краснеет вследствие окисления.
Отравление фенолом протекает бурно, ощущается запах фенола изо рта. Поражается желудочно-кишечный тракт, внутренние органы, ткани мозга.
Главными источниками загрязнения окружающей среды фенолом является производство фенолфомальдегидных смол, сточные воды нефтехимического производств.
1. Взаимодействие фенола с бромом.
Бромирование фенола в водной среде протекает значительно быстрее и в более мягких условиях, чем для бензола, так как гидроксильная группа –ОН относится к числу наиболее сильных электродонорных заместителей (I рода).
При взаимодействии раствора фенола с бромной водой (в избытке) выделяется хлопьевидный белый осадок 2,4,6-трибромфенола.
2. Цветная реакция на фенол.
В пробирку с 2 мл однопроцентного водного раствора фенола прибавляют несколько капель однопроцентного раствора хлорного железа. При этом получается фиолетовое окрашивание комплексного соединения железа с фенолом.
Ацетон – представляет собой бесцветную прозрачную жидкость, легче воды, плотность 0,79 г/см3 , со специфическим запахом, температурой кипения 56,5 0С. Смешивается во всех соотношениях с водой, спиртом, хлороформом и большинством эфирных масел.
Главными источниками загрязнения окружающей среды ацетоном является производство органического стекла, предприятия химчистки, производство пластификаторов, нефтехимического производство.
Обнаружение ацетона.
Ацетон можно обнаружить двумя путями: 1) переводом его в йодоформ; 2) качественной реакцией с нитропруссидом натрия.
1. Открытие ацетона посредством перевода его в йодоформ (проба Либена).
Процесс идет в соответствии с реакциями:
1) I2 + NaOH ® NaOI + NaI + H2O;
2) CH3–CO–CH3 + NaOI → I3C–CO–CH3 + 3 NaOH;
ацетон трииодацетон
3) I3C–CO–CH3 + NaOH → CH3I + CH3–COONa.
йодоформ
Иодоформная проба на ацетон очень чувствительна и позволяет открыть ацетон в водных растворах уже при содержании его около 0,04 %.
2. Цветная реакция на ацетон с нитропруссидом натрия (проба Легаля).
При взаимодействии ацетона с нитропруссидом натрия появляется красное окрашивание, которое от добавления 1 капли уксусной кислоты усиливается, принимая вишнево-красный оттенок. Реакция очень чувствительная.
Цветная реакция с нитропруссидом натрия (проба Легаля) служит дополнением к иодоформной пробе на ацетон (проба Либена) и широко применяется в медицинской практике при анализе мочи у больных сахарным диабетом.
Биотестирование летучих токсичных веществ
Токсичность летучих органических и неорганических веществ можно оценить путем биотестирования по прорастанию семян.
Биотестирование – это ответная реакция организмов, наиболее чувствительных к данному фактору неблагоприятного воздействия окружающей среды. Метод биотестирования с применением семян растений более оправдан, чем применение мелких животных для токсилогических исследований, так как требует меньших затрат времени для получения результатов. К тому же живое вещество наземных экосистем, с которыми, в основном, соприкасается человек, на 99,2 % сосредоточено в растениях.
Контроль во всех случаях ведут по росту семян без применения токсичных веществ. Результаты биотестирования рассчитывают в процентах и определяют, как происходит подавление прорастания семян и рост проростков. В качестве токсичных веществ используют летучие вещества: аммиак, бензол, ацетон.
Для проведения биотестирования на обнаружения токсичных веществ (аммиака, бензол, ацетон) в большие пробирки на дно помещают источники газообразных токсичных выделений (смоченные ватки). Пробирки располагают наклонно, вблизи горлышка каждой кладут сложенный втрое фильтр, который увлажняют 1-2 мл воды и засевают мелкими семенами мака, салата, рыжика и прочими семенами, пробирки закрывают пробками. Через несколько дней производят оценку прорастания семян и роста проростков путем измерения последних.