БИОСИНТЕЗ И СЕКРЕЦИЯ ГОРМОНОВ
За прошедшие несколько десятилетий эндокринологи и специалисты в области клеточной биологии получили массу сведений о процессах, касающихся синтеза гормонов. Накопление этой новой информации было обязано сочетанию ряда факторов: 1 — применению радиоактивных изотопов для метки предшественников и промежуточных продуктов, образующихся в ходе различных путей биосинтеза; 2 — разработке более тонких и чувствительных методик анализа клеточных компонентов и 3 — усовершенствованию клеточных и бесклеточных систем, на которых проводят исследования биосинтеза в условиях in vitro. Помимо этого, непрерывное повышение разрешающей силы трансмиссионного электронного микроскопа в сочетании с разработкой чувствительных иммунохимических, цитохимических и авторадиографических методик выявления субклеточной локализации гормонов и вновь синтезируемых белков позволило получить сведения о точном местоположении синтетических реакций в клетке.
В этой главе рассматривается биосинтез гормонов пяти различных классов: полипептидных и белковых, тиреоидных, катехоламинов, стероидных гормонов надпочечников и стероидных гормонов — производных витамина D. В каждом разделе главы конкретно рассматривается один из этих классов гормонов и освещаются химическая структура гормонов и их интермедиатов, биохимические реакции, протекающие на каждом этапе биосинтеза, субклеточные органеллы, в которых протекают эти реакции и, где возможно, биохимические механизмы регуляции продукции и секреции гормонов.
Не претендуя на всеобъемлющий охват проблемы биосинтеза; и секреции гормонов, мы рассмотрим некоторые стороны путей биосинтеза различных гормонов с указанием на их сходства в различия в отдельных случаях. Не будут даже упомянуты процессы, которые должны встречаться в биосинтезе столь важного класса гормонально-активных соединений, каким являются гипоталамические рилизинг-факторы, поскольку до сих пор об этих процессах ничего не известно. Другим классом соединений, не рассматриваемым в этой главе, являются простагландины. Они обладают важными функциями в качестве местных гуморальных трансмиттеров и подробно анализируются в других обзорах.
Можно лишь удивляться, если не поражаться, столь очевидному разнообразию веществ, выполняющих функции гормонов. Сложность этих веществ колеблется от белковых структур до более простых производных аминокислот. Каждая группа гормонов должна была развиваться независимо от другой, хотя все они действуют вместе, интегрируя необходимые для жизни физиологические функции. При чтении этой главы следует обратить внимание на то, что наше понимание, по крайней мере в описательном смысле, химических структур и реакций, участвующих в. образовании гормонов, достаточно полно. Точно так же идентифицировано большинство субклеточных структур, в которых протекают многие из гормональных реакций. Однако, переходя к клеточным механизмам, принимающим участие в продукции в секреции гормонов и ответственным за регуляцию этих процессов, мы попадаем в область неизвестного. В настоящее время ведутся интенсивные исследования, направленные на выяснение-молекулярной и клеточной основы регуляции биосинтеза гормонов, в надежде на то, что наше невежество в этой области сменится, наконец, пониманием предмета.
БЕЛКОВЫЕ ГОРМОНЫ
Эндокринологи, изучающие биологические функции белковых ж меньших по размеру полипептидных гормонов (менее 100 аминокислотных остатков в цепи), все более интересуются деталями биосинтеза белков, стремясь понять, каким образом регуляция продукции в клетке секретируемого белкового гормона связана с его функцией. Данные исследований синтеза белковых гормонов и других секретируемых белков, полученные за последние несколько лет, показали, что этот процесс включает синтез предшественников, превосходящих размерами окончательные секретируемые молекулы и превращающихся в конечные клеточные продукты путем расщепления в ходе транслокации, протекающей в специализированных субклеточных органеллах секреторных клеток. Прежде чем более подробно описывать этапы биосинтеза полипептидных гормонов, целесообразно рассмотреть различные этапы биосинтеза белка вообще.

Рис. 3—1 Схема синтеза белка, демонстрирующая этапы переноса генетической информации от ДНК к РНК и белку. Схема специально предусматривает путь биосинтеза секретируемых белков, посттрансляционная модификация которых происходит в месте их синтеза в шероховатом эндоплазматическом ретикулуме (ШЭР) (Habener, Potts [4]).
ОБЩИЕ АСПЕКТЫ БИОСИНТЕЗА БЕЛКА
Процессы синтеза белка включают много сложных реакций, с помощью которых информация, исходно закодированная на полинуклеотидном «языке» гена (ДНК) в конце концов будет выражена полиаминокислотным «языком» конечного биологически активного белка. В целях обсуждения эти процессы можно разделить на четыре этапа (рис. 3—1).
1. Транскрипция. Синтез РНК в форме предшественников, обладающих большой молекулярной массой, на матрице ДНК.
2. Посттранскрипционная модификация. Контролируемая модификация РНК, включающая этапы образования мРНК из РНК-предшественника путем вырезания и нового объединения сегментов РНК, равно как и модификации 3-конца РНК за счет полиаденилирования и 5 -конца за счет добавления 7-метилгуанозиновых «колпачков».
3. Трансляция. Сборка аминокислот с помощью специфического взаимодействия антикодонов аминоацилированных тРНК,— «носителей» с соответствующими кодонами мРНК, связанной с полирибосомами, и, наконец, полимеризации аминокислот с образованием полипептидной цепи.
4. Посттрансляционная модификация. Одна реакция или их сочетание, включающее расщепление пептидных связей (превращение биосинтетических предшественников в промежуточные или окончательные формы белка путем протеолитического расщепления), образование аминокислотных производных. (гликозилирование, фосфорилирование) и складывание полученной полипептидной цепи с приданием ей нативной конфигурации.
Последний этап синтеза белка представляет особый интерес в силу того, что такие посттрансляционные модификации могут являться способом, которым клетка различает отдельные классы белков и направляет их в соответствующие области, где они оказывают свое действие [1].
Эта проблема (разделение белков по клеточным пространствам после синтеза) уже много лет привлекает внимание специалистов в области клеточной биологии. Установлено, что типичная эукариотическая клетка за определенное время в процессе цикла синтезирует около 50 000 различных белков [2]. Современные данные свидетельствуют о том, что это множество производимых клеткой различных белков синтезируется общим пулом полирибосом [3]. Каждый вид синтезированных белков направляется в специальное место, где проявляется его специфическая биологическая функция. Например, особые группы белков транспортируются в ядро и другие субклеточные органеллы, где они выполняют функции либо регуляторных белков, либо ферментов, либо структурных белков, участвующих в биогенезе различных органелл, тогда как другие группы белков синтезируются специально на экспорт из клетки (иммуноглобулины, факторы свертывания крови, сывороточный альбумин и белковые или пептидные гормоны). Понятно, что силы, принимающие участие в этом процессе направленного транспорта белков, должны определяться очень сложным сочетанием информационных сигналов. Другими словами, поскольку информация для этого процесса транслокации может заключаться только во всей, либо в части первичной структуры или в конформационных свойствах самого белка, то посттрансляционная модификация (см. рис. 3—1) может играть решающую роль в определении белковой функции. Как только вновь синтезированный белок высвобождается из комплекса мРНК — рибосома — образующаяся цепь, дальнейшая регуляторная роль РНК представляется совершенно невероятной.
Другая проблема, стоящая перед исследователями, работающими в области биосинтеза полипептидных гормонов, заключается в том, каким образом регулируются биосинтетические и секреторные процессы. Исследования регуляторных механизмов ведутся в двух направлениях: 1 — изучение природы клеточных механизмов, — участвующих в сопряжении внеклеточных регуляторных стимулов с внутриклеточными процессами, определяющими изменения образования и высвобождения гормонов; 2 — определение стадии синтеза белка, на которую направлена регуляция, т. е. выяснение происходит она на транскрипционном (и претрансляционном), трансляционном или посттрансляционном уровне.


Рис. 3—2. Типичные продуцирующие белковые гормоны эндокринные клетки, в которых видны субклеточные органеллы. а — Гипофизарный тиротроф (мышь); б — опухоль у мыши. состоящая из тиротропных клеток, сохраняемая путем серийных подкожных трансплантаций мышам с гипотиреозом: в — околощитовидная железа быка: Можно видеть (резко выраженный ШЭР и редкие секреторные гранулы в опухоли из тиротропных клеток (см. рис. 3—26) по сравнению с нормальным гипофизарным тиротрофом (см. рис. 3—2а).
Я — ядро: ШЭР — шероховатый эндоплазматический ретикулум; ПК — пластинчатый комплекс: М — митохондрия; ПМ — плазматическая мембрана; СГ — секреторная гранула; ИСТ незрелая секреторная гранула зсг — зрелая секреторная гранула. Электронная микрофотография Х10000.
СУБКЛЕТОЧНАЯ МОРФОЛОГИЯ КЛЕТОК, СЕКРЕТИРУЮЩИХ БЕЛКОВЫЕ ГОРМОНЫ
В значительной мере благодаря работам Palade и сотр. [3] было получено много сведений относительно морфологии путей используемых клеткой,. синтезирующей белки на экспорт. Некоторые субклеточные морфологические особенности свойственны различным белоксекретирующим клеткам. Такие клетки содержат множество окруженных мембранами органелл: эндоплазматический ретикулум, пластинчатые комплексы (аппараты Гольджи) и варьирующее число секреторных гранул (рис. 3—2, 3—3). Белки, предназначенные для секреции, попадают в эти субклеточные органеллы и транспортируются в них.

Рис. 3—3. Схема субклеточного транспорта и секреторного пути в белоксекретирующей клетке.
I — синтез белка на полирибосомах, прикрепленных к эндоплазматическому ретикулуму, и направленный выход через мембрану в цистернальное пространство: II— образование челночных пузырьков (переходные элементы) из эндоплазматического ретикулума, сменяемое их транспортом и включением в пластинчатый комплекс (ПК); III — образование секреторных гранул в ПК; IV — транспорт секреторных гранул к плазматической мембране, слияние с плазматической мембраной и экзопигоз, приводящий к выделению содержимого гранул во внеклеточное пространство. Можно видеть, что секреция способна осуществляться путем транспорта секреторных пузырьков, а также незрелых и зрелых гранул. Некоторые гранулы захватываются лизосомами и разрушаются (кринофагия). ШЭР — шероховатый эндоплазматический ретикулум; ГЭР — гладкий эндоплазматический ретикулум.
Секретируемые белки синтезируются на шероховатом эндоплазматическом ретикулуме (ШЭР), состоящем из полирибосом, прикрепленных к сложно устроенным мембранным мешочкам, содержащим цистерны. Вновь синтезированные белки быстро получают доступ в цистерны за счет транспорта через двойной слой липидов мембраны. По цистернам эндоплазматического ретикулума белки транспортируются в пластинчатый комплекс либо путем прямого переноса через цистерны, которые продолжаются в мембранные каналы пластинчатого комплекса, либо с помощью совершающих челночные движения пузырьков, называемых переходными элементами (см. рис. 3—3). Разные секреторные клетки, по-видимому, преимущественно используют тот или другой механизм транспорта белка из ШЭР в пластинчатый комплекс. В комплексе происходит упаковка белков в секреторные пузырьки и/или секреторные гранулы. Окруженные мембраной секреторные пузырьки отпочковываются от пластинчатого комплекса в виде незрелых гранул, подвергающихся по мере уплотнения белкового содержимого созреванию. Высвобождение белка во внеклеточное пространство происходит путем миграции секреторных гранул на периферию клетки и слияния мембраны, покрывающей гранулы, с плазматической мембраной (экзоцитоз), что и приводит к выходу белков из клетки.
Хотя это окончательно и не доказано, но некоторые биологи считают, что секреция белковых гормонов может происходить также путем внутриклеточного транспорта и высвобождения белков, содержащихся в секреторных пузырьках и незрелых секреторных гранулах (см. рис. 3—3) [3L Если такие альтернативные-пути секреции действительно существуют в дополнение к механизму образования и экзоцитоза зрелых гранул, то возникает возможность того, что разные внеклеточные стимулирующие факторы отличаются друг от друга своей сравнительной эффективностью в отношении модуляции секреции гормона тем или иным путем. Например, можно было бы предположить, что секреция инсулина, вызываемая глюкозой, с одной стороны, и кальцием или b-адренергическими агонистами — с другой, осуществляется различными секреторными путями, или что часть секреции паратиреоидного гормона, не подавляемая повышенным уровнем внеклеточного кальция, высвобождается путем, морфологически отличающимся от кальцийчувствительного пути.
ПУТЬ БИОСИНТЕЗА
Значительный интерес вызвало открытие синтеза белковых и полипептидных гормонов в виде более крупных предшественников, которые затем путем расщепления модифицируются в более мелкие (рис. 3—4) [4]. На самом деле белковые и полипептидные гормоны составляют только один из многих классов белков, синтезируемых как предшественники. В качестве примеров белков. различных классов могут служить сывороточный альбумин, протеины яичного белка, антитела, коллаген, ферменты поджелудочной железы, вирусные и связанные с мембранами белки. Усилия исследователей в настоящее время сфокусированы на выяснении физиологической роли биосинтетических предшественников на пути образования гормонов, а также общего значения предшественников секретируемых белков.
Одна из вероятных функций последовательности предшественников видна на примере инсулина. С-пептид проинсулина — соединительный пептид, связывающий А- и В-цепи инсулина — принимает участие, по-видимому, в правильной сборке цепей, создавая возможность эффективного образования дисульфидных связей. Такая стабилизирующая функция должна иметь место только применительно к ограниченному числу секретируемых белков, таких, как инсулин, поскольку многие белки существуют в виде одиночных полипептидных цепей, лишенных дисульфидных мостиков.

Рис. 3—4. Неполный перечень пребелков различных структурных классов.
Стрелками показаны участки расщеплений, в результате чего предшественники превращаются в промежуточные или окончательные продукты. Не все предшественники для превращения в промежуточные формы пробелков проходят через стадию расщепления (Habener, Potts [4]).
В настоящее время складываются представления в пользу вероятной роли предшественников в посттрансляционных процессах, обусловливающих внутриклеточный транспорт и компартментализацию гормонов по ходу секреторного пути [5, 6]. Эта гипотеза, известная под названием сигнальной, предложена Mistein и сотр. [5], а также Blobel и Sabatini [6] для объясневия молекулярного механизма, с помощью которого белки, предназначенные для секреции из клетки, избирательно получают доступ к окруженным мембранами субклеточным органеллам, участвующими в их транспорте, упаковке и секреции.
На основании модели, приведенной на рис. 3—5, можно объяснить путь биосинтеза паратиреоидного гормона как представителя полипептидных гормонов с учетом положений сигнальной гипотезы. Этот путь включает последовательное расщепление биосинтетических предшественников: препропаратиреоидный гормон (пре-про-ПТГ) ® пропаратиреоидный ® паратиреоидный гормон. Инициация синтеза белка происходит на полирибосомах в матриксе клетки. Инициальная аминокислота (аминокислоты) — метионин, кодируемая специфическим кодоном АУГ, отделяется от растущей полипептидной цепи, когда она достигает в длину примерно 20—30 аминокислот (примерная длина полипептида, покрывающая протяженность крупной рибосомальной субъединицы). Этот процесс считается общим для синтеза всех белков, продуцируемых эукариотами.

Рис. 3—5. Схематическое изображение пути биосинтеза паратиреоидного гормона.
КОПаза—карбоксипептидаза В (Habener, Potts [4]),
Гидрофобная специфическая для прегормона последовательность пре-про-ПТГ, кодируемая последовательностью оснований мРНК, непосредственно прилегающей (3 -конец) к инициальному кодону АУГ (сигнальные кодоны), выступает затем в роли «водителя» или сигнала, который каким-то, до сих пор не выясненным, образом обеспечивает контакт комплекса полирибосома — синтезируемая цепь с мембраной эндоплазматического ретикулума. Контактируя с этой мембраной либо за счет чисто гидрофобных взаимодействий, либо, что вероятнее, за счет специфических рецепторов мембраны, растущая полипептидная цепь проходит через мембрану во внутрицистернальное пространство. Сразу же после этого или, вероятно, еще в процессе прохождения пре-про-ПТГ в цистерну сигнальная последовательность отщепляется, по-видимому, под действием специфической пептидазы, локализованный в эндоплазматическом ретикулуме, что приводит к образованию про-ПТГ. Этот промежуточный предшественник (про-ПТГ) движется затем по каналам, образованным мембранами эндоплазматического ретикулума, в пластинчатый комплекс, где от него под сочетанным действием ферментов, обладающих активностью, сходной с активностью трипсина и карбоксипептидазы В, отщепляется МНа-концевой гексапептид. Окончательный гормональный продукт включается в секреторные гранулы и высвобождается во внеклеточное пространство в ответ на снижение концентрации кальция во внеклеточной жидкости.
Правильность этой модели подтверждается многими данными» [7—11]. При структурном анализе первичных продуктов трансляции некоторых мРНК, кодирующих различные секретируемые белки, было обнаружено, что многие, если не все, белковые гормоны и секретируемые белки синтезируются вначале в виде предшественников с гидрофобными N1-12-концевыми участками (см. рис. 3—4). По-видимому, препропаратиреоидный гормон [12] является типичным представителем целого класса биосинтетических предшественников (пребелков) белковых гормонов, к которым относятся инсулин, СТГ, пролактин, ТТГ и АКТГ, а также негормональных секретируемых белков, таких, как ферменты поджелудочной железы, протеины яичного белка, иммуноглобулины, сывороточный альбумин, «мелиттин» (или меллитин — пчелиный яд) и некоторые ассоциированные с мембраной бактериальные белки. Характерным для сигнальных последовательностей предшественников является то, что они расположены на NH2-концевой части белков. Эти последовательности различаются по длине, включая от 15 до 25 аминокислотных остатков; в центральных их частях содержится гидрофобный участок, состоящий из 10— 12 аминокислот. Столь высокая степень гидрофобности характерна для белков, известных своим специфическим взаимодействием с мембранами.
Приведенные данные позволяют считать, что обеспечение возможности движения через мембрану — основная функция сигнальной последовательности. Таким образом, благодаря специфическому характеру последовательности предшественника из множества клеточных белков отбираются, отделяются, транспортируются и поступают на секреторный конвейер клетки белки, предназначенные для секреции.
Если в отношении прегормонов или препрогормонов существуют веские доказательства их транспортной функции, то функция промежуточных предшественников—прогормонов—остается неизвестной. Радиоавтографические исследования миграции вновь синтезированных белков в клетке показали, что превращение прогормона в конечные продукты происходит в пластинчатом комплексе клетки. Например, период в 15 мин между началом сип-теза пре-про-ПТГ и первым появлением ПТГ практически совпадает со сроком, необходимым для попадания радиоавтографических гранул в пластинчатый комплекс [13]. Превращение прогормона в гормон может быть также избирательно заблокировано действием на ткани ингибиторов продукции энергии в клетке (антимицин А и динитрофенол), равно как и веществами, нарушающими функцию микротрубочек (винбластин и колхицин). Эти данные указывают на то, что транслокация прогормона из ШЭР в пластинчатый комплекс является энергозависимым процессом, и что в движении прогормона могут принимать участие микротрубочки. Однако отсутствуют прямые доказательства того, что прогормон сам по себе, или его химические взаимодействия, играет существенную роль в транспорте вновь синтезированного белка из ШЭР в пластинчатый комплекс или что он в какой-либо мере определяет упаковку гормона в пузырьки или гранулы. Недавно проведенные исследования, согласно которым синтез многих секретируемых белков не требует образования промежуточных, или проформ предшественников (см. рис. 3—4), порождают определенные сомнения в справедливости такого представления [4]. Непонятно, почему некоторые секретируемые белки, например паратиреоидный гормон, инсулин и сывороточный альбумин, образуются с помощью промежуточных предшественников, тогда как другие, например СТГ, пролактин и овальбумин, не проходят через эту стадию.
Если значение прогормона для клеточного транспорта не известно, то некоторые детали его расщепления уже изучены. В отличие от того, что наблюдается в отношении прегормонов, в которых аминокислотные остатки по месту отщепления сигнальной последовательности от остальной части молекулы (гормона или прогормона) в разных прегормонах неодинаковы (см. рис. 3—4 и 3—5), места расщепления пробелковых интермедиатов постоянно содержат основные аминокислоты лизин или аргинин (или и ту и другую), обычно по 2—3 вместе (см. рис. 3—4). Этот субстрат легко и предпочтительно атакуется эндопептидазами, обладающими трипсиноподобной активностью. После эндопептидазного расщепления оставшиеся основные аминокислоты подвергаются избирательному отщеплению под действием экзопептидаз с активностью, подобной активности карбоксипептидазы В.
Вполне вероятно, что все пробелки расщепляются в ходе общего ферментативного процесса внутри пластинчатого комплекса клеток различного происхождения. Однако роль этого общего процесса расщепления прогормонов, находящихся на секреторном конвейере, остается неизвестной, как и значение самого существования пробелковых интермедиатов некоторых, но не всех, секретируемых белков. Дальнейшее ферментативное расщепление пептида-предшественника, отделившегося от пропаратиреоидного гормона, может представлять собой один из этапов клеточной деградации этого пептида, или, что более вероятно, трипсиноподобная и карбоксипептидазо-В-подобная активности могут быть неразделимыми свойствами единого ферментного комплекса. Не исключено также, что части пептидов-предшественников, отщепляемые от пробелка, могут обладать пока не установленной собственной и самостоятельной биологической активностью, а их дальнейшее расщепление необходимо для проявления этой активности. Такая ситуация, вероятно, складывается в процессе образования АКТГ, b-липотропина и эндорфинов (опиатоподобные пептиды), которые одновременно появляются в результате расщепления общего крупного белкового предшественника [14].

Рис. 3—6, Особенности секреции различных белковых гормонов. Секреция в ответ на специфические внешние стимулы (а, б); циркадный ритм секреции (в, г); «спонтанная» секреция, предположительно возникающая под влиянием ЦНС (д, е) (в— Jubiz W. и соавт., J. Cim. Invest.» 1972, 51, 2040; r—Gallager T.F. и соавт., J. din. EndocrinoL Metab., 1973, 36, 1058; д— Yen S.S. С. и соавт., J. din. EndocrinoL Metab., 1972, 34, 671; е — Finkelstein J.W. и соавт., J. Clin. EndocrinoL Metab., 1972, 35, 665).
СЕКРЕЦИЯ И РЕГУЛЯЦИЯ
Секреция белковых и полипептидных гормонов контролируется высокоспецифическими внеклеточными стимулами. В большинстве случаев такие стимулы представляют собой изменения уровня циркулирующих в крови веществ, что должно было бы привести к нарушению гомеостатического равновесия, а гормональные продукты, высвобождаемые вследствие этих изменений, действуют на соответственные органы-мишени, в результате чего восстанавливается гомеостаз (рис. 3—6). Например, повышение после приема пищи количества глюкозы в крови стимулирует секрецию инсулина, который в свою очередь стимулирует поглощение глюкозы мышцами, в связи с чем содержание глюкозы в крови нормализуется. Другим примером служит стимуляция высвобождения паратиреоидного гормона уже небольшим снижением уровня кальция в крови. Выделившийся при этом паратиреоидный гормон действует на свои органы-мишени — костную ткань и почки, способствуя обратному поступлению кальция во внеклеточную жидкость. Эти регуляторные процессы включают и ингибиторную петлю обратной связи, в силу которой продукты, вырабатываемые органами-мишенями и выделяемые в кровоток в ответ на действие гормонов, тормозят его дальнейшую секрецию. Например, снижение уровня глюкозы в крови тормозит дальнейшую секрецию инсулина, а увеличение содержания кальция в крови тормозит высвобождение паратиреоидного гормона. Большое число регуляторных петель обратной связи может действовать согласованно, что, например, наблюдается в отношении физиологической регуляции секреции различных гормонов передней долей гипофиза (рис. 3—7). В некоторых случаях точная природа стимула, участвующего в регуляции секреции гормона, выяснена недостаточно полно; эта неопределенность касается, например, «факторов», ответственных за «вспышки» секреторной активности, проявляемой передней долей гипофиза, и контролирующих элементов, управляющих циркадными или суточными ритмами.

Рис. 3—7. Регуляторные петли обратной связи в гипоталамо-гипофизарной системе. Такая регуляция может быть показана на примере любого из гипофизарных гормонов, в частности ТТГ, ЛГ, ФСГ, пролактина, СТГ.
Окончательные детали молекулярных процессов сопряжения внеклеточных стимулов с секрецией гормона и в конце концов с биосинтезом нового гормона, необходимого для восполнения его количества в железе, неизвестны. В известных же случаях эти процессы в разных клетках, секретирующих белковые гормоны, могут быть различными. Имеются, однако, данные о том, что в секреции многих гормонов может принимать участие общий механизм сопряжения. Этот механизм в качестве 2-го медиатора использует цАМФ (рис. 3—8). Согласно данной модели, стимулирующий фактор не проникает в клетку, а взаимодействует с рецептором, расположенным в структурах плазматической мембраны. Каким-то образом при связывании с рецептором плазматической мембраны стимулирующий фактор активирует аденилатциклазу, что приводит к образованию 3,5-цАМФ, который в свою очередь превращает неактивную форму фосфорилирующего фермента — протеинкиназы в активную форму путем отсоединения регуляторной субъединицы (PC) от активной каталитической субъединицы (КС).

Рис. 3—8. Предполагаемый механизм действия полипептидных гормонов на клетку-мишень. KС — каталитическая субъединица; PC — регуляторная субъединица. Объяснения »
Протеинкиназа (активная субъединица) катализирует фосфорилирование определенных внутриклеточных белков, причем считается, что образующиеся таким образом фосфорилированные белки играют роль в процессах транспорта и секреции гормона, вероятно, путем активации микротрубочек и/или слияния мембран секреторных гранул с плазматической мембраной. В настоящее время из-за отсутствия экспериментальных доказательств перечисленных процессов они остаются в высшей степени гипотетическими. Действительно, о характере процессов и сил, участвующих во внутриклеточном продвижении белков, известно крайне мало.
Следует отметить важную роль кальция в секреторном процессе. Потоки кальция из внеклеточной жидкости в клетку, равно как и его потоки из внутриклеточных органелл (например, митохондрий) в цитозоль, тесно сопряжены с секреторными процессами. При дефиците кальция во внеклеточной жидкости секреция значительно тормозится. Возможно, что вход кальция в клетку каким-то еще не изученным образом связан с активацией аденилатциклазы.
На секрецию белковых гормонов многими эндокринными органами влияют и катехоламины, действующие через адренергические рецепторы, связанные с рецепторами, реагирующими на главные стимулы. Считают, что эти адренергические эффекты служат модуляторами секреторной активности, находящейся в основном под контролем главных стимулирующих факторов.
С секреторными процессами должны быть каким-то образом связаны процессы биосинтеза. Синтез новых молекул гормона необходим для пополнения потраченных и, наоборот, при уменьшении потребности в секреции должен был бы тормозиться и синтез новых молекул гормона, чтобы предотвратить перегрузку им клетки. Мало известно о клеточных механизмах, сопрягающих секреторные процессы с процессами биосинтеза, т. е. не ясно, непосредственно влияют внеклеточные факторы, регулирующие скорость секреции, на скорость биосинтеза гормона, или сам по себе процесс секреции обеспечивает появление регуляторных сигналов, передающихся на отдельные этапы биосинтеза. Степень сопряжения секреторной и биосинтетической активности в конкретной эндокринной железе в большой мере может определяться относительной величиной накопления гормонов в железе. Железы, обладающие сравнительно большим количеством гормона, могут удовлетворять потребность в секреции более длительное время, чем железы с меньшими запасами его. Судя по главному морфологическому признаку секреторных клеток — присутствию секреторных гранул, все эндокринные клетки в той или иной степени обладают запасом гормонов. Вероятно, такие запасающие системы возникли с целью придания эндокринным секреторным клеткам свойства буфера или резервуара гормона, который может быть мобилизован на удовлетворение секреторных потребностей в течение очень короткого времени, без включения механизмов острого изменения скорости биосинтеза гормона.
Конкретный этап (или этапы) процесса биосинтеза гормона, на котором осуществляется регуляция этого процесса, в настоящее время не известен. Согласно существующим представлениям (см. рис. 3—1), регуляция могла бы происходить на одном или нескольких уровнях; помимо синтеза ДНК (рост и деление клеток), эти уровни включают: 1—транскрипцию; 2—посттранскрипционные процессы; 3 — трансляцию; 4 — посттрансляционные процессы. Клеточный и молекулярный уровни регуляции биосинтеза большинства белковых гормонов идентифицированы далеко не в той степени, которая позволила бы сделать определенные заключения. Однако имеющиеся ограниченные сведения, касающиеся, например, биосинтеза паратиреоидного гормона, свидетельствуют о том, что главные объекты регуляторных влияний в ответ на изменение содержания кальция в крови локализуются на уровне деления клеток и/или транскрипционном этапе. Стимуляция железы в условиях снижения содержания кальция приводит, очевидно, к увеличению синтеза РНК и в конце концов к гиперплазии железы. В околощитовидной железе функционирует и 3-й регуляторный механизм на посттрансляционном уровне: изменение внутриклеточного кругоооборота гормона. Таким образом, до сих пор нет достаточно четких и убедительных данных, которые свидетельствовали бы о том, что внеклеточные стимулы могут быть ответственными за изменение скорости расщепления биосинтетических предшественников или скорости инициации и трансляции мРНК, кодирующих гормоны.
ТИРЕОИДНЫЕ ГОРМОНЫ
Клеточные и молекулярные механизмы, используемые щитовидной железой для биосинтеза, накопления и секреции тиреоидных гормонов в течение прошлых 3—4 десятилетий, изучены достаточно полно благодаря объединенным усилиям большого числа исследователей. Подробности этих исследований содержатся в ряде исчерпывающих обзоров. Синтез тиреоидных гормонов во многих. отношениях сходен с синтезом полипептидных и белковых гормонов с добавлением нескольких уникальных этапов, особенно подходящих к метаболическим функциям щитовидной железы.
Основными тиреоидными гормонами являются йодтиронины — тетрайод-L-тиронин (тироксин, Т4) и 3,5,3-трийод-L-тиронин (трийодтиронин, Т3), которые образуются из йодированных тирозиновых предшественников. Они состоят из йодтирозина (моно — или дийодированного) и йодированного фенольного кольца, объединенных 4,1-эфиpнoй связью (рис. 3—9). Эти два йодтиронина вместе с йодтирозиновыми предшественниками составляют примерно 90% органического или белковосвязанного йода в щитовидной железе, причем на долю Т4 и Т3 приходится 99% секретируемого органического йода. Процессы образования и секреции тиреоидных гормонов включают несколько этапов, часть которых отличается своеобразием и характерна только для щитовидной железы.
Главными веществами, используемыми в синтезе тиреоидных гормонов, являются йод и тирозин. Щитовидная железа отличается высокоэффективным механизмом захвата йода из крови, а в качестве источника тирозина она синтезирует и использует крупный гликопротеин — тироглобулин. Если тирозин в организме содержится в большом количестве и поступает как из пищевых продуктов, так и из распадающихся эндогенных белков, то йод присутствует лишь в ограниченном количестве и поступает только из пищевых продуктов. Йод всасывается из кишечника в форме йодида и в этой форме циркулирует в крови в свободном (несвязанном) состоянии.
Йодид, захватываемый из крови тиреоидными (фолликулярными) клетками, и тироглобулин, синтезируемый в этих клетках, секретируются (путем экзоцитоза) во внеклеточное пространство внутри железы, называемое просветом фолликула или коллоидным пространством, окруженное фолликулярными клетками. В просвете фолликула или (что более вероятно) на апикальной поверхности клеток, обращенной в этот просвет, йодид окисляется в йод и другие окисленные продукты и ковалентно связывается фенольными кольцами тирозиновых остатков, содержащихся в полипептидном каркасе тироглобулина. Связывание йода с фенольным кольцом происходит либо только в 3-м положении, либо как в 3-м, так и в 5-м положениях, в результате чего образуются монойодтирозин (МИТ) и дийодтирозин (ДИТ) соответственно. Этот процесс йодирования тирозиновых остатков тироглобулина известен под названием этапа органификации в биосинтезе тиреоидных гормонов.

Рис. 3—9. Структура некоторых тиреоидных гормонов (Ingbar S.Н., Woeber К.A. In: Textbook of Endocrinology/Ed. Williams R.H. Sth ed.— Philadelphia: Saunders, 1974).
Следующим этапом является конденсация йодтирозинов с образованием йодтиронинов. Все еще оставаясь в структуре тироглобулина, молекулы МИТ и ДИТ конденсируются, образуя трийодтиронин (Т3), и подобно этому две молекулы ДИТ конденсируются, образуя молекулу L-тироксина (Т4). В таком виде, т. е. связанные с тироглобулином, йодтиронины, равно как и непроконденсировавшие йодтирозины, хранятся в тиреоидном фолликуле. Этот комплекс йодированного тироглобулина часто называют коллоидом. Таким образом, тироглобулин, составляющий 10% от влажной массы щитовидной железы, служит белком-носителем, или предшественником накапливающихся гормонов.
Секреция тиреоидных гормонов — процесс, происходящий в ответ на метаболические потребности и опосредуемый действием тиротропного гормона (ТТГ) на тиреоидные клетки, — предполагает высвобождение гормонов из тироглобулина. Это происходит на апикальной мембране путем поглощения коллоида, содержащего тироглобулин (процесс, известный под названием эндоцитоза). Тироглобулин затем гидролизуется в клетке под влиянием протеаз, а высвобождаемые таким образом тиреоидные гормоны выделяются в циркулирующую кровь.

Рис. 3—10. Схематическое изображение пути биосинтеза тиреоидных гормонов в клетке. Т3 и Т4 образуются и хранятся связанными с тироглобулином в коллоиде.
ПК — пластинчатый комплекс: МИТ — монойодтирозин: ДИТ — дийодтирозин} ШЭР — шероховатый эндоплазматический ретикулум.
БИОСИНТЕЗ
Различные этапы биосинтеза и секреции тиреоидных гормонов L-трийодтиронина (Т3) и L-тироксина (Т4) следует рассмотреть отдельно и более подробно, подразделив их на следующие категории: 1 — биосинтез тироглобулина; 2 — захват йодида, 3 — органификация йодида; 4—конденсация; 5—поглощение клетками и протеолиз коллоида; 6 — секреция. Схематическое изображение различных этапов биосинтеза тероидных гормонов представлено на рис. 3—10.
Биосинтез тироглобулина
Тироглобулин представляет собой крупный гликопротеин с молекулярной массой примерно 670 000 (19S). Он состоит по меньшей мере из 4 субъединиц (из двух сходных пар разных субъединиц), связанных друг с другом комбинацией нековалентных и ковалентных.(дисульфидных) связей. Белковый комплекс содержит от 8 до 10% углеводов. Тироглобулин состоит примерно из 5900 аминокислотных остатков, около НО из которых—тирозиновые. Содержание йода в тироглобулине, полученном из интактных желез, колеблется от 0,2 до 1% и более. Тироглобулин синтезируется на полирибосомах, связанных с ШЭР (см. рис. 3—10). Субклеточный путь, по которому транспортируется вновь синтезированный тироглобулин, характерен для транспорта многих предназначенных к секреции белков. Вновь синтезированные полипептидные цепи направленно проникают через мембрану ретикулума во внутрицистернальное пространство ШЭР, по которому переносятся в пластинчатый комплекс и упаковываются в окруженные мембраной пузырьки, называемые апикальными пузырьками (см. рис. 3—10 и 3—11). Эти пузырьки транспортируются к апикальному краю клетки, где сливаются с мембраной, граничащей с фолликулярным, или коллоидным, пространством, и тироглобулин выбрасывается в это пространство [15, 16]. Именно на поверхности этой мембраны со стороны коллоида и йодируется тироглобулин (см. далее). Исследования с импульсной меткой и последующим ее разведением, проводимые на срезах щитовидной железы, инкубируемых с радиоактивными аминокислотами in vitro, показали, что процессы синтеза и транспорта тироглобулина (от момента начального синтеза до первого появления в коллоидном пространстве) занимают от 4 до 6 ч. Начальным продуктом синтеза является, по-видимому, субъединица с молекулярной массой около 160000 (3—8S). Предполагается, что разные субъединицы кодируются отдельными мРНК.

Рис. 3—11. Участок тиреоидной фолликулярной клетки. Вверху можно видеть микроворсинки (MB), тянущиеся от апикального края клетки в коллоид (Кол), в цитоплазме под краем—апикальные пузырьки (АП).
Плотное тельце, имеющее лизосомную (Л) природу; МТ — микротрубочки, MX — митохондрия Электронная микрофотография. х37 800 (Haddad А и соавт., J. Cellp Biol., 1971, 49, 856).
Затем субъединицы объединяются в димеры с молекулярной массой 320 000 (12S,) и образуют нейодированный тироглобулин (17S), который «созревает» во время и после йодирования в окончательный комплекс с молекулярной массой 667000 (19S). Последовательность такова: 4 субъединицы (по 3—8S) ® 2 субъединицы (по 12S) ® нейодированный («незрелый») тироглобулин (17S) ® йодированный («зрелый») тироглобулин (19S). Гликозилирование тироглобулина происходит на всех стадиях синтеза. Сердцевинный олигосахаридный комплекс присоединяется, вероятно, к отдельным аспарагиновым остаткам N-гликозидной связью и переносится с долихофосфатного носителя в ходе транспорта вновь образуемых цепей субъединиц через мембраны эндоплазматической сети. В процессе транспорта полипептида по цистернам эндоплазматического ретикулума в пластинчатый комплекс к олигосахаридным ядрам добавляются новые углеводные остатки. По всей вероятности, гликозилирование каким-то образом участвует в транспорте и сборке цепей субъединиц и необходимо для формирования полностью собранного тироглобулинового комплекса с его специфической трехмерной четвертичной структурой.
Захват йода
Важнейшим этапом биосинтеза тиреоидных гормонов является активный, контролируемый ферментами, транспорт йодида, содержащегося в крови, через мембрану тиреоидной клетки в цитозоль и из него в фолликулярный коллоид. В конечном счете обеспеченность организма йодом должна определяться пищевыми продуктами. Часть йода всасывается в органической форме и превращается в йодид в печени. Однако наибольшая его часть уже. всасывается в форме йодида и именно в этой форме разносится с кровью. Суточное потребление йодида с пищей в США составляет примерно 500 мкг. Из этого количества 120 мкг поглощается щитовидной железой и 60 мкг включается в тиреоидные гормоны и секретируется с Т4 и Т3. Поглощение и концентрирование йодида щитовидной железой обеспечивается двумя энергозависимыми контролируемыми ферментными «насосами», или механизмами захвата; один, расположенный на базальной, или капиллярной, мембране, извлекает йодид из крови и транспортирует его в цитозоль тиреоидной клетки, а второй, локализующийся на апикальной мембране, доставляет его в коллоидное пространство. Существует и конкурентный пассивный перенос йодида обратно в кровь, но «чистый» эффект сводится к концентрированию йодида в щитовидной железе. Эти насосы функционируют столь эффективно, что концентрация йодида в щитовидной железе не менее чем в 25 раз превышает его уровень в плазме крови, а в условиях дефицита йода концентрация йодида в железе может быть в 500 paз выше, чем в плазме. Эффективность, с которой щитовидная железа концентрирует йодид, находится в обратной зависимости от уровня доступного йодида в плазме, и в условиях относительной йодной недостаточности железа извлекает до 20% йодида, присутствующего в крови. Извлеченный тиреоидной клеткой из крови йодид быстро уравновешивается в общем пространстве йодида, уже содержащегося в клетке, который образуется в результате распада и дейодирования йодаминокислот, высвобождающихся из-тироглобулина (см. далее), и быстро проникает в коллоидное-пространство, где связывается с тироглобулином. Этот концентрирующий и транспортный механизм работает так быстро, что отношение «свободного» йодида к органически связанному в щитовидной железе может составлять лишь 10:8000 мкг. Авторадиографические исследования показали, что уже через 30 с после импульсного внутривенного введения животному радиоактивного йодида практически вся метка обнаруживается в коллоидном пространстве, будучи органически связанной с тироглобулином [17]; только около 0,25% тиреоидного йода остается в форме свободного йодида, а остальная его часть связана с тироглобулином в форме йодаминокислот или йодтиронинов.
О необходимости столь легкого накопления йода в щитовидной железе свидетельствует тот факт, что для поддержания нормальной секреции гормонов эта железа должна каждые сутки накапливать от 50 до 75 мкг йодида, т. е. полностью экстрагировать йодид из 20—30% крови, протекающей через щитовидную железу в сутки, что составляет лишь небольшую часть резерва, необходимого на случай колебаний содержания йода в диете или возникновения чрезмерной потребности в тиреоидных гормонах. Сам организм, однако, способен в значительной мере компенсировать временный дефицит йодида путем повышения его канальцевой реабсорбции и всасывания в кишечнике.
Детали конструкции йодидных насосов выяснены не полностью» но, по всей вероятности, в них участвует Na+/K+-стимулируемая, Mg2+-зависимая оуабаинчувствительная АТФаза. Для накопления йодида необходимы и ионы кальция. Процесс концентрирования явно зависит от доступности клеточной энергии, поскольку разобщители окислительного фосфорилирования, такие, как 2,4-динитрофенол и бис-оксикумарин, являются эффективными ингибиторами накопления йода срезами щитовидной железы.
Щитовидная железа концентрирует не только йодид, но и некоторые другие анионы, которые могут действовать как конкурентные ингибиторы транспорта йодида. К таким ингибиторам относятся тиоцианат, перхлорат и пертехнетат. Перхлорат можно применять в клинике для того, чтобы вызвать быстрый выброс неорганического йодида, после определения количества которого можно получить представление о величине несвязанной фракции йодида в щитовидной железе. У больных с нарушенной органификацией йодида, например при врожденном дефиците ферментов или воздействии зобогенных факторов, блокирующих органификацию йодида, одна и та же доза перхлората будет высвобождать гораздо большую, чем в норме, часть дозы ранее введенного» йодида.
Органификация йодида
На апикальной мембране тероидной фолликулярной клетки илд вблизи нее йодид окисляется пероксидазными ферментами, что приводит к присоединению йода к фенольному кольцу тирозиновых остатков, содержащихся в структуре тироглобулина. Йодирование молекул тирозина происходит именно тогда, когда они являются частью полипептидного каркаса тироглобулина, а не до синтеза этого белка. Хотя некоторые авторы обнаруживали пероксидазную активность в митохондриях и пластинчатом комплексе, современные данные свидетельствуют в пользу той точки зрения, — что основное количество пероксидазы связано с микроворсинками апикальной мембраны и что процесс йодирования происходит на поверхности раздела мембрана — коллоид, а не внутри самой фолликулярной клетки [18]. Территориальное ограничение йодирования поверхностью раздела между клеткой и коллоидом обеспечивает щитовидную железу механизмом минимизации случайного йодирования внутриклеточных белков, не являющихся тироглобулином. В результате йодирования тироглобулин «созревает» и его константа седиментации увеличивается с 17 до 19S. Относительное количество моно- и дийодтирозинов варьирует в зависимости от степени йодирования, которая в свою очередь зависит от доступности йода. В тироглобулине человека в норме йод распределен следующим образом: 20% в составе МИТ, 40% —ДИТ, 30% —Т4 и 2% —Т3. Эти величины свидетельствуют о том, что в большинстве случаев фенольные кольца содержат две молекулы йода. Можно отметить, что в исследованиях по химическому йодированию модельного вещества — N-ацетилтирозина in vitro было установлено в 30 раз более интенсивное монойодирование, чем дийодирование; поэтому, если бы тирозиновые группы тироглобулина вели себя подобно модельному соединению, то основная часть йода в тироглобулине должна была бы присутствовать в монойодтирозинах. Однако в тироглобулине, выделенном из щитовидных желез больных зобом, доля монойодированных веществ заметно превышает таковую дийодированных (см. далее). Содержание тирозина в тироглобулине отнюдь не уникально и сравнимо с его содержанием во многих других белках (примерно 1,8% всех аминокислот). Имеются данные, указывающие на то, что подвергаться йодированию могут лишь особые тирозиновые остатки в аминокислотной последовательности тироглобулина; предполагается, что тироксин (Т4) локализуется в уникальной последовательности: ала-сер-Т4-глю (или глн)-асп (или асн) [19]. По всей вероятности, в определении доступности отдельных тирозиновых остатков для йодирования важную роль играет вторичная и/или четвертичная структура молекулы тироглобулина. Вещества, относящиеся к классу тионамидов (метимазол, пропилтиоурацил) являются мощными ингибиторами этапа органификации йодида вследствие их тормозящего действия на пероксидазу щитовидной железы.
Конденсация йодаминокислот с образованием йодтиронинов
В течение нескольких часов после образования в тироглобулине йодтирозинов две молекулы дийодтирозина конденсируются, образуя молекулу тироксина, а одна молекула монойодтирозина, конденсируясь с одной молекулой дийодтирозина, образует молекулу трийодтиронина. Относительное содержание этих двух йодтиронинов в щитовидной железе зависит от количества йода в диете. У крыс при дефиците йода увеличено образование МИТ. по сравнению с ДИТ и образование Т3 по сравнению с Т4. С позиций целесообразности этот сдвиг синтеза с образования, обладающего меньшей биологической активностью Т4 на синтез более активного Т3, можно рассматривать как компенсаторный механизм, используемый железой для обеспечения синтеза гормона, обладающего большей биологической активностью в условиях ограниченного снабжения йодом.
Молекулярный механизм реакций конденсации точно не известен. Предложены как внутри-, так и межмолекулярные схемы процесса конденсации [20]. Внутримолекулярный механизм предполагает генерацию пероксидазой свободных дийодтирозильных радикалов в коллоиде. После того как два из подобных радикалов конденсируются, образуя хиноловый эфир, один из них расщепляется и возникающее вследствие этого дийодированное фёнольное кольцо переносится на 2-й хиноловый эфир, образуя в свою очередь молекулу тироксина, связанную с цепью тироглобулина. Межмолекулярная схема основана на роли пероксидазы в катализе окисления дийодоксифенилпировиноградной кислоты (ДЙОФПК) в гидроперекись ДЙОФПК. Последняя предположительно является активной формой, неферментативно конденсирующейся со свободным ДИТ, в результате чего образуется Т4. В обоих случаях роль тиреоидной пероксидазы в образовании Т4 и Т3 не ограничивается простым катализом йодирования тирозиновых остатков в молекуле тироглобулина.
СЕКРЕЦИЯ
Морфологический путь
Секреторные процессы в щитовидной железе возникают при действии ТТГ на рецепторы, расположенные на базальной мембране тиреоидных клеток. Схематическое изображение предполагаемых клеточных процессов, принимающих участие в секреции тироидных гормонов, приведено на рис. 3—12. Начальным моментом этих процессов должно служить высвобождение тиреоидных гормонов (Т4 и Т3) из коллоида, в котором они ковалентно связаны пептидными связями.

Рис. 3—12. Схематическое изображение секреторного пути в тиреоидной фолликулярной клетке. Йодированный тироглобулин резорбируется в цитоплазму в виде капель коллоида путем эндоцитоза последнего. Капли захватываются фаголизосомами, и тиреоидные гормоны высвобождаются в результате протеолиза тироглобулина. Из клетки во внеклеточную жидкость выделяются Т4 и Т3. Монойодтирозин (МИТ) и дийодтирозин (ДИТ) остаются в клетке и подвергаются дейодированию. Высвобождаемый при этом йодид поступает в общее йодидное пространство. Секреция начинается в ответ на стимуляцию рецепторов плазматической мембраны ТТГ. Считают, что ТТГ-рецепторная реакция опосредуется образованием цАМФ, играющего роль второго медиатора в процессе сопряжения стимула с клеточным ответом.
Исследования, проведенные с помощью высокоразрешающей авторадиографии на электронно-микроскопическом уровне, выявили морфологию путей гормональной секреции в клетке [17]. Исходные процессы включают поглощение, или эндоцитоз, глыбок коллоида, содержащего тироглобулин, микроворсинками апикальной мембраны. Коллоид в виде окруженных мембраной капелек переносится в цитозоль тиреоидной клетки. Считается, что коллоидные капельки затем фагоцитируются лизосомами, содержащими протеолитические ферменты. В результате гидролиза тироглобулина образуются свободные йодтирозины — МИТ и ДИТ, а также йодтиронины — Т3 и Т4. На этой стадии в клетке происходит любопытный избирательный процесс: йодтиронины избирательно секретируются из клетки в кровь, тогда как йодаминокислоты дейодируются ферментами, а высвобождаемый при этом йодид поступает в общее йодидное пространство железы и эффективно реутилизируется в синтезе нового тироглобулина. Только около 10% высвобождаемого йодида поступает в кровь. Йодтиронины также подвергаются дейодированию, но в нормальных. условиях функционирования щитовидной железы это происходит лишь в небольшой степени. Часть Т4 дейодируется в Т3, причем этот процесс ускоряется в условиях дефицита йодида (см. далее).
Лизосомное переваривание коллоидных капель протекает быстро, и свободный гормон, меченный радиоактивным йодом, поступает в кровь уже через несколько минут после появления первых капель коллоида в верхней части клетки. Существуют данные, что в разных фолликулах движение гормона происходит с разной скоростью. Хотя основной процесс эндоцитоза и расщепления тироглобулина в фаголизосомах, по-видимому, одинаков во всех отделах щитовидной железы, но между фолликулами существует функциональная гетерогенность. Тироглобулин, синтезированный в ближайшие к секреции сроки, движется быстрее, чем более «старый» тироглобулин. Это составляет сущность так называемой гипотезы «новый—в первую очередь» [21]. Одной из причин этого служит, по-видимому, тот факт, что по мере созревания тироглобулина он становится более резистентным к протеолизу, вероятно, в результате «уплотнения» четвертичной структуры молекулы и труднее поддается секреторным процессам, чем позднее синтезированный тироглобулин.
Регуляция секреции
Наиболее мощным стимулятором секреции и синтеза тиреоидных гормонов, по своему эффекту намного превосходящим другие стимуляторы, является ТТГ (см. рис. 3—7). В некоторых случаях гиперфункции щитовидной железы (болезнь Грейвса) в роли сильных ее стимуляторов выступают и тиреоидстимулирующие иммуноглобулины, например длительно действующий тиреоидный стимулятор (ДДТС), причем считается, что их действие опосредовано клеточными механизмами, весьма близкими, если не идентичными, тем, которые опосредуют эффекты ТТГ. Показано, что на секрецию тиреоидных гормонов влияют и различные агенты, в норме присутствующие в организме или в щитовидной железе, такие, как простагландины и катехоламины, но эти факторы имеют меньшее значение, чем ТТГ.
Как уже упоминалось, уровень ТТГ в крови зависит от уровня в циркуляции тиреоидных гормонов, особенно Т3, действующего с составе петли отрицательной обратной связи на гипоталамо-гипофизарную ось и регулирующего секрецию ТТГ (см. рис. 3—7). На мембране тиреоидных клеток ТТГ связывается с рецепторами я запускает сложную серию реакций, в том числе активацию аденилатциклазы, что в конце концов приводит к выделению тиреоидных гормонов из клетки. После введения ТТГ секреция гормонов начинается очень быстро, причем она и быстро прекращается после отмены ТТГ.
Реакции щитовидной железы на введение ТТГ. Самыми ранними реакциями, наблюдаемыми в пределах 5 мин после введения животным ТТГ, являются повышение активности аденилатциклазы, усиление йодирования тироглобулина и образования внутриклеточных Т3 и Т4, а также ускорение образования коллоидных капель [22]. Секреция тиреоидных гормонов начинается на 5—10 мин позднее. Интактная или стимулированная в минимальной степени щитовидная железа содержит очень мало коллоидных капель, и основная масса секретируемых под влиянием ТТГ гормонов образуется, очевидно, из фолликулярных запасов тироглобулина. Таким образом, перенос тироглобулина из коллоидного пространства в клеточный матрикс и его протеолиз с высвобождением Т4 и Т3 являются относительно быстрыми процессами. В более поздние сроки (через несколько часов) после введения ТТГ наблюдают увеличение различных параметров клеточного метаболизма, например повышение обмена глюкозы и синтеза фосфолипидов, РНК и белка. Через 48 ч повышается также синтез ДНК и начинается митоз клеток. Ближайшие эффекты ТТГ на метаболизм йодида несколько неожиданны, поскольку вначале между 0 и 4 ч, наблюдается торможение захвата йодида клетками, вслед за чем наступает медленное усиление его [22].
По всей вероятности, большинство, если не все, влияния ТТГ на тиреоидную клетку опосредуются через цАМФ, выступающий в роли 2-го медиатора. Как in vivo, так и in vitro активация аденилатциклазы и образование цАМФ являются одними из наиболее ранних реакций на введение ТТГ. Больше того, все известные метаболические и клеточные реакции, вызываемые ТТГ, можно воспроизвести в экспериментальных системах с помощью цАМФ или его аналога дибутил-цАМФ. Химические и структурные особенности рецептора ТТГ, равно как и клеточные механизмы, с помощью которых ТТГ-рецепторное взаимодействие сопряжено с активацией аденилатциклазы, а также способ, которым эта активация и образующийся в ее результате цАМФ приводят к изменению показателей клеточной активности и биосинтезу и секреции тиреоидных гормонов, все еще выяснены не до конца.
Ауторегуляторные эффекты йодида
Поскольку йод является важной составной частью тиреоидных гормонов, количество этого элемента во внеклеточной жидкости имеет большое значение для гомеостатической регуляции тиреоидной секреции. Недостаточность йода сопровождается повышением эффективности экстракции йодида из крови щитовидной железой и сдвигом отношения синтезируемых и секретируемых Т3 и Т4, что снижает потребности в йоде за счет оптимизации его использования и повышения его активности, приходящейся на молекулу Т3. Инициация этих изменений зависит от снижения концентрации тиреоидных гормонов в крови. Это стимулирует секрецию ТТГ, мобилизацию запасов йода в щитовидной железе и увеличивает соотношение Т3/Т4, синтезируемых в матриксе тироглобулина. Одновременно ускоряется кровоток через щитовидную железу, развивается ее гипертрофия и повышается эффективность экстракции йодида. Происходит также существенное ускорение внутритиреоидного дейодирования свободного Т4 с образованием Т3, что еще больше увеличивает секрецию Т3. Эти изменения зависят не только от повышения секреции ТТГ. Существует и интратиреоидный ауторегуляторный механизм, который каким-то образом контролируется общей концентрацией йода в щитовидной железе [23]. Этот автономный механизм поддерживает повышенный уровень активности некоторых из перечисленных процессов даже в отсутствие ТТГ, если снабжение организма йодом не восстановилось.
Избыток йодида ингибирует синтез и секрецию тиреоидных гормонов. С телеологических позиций такое ингибирование под. влиянием избытка йодида физиологически оправдано. Если бы все увеличенное количество йодида использовалось в биосинтеза тиреоидных гормонов, то это могло бы обусловить избыточную их продукцию и привести к тяжелому гипертиреозу. Выявлено несколько механизмов адаптации к избытку йодида: 1 — острое, хотя обычно и преходящее, торможение органического связывания? йода (эффект Вольфа—Чайкова) [24]; 2—снижение эффективности экстракции йодида из крови; 3 — ингибирование секреций гормонов при чрезмерной стимуляции щитовидной железы. Имеющиеся в настоящее время данные свидетельствуют о том, что при нормальной активности щитовидной железы йодид не угнетает секрецию в заметной степени, но в чрезмерно стимулированных железах он оказывает тормозящее действие [25]. Эта концепция подтверждается отсутствием гипотиреоза у большого; числа больных с хроническими легочными заболеваниями, получающих с лечебной целью массивные дозы йодида. Развитие гипотиреоза у некоторых больных при подобном лечении является вероятно, результатом персистирования эффекта Вольфа — Чайкова, а не первичного снижения скорости тиреоидной секреции.
Механизм, с помощью которого избыток йодида тормозит эти функции щитовидной железы, не известен. Отчасти, вероятно, действие йодида направлено на подавление некоторых процессов тиреоидной секреции, которые стимулируются ТТГ и ДДТС. Известно, что йодид угнетает секрецию тиреоидных гормонов у больных с гипертиреозом, сопровождающим болезнь Грейвса [25], которая, возможно, обусловлена ДДТС, или у больных с автономной гиперфункцией одиночных узлов щитовидной железы (когда снижен уровень как ТТГ, так и ДДТС) [26]. Общим для обоих случаев фактором является гиперактивность тиреоидной ткани. Подобно этому большие дозы йодида могут тормозить секрецию тиреоидных гормонов нормальной щитовидной железой, стимулируемой умеренными дозами экзогенного ТТГ. Вызванное йодидом угнетение секреции у больных с тиреотоксикозом или у эутиреоидных лиц, получающих малые дозы ТТГ, удается быстро ликвидировать назначением больших доз ТТГ, несмотря на продолжающееся введение йодида. Имеются некоторые данные о том, что ингибиторный эффект йодида на тиреоидную секрецию локализуется на какой-то стадии после образования коллоидных капель.
Если в нормальных физиологических условиях избыток йодида и не угнетает секрецию самих тиреоидных гормонов, то он все же влияет на секрецию йодида, образующегося в щитовидной железе при дейодировании йодаминокислот, высвобождающихся внутри железы вследствие протеолиза в процессе секреции. В норме большая часть этого йодида реутилизируется щитовидной железой в основном с помощью йодидного насоса на базальной мембране клеток, задерживающего анион внутри железы. Массивные дозы йодида насыщают емкость этого насоса, вследствие чего йодид, образующийся внутри железы, покидает ее [27]. Этот процесс не должен создавать физиологического преимущества, поскольку, если только органическое связывание йода, необходимое. для синтеза гормонов, не будет подавлено другими механизмами, процесс органификации все же будет обеспечен избытком субстрата.
КАТЕХОЛАМИНЫ
Катехоламины представляют собой дигидроксилированные фенольные амины и включают дофамин, адреналин и норадреналин. Эти соединения продуцируются только в нервной ткани и в тканях, происходящих из нервной цепочки, таких, как мозговой слой надпочечника и органы Цукеркандля. Норадреналин обнаруживается главным образом в симпатических нейронах периферической и центральной нервной системы и действует местно как нейротрансмиттер на эффекторные клетки гладких мышц сосудов, мозга, сердца и печени. Адреналин продуцируется в основном мозговым слоем надпочечников, откуда поступает в кровоток и действует как гормон на отдаленные органы-мишени. Дофамин выполняет две функции: он служит биосинтетическим предшественником адреналина и норадреналина и действует как местный нейротрансмиттер в определенных областях головного мозга, имеющих отношение к регуляции моторных функций.
ЭТАПЫ БИОСИНТЕЗА В СИМПАТИЧЕСКИХ НЕЙРОНАХ
Стадии биосинтеза на пути образования катехоламинов в течение последних 20 лет изучены весьма подробно, причем все принимающие участие в этом процессе ферменты выделены и детально охарактеризованы [28, 29]. Исходным субстратом для биосинтеза служит аминокислота тирозин. В отличие от того, что наблюдают при биосинтезе тиреоидных гормонов, когда тирозин, также являющийся биосинтетическим предшественником, ковалентно присоединен пептидной связью к крупному белку (тироглобулину), в синтезе катехоламинов тирозин используется в виде свободной аминокислоты. Тирозин поступает в организм главным образом с пищевыми продуктами, но в некоторой степени образуется и в печени путем гидроксилирования незаменимой аминокислоты фенилаланина.

Рис. 3—13. Этапы биосинтеза катехоламинов в окончаниях симпатических нервов, мозговом слое надпочечников и головном мозге. Скорость ограничивающими этапами в процессе биосинтеза являются стадия 1 и, возможно, стадия 3. Вертикальные стрелки обозначают торможение отдельных этапов (Melmon К.L. — In: Textbook of Endocrinology/Ed. Williams R.H. 5 th ed. — Philadelphia: Saunders, 1974).
На рис. 3—13 приведены стадии ферментативного биосинтеза катехоламинов. Следует подчеркнуть ряд моментов, касающихся этих биосинтетических процессов. Этапом, ограничивающим скорость этих процессов, который имеет место как в симпатических ганглиях, так и в мозговом слое надпочечников, является превращение тирозина в ДОФА под действием тирозингидроксилазы; в ткани присутствуют очень малые количества ДОФА или дофамина [30]. Активность тирозингидроксилазы регулируется некоторыми факторами, к которым относятся: 1 — присутствие субстрата — тирозина, зависящее от скорости транспорта тирозина в клетку; 2 — восстановленный птеридиновый кофактор, который может содержать Fe2+; 3 — конечный продукт синтетических процессов — норадреналин, действующий через ингибирование продуктом по механизму обратной связи. Активность тирозингидроксилазы может ингибироваться и фенилаланином, но он является неконкурентным ингибитором и приобретает значение только в условиях значительного накопления в клетке, что иногда встречается при заболеваниях, подобных фенилкетонурии.

Рис. 3—14. Биосинтез норадреналина в симпатическом нерве (Axelrod J., Kopin I.J. Prog. Brain. Res., 1969, 31, 21).
НА — норадреналин, МАО — моноаминоксидаза. ДОФА — 3,4-диоксифенилаланин
В нервной ткани содержится большое количество фермента декарбоксилазы ароматических L-аминокислот (ДОФА-декарбоксилаза). Его характеризуют высокие Умакс и сродство к своему субстрату — ДОФА. В результате на общую скорость синтеза дофамина слабо влияют даже мощные ингибиторы этого фермента. В связи с этим декарбоксилирование ДОФА не ограничивает скорость биосинтеза норадреналина. Хотя a-метилдофа является конкурентным ингибитором декарбоксилазы, его снижающее артериальное давление действие осуществляется, вероятно, не путем ингибирования этого фермента, а вследствие того, что продукт его метаболизма a-метилнорадреналин блокирует действие норадреналина на периферические рецепторы [31].
СУБКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ ЭТАПОВ БИОСИНТЕЗА
Дальнейший анализ этапов биосинтеза катехоламинов требует краткого рассмотрения субклеточной локализации этих этапов. Имеющиеся в этой области представления применительно к симпатическому нерву иллюстрируются на рис. 3—14. Аналогичное распределение процессов наблюдается и в мозговом слое надпочечников. Обе реакции — гидроксилирование тирозина и его декарбоксилирование — быстро протекают в клеточном матриксе под действием ферментов цитоплазмы. Продукт декарбоксилирования — дофамин — активно транспортируется АТФ-зависимым механизмом в цитоплазматические пузырьки или гранулы, содержащие фермент дофамин — b-гидроксилазу.
Внутри гранул путем гидроксилирования b-углеродного атома дофамин превращается в норадреналин. Фермент b-гидроксилаза, по-видимому, хранится в виде неактивного предшественника, составляя часть крупного нерастворимого белкового комплекса (с молекулярной массой 290000), известного под названием хромогранина А [32]. Под действием АТФ комплекс b-гидроксилазы и хромогранина приобретает растворимость и тем самым активируется. В этой активной форме он связывается с белком, расположенным на внутренней поверхности мембраны гранулы, где и образуется норадреналин. Такая компартментализация ферментативных стадий синтеза катехоламинов позволяет поднять ряд интересных вопросов, касающихся регуляторных эффектов норадреналина на процессы своего биосинтеза. Как уже упоминалось, норадреналин служит важным регулятором тирозингидроксилазы — фермента, ограничивающего скорость всего процесса биосинтеза. Можно считать, что норадреналин, образующийся в гранулах, по крайней мере в некоторой степени выделяется в цитозоль, где и оказывает свое ингибиторное действие на присутствующую в цитоплазме тирозингидроксилазу. Можно предположить, что какая-то часть норадреналина поглощается нервными клетками из крови, и в регуляции активности синтеза ДОФА может принимать участие именно этот обратный захват норадреналина.
СЕКРЕТОРНЫЙ ПРОЦЕСС В СИМПАТИЧЕСКИХ НЕРВАХ
Высвобождение норадреналина из симпатических нервов происходит путем экзоцитоза [33, 34]. Этот процесс несколько отличается от аналогичного процесса, свойственного секреторным клеткам, продуцирующим полипептидные и белковые гормоны, тем, что из аксональной области нервной клетки выделяется не содержимое гранул, что наблюдается в клетках, продуцирующих белковый эндокринный секрет, а целиком вся окруженная мембраной гранула с ее содержимым [35]. Такой «тотальный» экзоцитоз предполагает необходимость синтеза нового фермента и компонентов мембраны для возмещения их количества, теряемого в результате секреции. Таким образом, последний этап синтеза норадреналина — -гидроксилирование — решительно зависит от синтеза белка. Ингибиторы белкового синтеза вызывают резкое прекращение продукции и секреции норадреналина. Вторым следствием такого секреторного процесса является попадание в кровь b-гидроксилазы. В настоящее время получена антисыворотка к изолированному и очищенному ферменту, и радиоиммунологический анализ с использованием этой антисыворотки представляет собой чувствительный метод определения нейросекреторной активности в условиях, когда уровень катехоламинов в крови оказывается ниже возможностей его измерения [35].
Экзоцитоз, по-видимому, находится под непосредственным контролем со стороны нервной системы. Секреторные гранулы с содержащимися в них катехоламинами выделяются в кровь в ответ на электрическое раздражение. При этом обнаруживается связь с присутствием ацетилхолина и/или входом в клетку ионов кальция и зависимость от энергии, т. е. интактности окислительных процессов или гликолиза. На миграцию секреторных гранул к периферии клетки может влиять сокращение микрофибрилл или микротрубочек. Винбластин и колхицин, известные ингибиторы функций микротрубочек, угнетают выделение катехоламинов. Не вся секреция катехоламинов происходит путем экзоцитоза»

Рис. 3—15. Синтез и реууляция продукции катехоламинов в мозговом слое надпочечников. Образование ДОФА из тирозина под действием тирозингидроксилазы и Превращение дофамина в норадреналин под действием дофамина-р-гидроксилазы регулируется главным образом нервными импульсами. Метилирование норадреналина с образованием адреналина под действием фенилэтаноламин-N-Meтилтрансферазы контролируется в основном дгортикоидами (Axelrod J., Weinshilboum R., N. Engl. J. Med., 1972, 287, 237).
Небольшие их количества непрерывно «просачиваются» в кровь, причем в некоторых условиях необычные вещества, такие, как ацетальдегид, которые накапливаются в организме в результате метаболизма алкоголя, могут способствовать выделению катехоламинов без экзоцитоза. Симпатомиметические амины, такие, как тирамин и амфетамин, стимулируют секрецию катехоламинов и тем самым вызывают физиологически важные прессорные эффекты, что сопровождается истощением тканевых запасов катехоламинов. Резерпин также истощает тканевые запасы катехоламинов, но механизм его действия отличается от механизма действия симпатомиметических аминов. Резерпин ингибирует связывание норадреналина с мембранами гранул, и освобожденный норадреналин диффундирует из гранул и метаболизируется в цитоплазме под действием внутринейрональной моноаминоксидазы. Выделяемые в кровь метаболиты биологически инертны и не вызывают периферических прессорных реакций.
СТАДИИ, ПРОХОДЯЩИЕ В МОЗГОВОМ СЛОЕ НАДПОЧЕЧНИКОВ
Мозговой слой надпочечников и органы Цукеркандля представляют собой специализированные производные симпатической нервной системы. Хотя в мозговом слое надпочечников протекают многие из описанных биосинтетических реакций, в целом биосинтетические и регуляторные стадии в этой ткани некоторыми существенными особенностями отличаются от протекающих в симпатическом нейроне (рис. 3—15). Цитоплазматический фермент фенилэтаноламин-N-метилтрансфераза, который определяет превращение норадреналина в адреналин (этап 4 на рис. 3—13), содержится почти исключительно в мозговом слое надпочечников и органах Цукеркандля; в других тканях нервного происхождения он присутствует лишь в незначительных количествах. Адреналин вырабатывается главным образом мозговым слоем надпочечников и вместе с норадреналином составляет основную массу катехоламинов, количество которых колеблется в пределах 5—10 мг/г ткани надпочечника.
Морфологические исследования показали, что норадреналин и адреналин откладываются в разных клетках мозгового слоя надпочечников. Если синтезировать норадреналин способны все клетки мозгового слоя, то метилировать норадреналин с образованием адреналина способны лишь некоторые специфические клетки. Секреторные, или хромаффинные, гранулы, в которых откладываются эти катехоламины в клетках двух разных типов, также обнаруживают различия по скорости седиментации в градиенте плотности. Не известно, чем обусловлено это различие между гранулами, так как они содержат одни и те же белки и фосфолипиды. Катехоламины откладываются в гранулах в виде комплекса,. состоящего из белка хромогранина А, фермента дофамин-бета-оксидазы и большого количества адениновых нуклеотидов, преимущественно АТФ, присутствующих в стехиометрических количествах по отношению к катехоламинам. Хотя процессы образования хромаффинных гранул расшифрованы неполностью, некоторые экспериментальные данные свидетельствуют о существовании следующего ряда событий. Считают, что подобно гранулам других белоксекретирующих клеток гранулы хромаффинной ткани образуются в пластинчатом комплексе и на первых этапах содержат хромогранин А, дофамин-бета-гидроксилазу и другие белки, синтезируемые в ШЭР и переносимые в пластинчатый комплекс. Затем, по мере созревания гранул, в них активно транспортируются и концентрируются АТФ и дофамин. Полагают, что кислый АТФ нейтрализует основные амины и тем самым обеспечивает возможность более эффективного их накопления в высококонцентрированной форме. Кроме того, АТФ обеспечивает энергией транспортные процессы и, вероятно, также утилизируется при стимуляции продукции катехоламинов.
СЕКРЕЦИЯ
Высвобождение секреторных продуктов хромаффинных клеток происходит путем экзоцитоза. Электронно-микроскопические исследования позволили обнаружить различные морфологические стадии этого процесса (рис. 3—16). Механизм высвобождения включает в себя слияние мембраны гранул с плазматической мембраной и расщепление слившихся мембран. Вследствие этого содержимое гранул высвобождается непосредственно во внеклеточное пространство без предыдущего контакта с цитоплазмой клетки. Мембрана гранулы, освободившись от своего содержимого,, втягивается в клетку путем инвагинации и эндоцитоза и разрушается ферментами после фагоцитирования лизосомами.

Рис. 3—16. Часть «адреналиновой» клетки из мозгового слоя надпочечников; видны плотные хромаффинные гранулы в цитоплазме и в процессе-экзоцитоза. Электронная микрофотография (по данным Grinszpan-Wmograci [34]).
РЕГУЛЯЦИЯ СЕКРЕЦИИ И БИОСИНТЕЗА
Непосредственным физиологическим стимулом для высвобождения катехоламинов является ацетилхолин. Стимуляция электрическим разрядом холинергического преганглионарного чревного. нерва, идущего к надпочечнику, приводит к быстрому выбросу содержимого хромаффинных гранул. Ацетилхолин, выделяющийся из преганглионарных окончаний нерва, действует, по-видимому, на наружную поверхность хромаффинной клетки с помощью пока не выясненного механизма. Ацетилхолин не вызывает высвобождения катехоламинов из изолированных хромаффинных гранул.
Важное регуляторное влияние на синтез катехоламинов оказывают и глюкокортикоиды. Эти вещества и АКТГ, действующий путем стимуляции высвобождения глюкокортикоидов, повышают активность ферментов, принимающих участие в синтезе катехоламинов. Гипофизэктомия приводит к значительному снижению активности этих ферментов, которую можно восстановить введением АКТГ или глюкокортикоидов. Глюкокортикоиды, по-видимому, непосредственно модулируют уровень фермента фенилэтаноламин-N-метилтрансферазы и тем самым количество адреналина, продуцируемого мозговым слоем надпочечников. Однако уровень тирозингидроксилазы и дофамин-|3-гидроксилазы в большей мере зависит от содержания в крови АКТГ, чем глюкокортикоидов. Это позволяет предполагать, что в повышении активности указанных ферментов каким-то образом может участвовать цАМФ, образующийся при действии АКТГ на кору надпочечников. Тесные взаимоотношения метаболических процессов в корковом и мозговом слоях надпочечника оправдываются общими реакциями этих двух эндокринных тканей на физические стрессы. Стресс сопровождается повышением секреции АКТГ и глюкокортикоидов, что в свою очередь способствует продукции адреналина мозговым слоем надпочечников. Таким образом, мозговой слой надпочечников можно рассматривать как один из многих органов-мишеней продуктов коры надпочечников, в которой развиваются изменения при стрессе. Больше того, тесная близость коры и мозгового слоя надпочечников, а также тот факт, что венозный отток из коркового слоя проходит через мозговой, создают анатомическую возможность попадания в последний высоких концентраций глюкокортикоидов прежде, чем они подвергнутся разведению в общей циркуляции.
ИЗБИРАТЕЛЬНОЕ ВЫСВОБОЖДЕНИЕ
Некоторые стимулы избирательно повышают выделение из мозгового слоя надпочечников либо адреналина, либо норадреналина. По-видимому, это обусловливается избирательной стимуляцией того или другого типа клеток мозгового слоя [36]. Гипогликемия или никотин избирательно стимулирует секрецию адреналина и вызывает соответствующее истощение медуллярных запасов адреналина, тогда как закупорка сонной артерии приводит к появлению надпочечникового секрета, содержащего мало адреналина по отношению к норадреналину. Избирательная секреция отдельных катехоламинов вполне могла бы иметь отношение к функциональной роли того или иного из них, так как биологическая активность этих гормонов характеризуется существенными различиями. Норадреналин, например, вызывает сужение сосудов, тогда как адреналин вызывает расширение их в скелетных мышцах и обладает более выраженным метаболическим действием. Исследование влияний эмоционального стресса на секрецию катехоламинов также свидетельствует о дифференцированной реакции. Как правило, пассивное, напряженное, беспокойное поведение сопровождается повышением секреции адреналина, а агрессивные, враждебные реакции сопровождаются преимущественным усилением секреции норадреналина.
МЕТАБОЛИЗМ И ИНАКТИВАЦИЯ
Катехоламины метаболизируются и инактивируются в одной из трех анатомических структур: 1 — внутри нейрона, секретирующего эти соединения, после того, как они попадут обратно в цитоплазму в ходе процесса, известного под названием обратного захвата; 2 — в эффекторных клетках (мишенях) после оказания своего биологического действия и 3 — в печени после удаления из крови. Первый процесс протекает преимущественно в нейронах головного мозга и в периферической нервной системе. Этот обратный захват служит быстрым и экономичным механизмом; прекращения действия катехоламинов, выступающих в роли местных нейротрансмиттеров. Большая часть поглощаемого таким образом амина вновь проникает в секреторные гранулы и повторно используется нейроном в цикле секреторных процессов. Часть, амина, не попадающая в гранулы, разрушается в цитоплазме нейрона. Следует отметить, что процесс захвата путем транспорта через мембрану нейрона и хромаффинной гранулы отличается от-процесса накопления амина в гранулах. Вещества, препятствующие одному процессу, могут практически не влиять на другой;. Так, резерпин, препятствующий накоплению норадреналина, влияет на захват лишь в минимальной степени, а кокаин и трициклические антидепрессанты (имипрамин, имизин), блокирующие захват, не оказывают видимого влияния на накопление. Для элиминации катехоламинов, выделяемых в кровоток мозговым слоем надпочечников, служат главным образом 2-й и 3-й пути метаболизма. Метаболизм катехоламинов определяется сочетанным действием двух ферментов — моноаминоксидазы и катехол-О-метилтрансферазы. Эти ферменты присутствуют в печени, почках, плазме крови и цитоплазме нейронов. Главными метаболитами норадреналина и адреналина являются ванилилминдальная кислота и метокси-оксифенилгликоль, оба экскретируемые с мочой.
Продуктами биологического метаболизма дофамина, обнаруживаемыми в моче, являются гомованилиновая кислота и метокситирамин. Хотя дополнительные минорные О-метилированные метаболиты адреналина и норадреналина — метанефрин и норметанефрин, образующиеся под действием катехол-О-метилтрансферазы, составляют лишь небольшую фракцию мочевых метаболитов, они лучше и непосредственнее отражают количество выделяемых в кровь биологически активных аминов, чем дезаминированные продукты. Катехоламины, поглощаемые эффекторными клетками, такими, как нейроны и гепатоциты, метаболизируются почти полностью. В моче присутствует лишь очень небольшое количество неизмененных аминов.
СТЕРОИДНЫЕ ГОРМОНЫ НАДПОЧЕЧНИКОВ
Кора надпочечников служит главным источником глюкокортикоидных и минералокортикоидных стероидных гормонов и в меньшей степени половых стероидных гормонов. Корковое вещество разделяется на три зоны, которые можно различить по морфологическому виду клеток и продуцируемым ими стероидным соединениям. Самый наружный слой коры — клубочковая зона — является местом синтеза минералокортикоидов, из которых наибольшее функциональное значение у человека и крысы имеют соответственно альдостерон и кортикостерон. Клетки средней зоны — пучковой — продуцируют глюкокортикоиды кортизол и кортизон. Самый внутренний слой — сетчатая зона — также принимает участие в синтезе глюкокортикоидов и, кроме того, как считают, производит небольшое количество стероидных половых гормонов андрогенов и эстрогенов. Главными источниками стероидных половых гормонов, однако, служат половые железы, и продукции половых гормонов корой надпочечников придают функциональное значение только в необычных условиях, когда на путях биосинтеза в надпочечных железах появляются дефекты ферментов. Функциональное подразделение биосинтетической активности коры надпочечников по анатомическим областям основано на результатах гистологических и гистохимических исследований этой ткани после «удаления» ее специфических стимуляторов. Гипофизэктомия и вызываемое ею отсутствие АКТГ приводят к атрофии пучковой и сетчатой зон, тогда как в клубочковой зоне появляются очень небольшие изменения. В то же время хроническая нагрузка натрием вызывает избирательную атрофию клубочковой зоны. Наоборот, при длительной стимуляции АКТГ или ограничении потребления натрия возникает соответственно гипертрофия пучковой и сетчатой или клубочковой зоны. Как будет показано далее, некоторые специфические ферменты, необходимые для образования минерале- и глюкокортикоидов, обнаруживаются только в специфических зонах коркового слоя надпочечников.
СТАДИИ БИОСИНТЕЗА
Биосинтез стероидных гормонов проходит сложную последовательность контролируемых ферментами этапов (рис. 3—17 [37, 38]. Ближайшим химическим предшественником надпочечниковых стероидов является холестерин, который не только поглощается клетками коры надпочечников из крови, но и образуется внутри этих клеток. Синтез холестерина начинается с ацетил-СоА и проходит через ряд промежуточных продуктов. Точное соотношение поглощенного из крови и образованного в самих клетках холестерина неизвестно, но, по-видимому, оба процесса играют существенную роль в обеспечении биосинтеза стероидных гормонов необходимым субстратом. Холестерин, будь то поглощенный из крови или синтезированный в коре надпочечников, накапливается в цитоплазматических липидных каплях (см. раздел, посвященный клеточному пути биосинтеза). Затем в митохондриях холестерин превращается в прегненолон путем образования вначале 20а-оксихолестерола, потом 20а, 22-диоксихолестерола и, наконец, расщепления цепи между 20-м и 22-м углеродным атомом с образованием прегненолона. Считается, что превращение холестерина в прегненолон является ограничивающим скорость этапом биосинтеза стероидных гормонов и что именно этот этап контролируется стимуляторами надпочечников: АКТГ, калием и ангиотензином II. В отсутствие стимуляторов надпочечники образуют очень мало прегненолона и стероидных гормонов. Прегненолон трансформируется в глюко-, минералокортикоиды и половые гормоны тремя разными ферментативными реакциями. Основной путь, наблюдаемый в пучковой зоне, включает дегидрирование 3|3-гидроксильной группы прегненолона с образованием прегн-5-ен-3,20-диона, который затем подвергается изомеризации в прогестерон. В результате серии гидроксилирований прогестерон превращается в 17а-оксипрогестерон под влиянием системы 17а-гидроксилазы, а затем в 17а, 21-диоксипрогестерон (17a-оксидезоксикортикостерон, 11-дезоксикортизол, соединение S) и, наконец, в кортизол в ходе 11b-гидроксилирования (соединение F). У крыс главным глюкокортикоидом, синтезируемым в коре надпочечников, является кортикостерон; небольшое количество кортикостерона продуцируется и в коре надпочечников человека. Путь синтеза кортикостерона идентичен таковому кортизола, за исключением лишь отсутствия этапа 17а-гидроксилирования. Альдостерон образуется из прегненолона в клетках клубочковой зоны путем, отличающимся от пути синтеза кортизола несколькими моментами. Клубочковая зона не содержит 17a-гидроксилазы и поэтому лишена способности синтезировать кортизол. Вместо него образуется кортикостерон, часть которого под действием 18-гидроксилазы превращается в 18-оксикортикостерон и затем под действием 18-оксистероиддегидрогеназы — в альдостерон. Поскольку 18-оксистероиддегидрогеназа обнаружена только в клубочковой зоне, считается, что и синтез альдостерона ограничен этой зоной.

Рис. 3—17. Схематическое изображение внутриклеточного процесса биосинтеза кортикостероидов в надпочечниках. Следует обратить внимание на точку разветвления путей после образования прогестерона, в которой начальное 21-гидроксилирование приводит к образованию минералокортикоидов (кортикостерон, альдостерон), а 17-гидроксилирование — к образованию глюкокортикоидов (кортизол) [Malamed, 39].
Хотя главными физиологически значимыми стероидными гормонами, продуцируемыми корой надпочечников, являются кортизол и альдостерон, эта железа образует и небольшие количества андрогенов и эстрогенов, синтезируемых 3-м путем, в ходе которого 17,20-десмолаза превращает 17-оксипрогненолон и 17а-окси-ирогестерон в слабые андрогены дегидроэпиандростерон и D4-андростендион соответственно. Небольшие количества этих андрогенов превращаются в андрост-4-ен-3,17-дион и тестостерон. По всей вероятности, из тестостерона образуются также небольшие количества эстрогена 17бета-эстрадиола.
В норме превращение прегненолона в конечные продукты — кортизол, альдостерон, кортикостерон и дегидроэпиандростерон — происходит столь быстро, что эти продукты (но ни один из интермедиатов) являются единственными, которые накапливаются в количествах, достаточных для обеспечения физиологически значимой секреции.
Различные ферменты, принимающие участие в биосинтезе стероидов, можно разделить на три класса: гидроксилазы и лиазы (отщепляющие боковые цепи), требующие кислорода и НАДФ-Н; дегидрогеназы, которые используют НАД+ в качестве акцептора водорода и катализируют обратимые реакции; изомеразы, коферменты которых не идентифицированы. Гидроксилазы включают в себя несколько белков; они идентифицированы как ФАД-со держащий флавопротеин, негемовый железопротеин — адренодоксин и протопорфирин, гемопротеин — цитохром Р-450.
Источником восстановительной энергии для гидроксилирования является НАДФ-Н. В митохондриях и гладком эндоплазматическом ретикулуме, по-видимому, происходят близкие мультикомионентные реакции гидроксилирования. Однако компоненты систем в органеллах обоих типов различаются. В митохондриях для переноса электронов на цитохром С или цитохром Р-450 необходим как специфический флавопротеин, так и адренодоксин. В эндоплазматическом ретикулуме главным участником переноса электронов является другой флавопротеин, непосредственно восстанавливающий цитохром С; перенос же электронов на цитохром Р-450 облегчается, по-видимому, фосфолипидом.
Следует отметить существование врожденных клинических состояний, обусловленных дефицитом одного или нескольких ферментов, участвующих в реакциях биосинтеза. В этих условиях скорость ограничивающим становится тот этап биосинтетического процесса, который катализируется дефицитным ферментом, причем накапливаются и секретируются в избыточных количествах предшественники (субстраты) замедленной реакции. В настоящее время выяснены следующие клинические формы этих состояний дефицит 2-гидроксилазы (встречается чаще всего), сочетание дефицита 21-гидроксилазы с дефицитом 18-гидроксилазы, дефицит 11-гидроксилазы и 17-гидроксилазы. Еще две формы являются следствием дефицита либо 3b-оксистероид-дегидрогеназы, либо 18-оксидегидрогеназы. Все эти ферментные блоки приводят к недостаточной продукции и секреции кортизола — наиболее важного регулятора выделения АКТГ по принципу обратной связи. В результате уровень АКТГ в крови резко повышается и кора надпочечников становится объектом интенсивной стимуляции. Развивается выраженная гиперплазия ее. Продукция стероидов, образующихся проксимальнее заблокированного этапа процесса биосинтеза, увеличивается во много раз и достигает патологического уровня. Например, при недостаточности активности 21-гидроксилазы вследствие дефицита кортизола и альдостерона возникают гипогликемия и потеря соли, а вследствие избыточной продукции слабых андрогенов — дегидроэпиандростерона и D4-андростендиона — развивается выраженная вирилизация. Лечение кортизоном или кортизолом приводит к подавлению секреции АКТГ и снижению количества секретируемых надпочечниковых андрогенов.
Некоторые вещества оказывают избирательное ингибиторное действие на ферменты стероидогенеза. Метиранон, 2-метил-1,2-ди-3-пиридил-1-пропанон (SU 4885), снижает или полностью ингибирует 11b-гидроксилазу, что приводит к снижению секреции кортизола и одновременному увеличению секреции дезоксикортикостерона и 11-дезоксикортизола вследствие увеличения секреции АКТГ. Доказана большая клиническая польза метирапонового теста на функциональную целостность надпочечниково-гипофизарной оси; адекватное повышение уровня 11-дезоксикортизола в крови или 17-оксистероидных метаболитов в моче после введения этого вещества является веским доказательством сохранения функции как коры надпочечников, так и гипофиза. Аминоглютетимид (2-этил-2-аминофенил глютарамид) тормозит превращение холестерина в 20a-оксихолестерол; это приводит к накоплению холестерина в коре надпочечников и ингибированию синтеза кортикоидов. Соединение 1,1-дихлор-2-(о-хлорфенил)–2-(р-хлорфенил)-этан (о, р-ДДД) вызывает дегенеративные изменения именно в митохондриях надпочечников, вследствие чего тормозится секреция адренокортикостероидов. Механизм действия этого вещества сводится, по-видимому, к широкому угнетению активности многих ферментов коры надпочечников. Как аминоглютетимид, так и о, р-ДДД с определенным успехом применяются в лечении карциномы коры надпочечников.

Рис. 3—18. Часть адренокортикальной клетки крысы. а — ЛК — липидная капля: М — митохондрия; ГЭР — гладкий эндоплазматический ретикулум; ПМ — плазматическая мембрана. Следует обратить внимание на скудность шероховатого эндоплазматического ретикулума. х21 000; б — круглые структуры в матриксе митохондрий — это срезы через пузырьки и в некоторых случаях— через трубочки. Стрелками показаны взаимосвязи между трубочками и/или пузырьками (см. рис. 3—19) (Malamed). Электронная микрофотография. х42 700.
СУБКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ ЭТАПОВ БИОСИНТЕЗА
Исследование ультраструктуры клеток паренхимы коры надпочечников млекопитающих выявило три четкие особенности, свойственные этому органу и некоторым другим стероидпродуцирующим клеткам, таким, как интерстициальные клетки яичников и семенников (рис. 3—18) [39]. Этими особенностями являются: 1—присутствие широкой сети гладкого эндоплазматического ретикулума без прикрепленных к нему рибосом и практически отсутствие ШЭР; 2 — присутствие большого количества липидных капель; 3 — присутствие высокоспециализированных и характерных митохондрий, структурно отличающихся от митохондрий других клеток тем, что они содержат трубчатые, пальцевидные инвагинации в складках внутренней мембраны (кристах) (рис. 3—19) Эти ультраструктурные особенности соответствуют особенностям биосинтеза стероидных гормонов в клетках коры надпочечников. Ферментативные этапы биосинтеза стероидов в клетке локализуются внутри мембран гладкого эндоплазматического ретикулума и митохондрий. Липидные капли содержат холестерин — сырой материал для синтеза стероидов; внутри капель заключено 75% общего количества холестерина в клетке, 8% находится в гладком эндоплазматическом ретикулуме, а остальное—в митохондриях.
Рис. 3—19. Предполагаемое строение митохондрий клеток коры надпочечников. Рисунки выполнены на основе электронно-микроскопической картины поперечных срезов адренокортикальных клеток (см. рис. 3—186) (Malamed [39]).
Относительная скудность рибосом отражает тот факт, что ферменты, участвующие в отдельных реакциях биосинтеза гормонов, стабильны, не покидают клетку и обладают длительным периодом полужизни в клетке. Эта особенность клеток коры надпочечников резко отличает их от клеток, секретирующих белковые гормоны, и, например, от клеток мозгового слоя надпочечников, в котором ключевой фермент синтеза катехоламинов — b-гидроксилаза — секретируется из клетки. В клетках, богатых рибосомами и ШЭР, кругооборот белков происходит с высокой скоростью и соответственно требуется большая скорость синтеза белка, чтобы возместить потери его в результате секреции во внеклеточное пространство.
Исследования с фракционированием клеток и применением цитохимической идентификации отдельных процессов способствовали выяснению локализации ферментов биосинтеза в тех или иных субклеточных пространствах (см. рис. 3—17). Необходимо учитывать, однако, возможность получения артефактов в связи с неспецифической адсорбцией ферментов на субклеточных фракциях. Ионы ацетата полимеризуются в холестерин из ацетил-СоА в гладком эндоплазматическом ретикулуме. У животных некоторых видов определенные количества холестерина поступают в клетку и пз плазмы крови. Последующие реакции протекают в митохондриях, где холестерин превращается в прегненолон. Прегненолон покидает митохондрию и вновь проникает в гладкий эндоплазматический ретикулум, в котором образуется прогестерон и, следуя по глюкокортикоидному пути, далее гидроксилируется в 17-м и 21-м положениях, образуя 17-окси-дезоксикортикостерон (11-дезоксикортизол). Последний этап—11-гидроксилирование — происходит в митохондриях. Образование минералокортикоидов несколько отличается от образования глюкокортикоидов. Оба эти пути расходятся на стадиях после образования прогестерона. Альдостерон синтезируется за счет 21-гидроксилирования прогестерона в гладком эндоплазматическом ретикулуме, вслед за чем происходят 11-, 18-гидроксилирование и, наконец, превращение под действием 18-дегидрогеназы; все эти процессы протекают в митохондриях (см. рис. 3—17).
Тесное сопряжение ферментативных реакций, протекающих в митохондриях и гладком эндоплазматическом ретикулуме, подтверждается ультраструктурными наблюдениями, свидетельствующими о близком соседстве митохондрий, эндоплазматического ретикулума и липидных капель. Высокая складчатость и трубчатая структура митохондриальных и ретикулярных мембран создает большую поверхность, на которой могут разворачиваться ферментативные процессы.
Если схема, приведенная на рис. 3—17, верна, то внутриклеточная локализация стероидогенеза трижды перемещается из гладкого эндоплазматического ретикулума в митохондрии. Это предполагает перемещение субстратов или мембран органелл или тех и других вместе. Клеточные и молекулярные механизмы, направляющие эту серию внутриклеточных транслокаций, точно не известны.
Транспорт прегненолона из митохондрий в эндоплазматический ретикулум зависит не от связывания с белками цитозоля, а скорее от сильной ассоциации с какими-то молекулами в эндоплазматическом ретикулуме. Это обеспечивает в равновесных условиях высокую концентрацию прегненолона в эндоплазматическом ретикулуме по сравнению с его концентрацией в цитозоле. Такой перенос в эндоплазматический ретикулум поддерживает разницу концентраций между митохондриями и цитозолем, что, по-видимому, и обеспечивает постоянную диффузию из митохондрий.
Очертить морфологию пути секреции стероидных гормонов в клетках коры надпочечников не представляется возможным. Не удается точно идентифицировать дискретные секреторные гранулы или пузырьки. Одной из причин отсутствия сведений по этому вопросу является накопление лишь очень малого количества стероидных гормонов перед их выделением из железы. Морфологическое следствие такого отсутствия отложения гормонов заключается в том, что в клетках коры надпочечников присутствует, вероятно, очень мало органелл (гранул, пузырьков), в которых обычно хранятся внутриклеточные запасы веществ. Возможно, однако, что какая-то часть липидных капель, в избытке присутствующих в клетке, содержит стероидные гормоны, высвобождающиеся из клетки путем экзоцитоза.
РЕГУЛЯЦИЯ СЕКРЕЦИИ
Регуляция функции коры надпочечников будет рассмотрена на примере некоторых сторон контроля за секрецией и синтезом кортизола.
Наиболее важным, если не единственным, физиологическим регулятором продукции кортизола является. АКТГ [40, 41]. Длительное повышение уровня АКТГ в крови, наблюдаемое при некоторых опухолях гипофиза или других, не гипофизарных, опухолях с эктопической продукцией АКТГ, сопровождается гиперплазией надпочечников и гиперкортицизмом. Напротив, гппофизэктомия приводит к атрофии надпочечников, особенно пучковой и сетчатой зон. Синтез и секреция АКТГ в свою очередь регулируются уровнем кортизола в крови путем замыкания ингибиторной петли обратной связи непосредственно на аденогипофизе. Полагают, что кортизол может действовать также на гипоталамические и другие мозговые центры, регулируя продукцию кортикотропин-рилизинг фактора, но убедительных доказательств существования такого регуляторного пути пока не получено. Несомненно, однако, что влияние ЦНС является важной детерминантой высвобождения АКТГ. Разнообразные стрессы, такие, как гипогликемия, тяжелая травма и болезни, а также эмоциональные стрессы, стимулируют секрецию АКТГ, несмотря на присутствие в крови таких уровней кортизола, которые в норме оказывают ингибиторное действие. Основной регулятор секреции АКТГ и, следовательно, продукции кортизола, по всей вероятности, действительно образуется в головном мозге. Уже много лет известно, что секреция АКТГ и кортизола обнаруживает суточные ритмы, определяемые «биологическими часами», расположенными в головном мозге и подчиняющимися конкретным циклам свет — темнота и/или бодрствование — сон [42, 43]. У здоровых людей, бодрствующих днем и спящих ночью, максимальная скорость секреции приходится на период между полуночью и рассветом, а минимальная регистрируется после полудня и ранним вечером. Примерно 80—90% общей суточной секреции кортизола приходится на период между 4 и 6 ч утра. В интервале между этими периодами железа остается в спокойном состоянии. Подробные исследования характера секреции у здоровых людей, проводимые путем анализа проб крови, отбираемых в течение 24 ч с частыми интервалами, обнаружили существование нерегулярных выбросов
АКТГ и кортизола, разделенных промежутками полного отсутствия секреции [44]. Такая эпизодическая секреция, по-видимому, вообще характерна для гормонов передней доли гипофиза, поскольку СТГ, пролактин, ЛГ и ФСГ также секретируются «вспышками». Причины и физиологическая значимость такого нерегулярного характера секреции не известны. Эта нерегулярность не определяется соответствующими колебаниями уровня содержания в крови тех или иных гормонов, продукция которых контролируется гипофизарными гормонами, но накладывается на гораздо более широкие во времени колебания, реципрокно связанные с уровнем в крови продуктов, выделяемых органами-мишенями.
Влияние АКТГ на секрецию кортизола надпочечниками проявляется быстро [41]. Повышение уровня кортизола в крови отмечается уже в пределах 2—3 мин после введения АКТГ человеку или экспериментальному животному. Поскольку клетки коры надпочечников содержат мало депонированного кортизола, эти быстрые эффекты АКТГ предполагают повышение скорости биосинтеза стероидов, а не ускорение секреции уже готового гормона. Такое быстрое действие должно сказываться на реакциях, происходящих до гидроксилирования и отщепления боковой цепи холестерина или во время этих процессов и обусловливающих образование прегненолона, поскольку именно этот этап идентифицирован в качестве скорость ограничивающего в процессе биосинтеза стероидов.
МЕХАНИЗМ ДЕЙСТВИЯ АКТГ
Считают, что в клеточных механизмах, с помощью которых АКТГ влияет на высвобождение и синтез кортизола и других стероидных гормонов коры надпочечников, участвует активация связанной с клеточной мембраной аденилатциклазы, подобно тому, что наблюдается при активации секреторных и клеточных процессов во многих других тканях [41]. АКТГ специфически и с высоким сродством связывается с рецепторами, расположенными на плазматической мембране клеток коры надпочечников, что приводит к активации аденилатциклазы и образованию цАМФ. Последующие молекулярные реакции менее выяснены, но, по всей вероятности, цАМФ обусловливает фосфорилирование одной или более протеинкиназ, тем самым переводя их из неактивных комплексов в форму активных каталитических субъединиц, которые в свою очередь фосфорилируют и, следовательно, активируют ферменты, принимающие участие в процессах биосинтеза стероидов. Точная природа последних стадий в серии происходящих реакций не известна, и модели, изображающие эти реакции, в настоящее время следует считать лишь предположительными. Одна такая модель представлена на рис. 3—20. Эта схема предусматривает возможность двух, не противоречащих имеющимся сведениям, реакций, с помощью которых фосфорилированные протеинкиназы контролируют (активируют) ранние стадии синтеза стероидов. Одна из них предполагает повышение внутримитохондриального связывания холестерина и цитохрома Р-450, что является важным этапом ферментативного гидроксилирования и отщепления боковой цепи холестерина с образованием прегненолона вследствие активации гипотетического лабильного интермедиата (холестерин-Р-450).
Другой реакцией, которая могла бы контролироваться активированной протеинкиназой, является фосфорилирование и последующая активация цитоплазматического фермента холестеринэстеразы, которая расщепляет эфир холестерина с образованием свободного холестерина. Эти предполагаемые объекты действия протеинкиназ соответствуют данным, полученным при кинетическом анализе скорости реакций на различных стадиях биосинтеза стероидов и показавшим, что скорость ограничивающим этапом является превращение холестерина в прегненолон.

Рис. 3—20. Предполагаемый механизм действия АКТГ на клетку коры надпочечника. Согласно этой модели, АКТГ не проникает в клетку, а стимулирует продукцию второго медиатора—цАМФ—путем активации связанной с рецептором аденилатциклазы в плазматической мембране. Холестерин может образовываться в гладких микросомах до проникновения в липидные капли (см. рис. 3—19) (Simpson E.R. и соавт., J. Biol. Chem., 1978, 235, 3135),
ВИТАМИН D: БИОГЕНЕЗ И МЕТАБОЛИЗМ
В начале века впервые был обнаружен и назван витамином D жирорастворимый фактор, содержащийся в печеночной ткани животных и рыб и обладающий способностью излечивать рахит. Позднее было показано, что аналогичный антирахитический фактор может образовываться в коже млекопитающих и в некоторых растениях (зерновые, бобовые) под влиянием ультрафиолетовых лучей [45, 46]. Это открытие означало, что данный фактор не является витамином в строгом смысле, поскольку он вырабатывается в коже и переносится кровью к объектам своего действия в отдаленных тканях-мишенях, что является характерной особенностью гормонов. Таким образом, витамин D представляет собой и витамин, если он поступает в организм извне, и гормон, если он образуется в коже под действием ультрафиолетовых лучей.
ХИМИЯ
Исследования, проведенные до 30-х годов, привели к выяснению структуры витаминов D3 (холекальциферол) и D2 (эргокальциферол), которые представляют собой 9,10-секо-производные 7-дегидрохолестерина (холеста-D5,7-диена) и эргостерола (эргоста-D5,7-диена), соответственно [47, 48]. Витамин D3—это именно та форма витамина, которая образуется в коже под влиянием ультрафиолетовых лучей и депонируется в печени, а витамин D2 образуется при облучении растительных стеролов.
Интенсивные исследования, проведенные в течение последних 20 лет, позволили расшифровать процесс биосинтеза, включающий последовательное гидроксилирование, которое превращает неактивные стероловые предшественники в активную форму витамина D — 1,25-диоксивитамин D [1,25 (OH)2D] [49—51].
ЭТАПЫ БИОСИНТЕЗА: ФОТОБИОГЕНЕЗ И МЕТАБОЛИЗМ
Схема стадий биосинтеза витамина D3 (холекальциферол) приведена на рис. 3—21. Субстратом синтеза 7-дегидрохолестерина — «провитамина» служит ацетил-СоА. Ультрафиолетовый фотолиз провитамина приводит к образованию 6,7-цис изомера, называемого «провитамин D3» (преD3). Этот изомер под действием температуры превращается в коже в витамин D3. Аналогичная группа реакций наблюдается и при образовании витамина D2 (эргокальциферол) из провитамина эргостерола. Витамины В3 и Da затем транспортируются на специфических, связывающих витамин D, белках плазмы в печень, где карбоксилируются по 25-му углеродному атому (С-25) с образованием одного из главных циркулирующих в крови метаболитов — 25-оксивитамина D (25-OHD). Хотя именно печень является главным местом 25- гидроксилирования витамина D, однако в некоторой степени оно происходит и в других органах. Витамин D3 25-гидроксилаза локализуется в микросомах печени (и других органов), причем ферментативная реакция в качестве кофакторов требует восстановленного НАДФ и молекулярного кислорода. В физиологических концентрациях ни витамин D, ни 25-OHD не способны стимулировать транспорт кальция в кишечнике или мобилизацию кальция из костей.
Конечной активной формой витамина является 1,25(ОН)2D. Этот дважды гидроксилированный метаболит образуется в почках путем гидроксилирования 25-OHD, синтезируемого в печени и транспортируемого белковыми переносчиками плазмы в почки. Считается, что почки являются главным, если не единственным местом локализации la-гидроксилазы 25-OHD. В отличие от 25-гидроксилазы витамина D, которая присутствует в печеночных микросомах, 1a-гидроксилаза 25-OHD локализуется в митохондриях почечных клеток, и реакция гидроксилирования требует присутствия НАДФ-Н, молекулярного кислорода и ионов магния. Кроме того, этот фермент представляет собой оксидазу со смешанными функциями, зависимую от цитохрома Р-450. 1,25(OH)2D транспортируется белками-переносчиками плазмы в специфические клетки-мишени кишечника и скелета, где и оказывает свое биологическое действие. О точной природе белков плазмы, участвующих в транспорте витамина D и его метаболитов, известно мало. По-видимому, они являются a-глобулинами, но не ясно, один или несколько белков выполняют эту транспортную функцию.
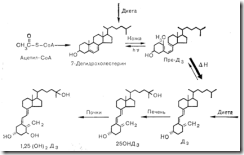
Рис. 3—21. Начальные этапы биосинтеза витамина D. 7-Дегидрохолестерин (провитамин D), образующийся из ацетил-СоА, накапливается в коже, где в ответ на солнечное или ультрафиолетовое излучение вследствие фотометаболизма превращается в витамин В3 (холекальциферол) через промежуточные стадии, включающие образование превитамина D.
Механизм действия 1,25(OH)2D, очевидно, сходен с механизмом действия надпочечниковых и половых стероидов тем, что в нем участвует связывание дигидроксилированного витамина с цитозольными рецепторными белками. Витаминорецепторный комплекс затем транслоцируется в ядро, в котором он стимулирует синтез РНК и в результате синтез связывающих и/или транспортирующих кальций белков. Современные данные убедительно свидетельствуют о том, что 1,25(OH)2D является конечной активной формой витамина и что она представляет собой конечный продукт последовательных реакций гидроксилирования. Через несколько часов после введения животным меченого 1,25 (ОН)2D, когда уже отчетливо виден транспорт кальция в кишечнике и скелете, большую часть меченого вещества удается обнаружить в неизмененном виде; это свидетельствует о том, что для проявления биологической активности дальнейший метаболизм не требуется. Некоторые исследователи, однако, в экстрактах кишечника идентифицировали небольшие количества трижды гидроксилированного метаболита — 1,24,25-триоксивитамина D, — причем кишечник содержит, по-видимому, и фермент, способный гидроксилировать 1,25 (ОН)2D в 24-м положении. Таким образом, возможно, хотя и не доказано, что определенная часть биологической активности 1,25(OH)2D в кишечнике обусловлена его гидроксилированием в 1,24,25 (ОН)2D. Помимо уже описанных реакций гидроксилирования, в почках и, вероятно, в других тканях присутствуют активности, гидроксилирующие 25-OHD в 24-м положении, что приводит к образованию 24,25 (ОН)2D. Биологические эффекты этого особого дважды гидроксилированного метаболита выяснены неполностью. По крайней мере, одна из его функций могла бы заключаться в ингибировании секреции паратиреоидного гормона (см. далее).
Биосинтетический путь образования биологически активного витамина D через последовательные реакции гидроксилирования отличается от пути образования стероидных гормонов надпочечников по крайней мере одним интересным аспектом. Все ферментативные стадии, необходимые для гидроксилирования и синтеза стероидных гормонов надпочечников, происходят в одном и том же органе — коре надпочечников, и в одной и той же клетке коры, хотя и в разных субклеточных органеллах. В отличие от этого, различные этапы гидроксилирования на пути синтеза ди- и тригидроксилированных метаболитов витамина D происходят по крайней мере в трех разных органах (кожа, печень и почки), что делает необходимым существование высоко избирательных процессов захвата, ферментативной модификации и выделения метаболитов, равно как и транспорта промежуточных метаболитов из органа в орган через кровоток. Факт столь разительного отличия путей биосинтеза, происходящего в ходе последовательного гидроксилирования этих двух видов стероидных гормонов безусловно интересен. Хотя причины таких различий не известны, можно было бы предположить, что они связаны с эволюцией механизма, обеспечивающего существование множества пунктов, в которых происходит регуляция образования активной формы витамина D.
РЕГУЛЯЦИЯ
Главная регулируемая стадия биосинтеза витамина D локализуется на уровне превращения 25-OHD в 1,25 (ОН)2D под влиянием 1a-гидроксилазы 25-OHD в почках. Биосинтез витамина может в какой-то степени регулироваться и на уровне 25-гидроксилирования в печени, а также на уровне превращения провитамина D в витамин D в коже, но общее значение этих регуляторных этапов не выяснено.

Рис. 3—22. Схематическое изображение предполагаемых пунктов регуляции в процессе метаболизма витамина D.
1 — 25-гидроксилирование в печени; 2 — 1-гидроксилирование в почках: паратиреоидный гормон стимулирует, а гиперфосфатемия подавляет превращение 25-оксивигамина D3 в 1,25-диоксивитамина D3: 3 — действие 1,25-диоксивитамина D3 на цитозольные рецепторы в кишечнике и кости — главных органах-мишенях (НаЬег J.F., Mahaffey J.E., Ann. Rev. Med., 1978, 29, 327).
С физиологической точки зрения важно, что активность почечной 1a-гидроксилазы 25-OHD находится в обратной зависимости от уровня ионизированного кальция во внеклеточной жидкости. Так, снижение уровня ионизированного кальция в плазме приводит к усилению образования 1,25 (ОН)2D из его предшественника 25-OHD и, наоборот, повышение уровня кальция подавляет образование дигидроксилированного метаболита. В первом случае всасывание кальция в кишечнике и резорбция его из скелета стимулируются, тогда как во втором случае эти процессы тормозятся и, таким образом, происходит обратный сдвиг уровня кальция во внеклеточной жидкости в направлении его нормализации. Однако кальций, вероятно, изменяет активность 1a-гидроксилазы не непосредственно. Он осуществляет свое влияние опосредованно путем регуляции высвобождения паратиреоидного гормона в кровь, а паратиреоидный гормон уже действует на почки, регулируя степень гидроксилирования в 1-м положении (рис. 3—22). По-видимому, это действие паратиреоидного гормона на процесс 1-гидроксилирования также не прямое, а опосредуется влиянием гормона на трансмембранные потоки фосфатного иона в клетках почечных канальцев. Активность la-гидроксилазы, очевидно, непосредственно зависит от окружающей концентрации фосфатного иона; гипофосфатемия стимулирует, а гиперфосфатемия угнетает образование 1, 25(OH)2D.
Помимо фосфатных ионов, оказывающих сильное влияние на. скорость образования 1,25 (ОН)2D, другие факторы могут регулировать или модулировать активность 1a-гидроксилазы и в результате—количество 1,25 (ОН)2D, продуцируемое почками. К таким факторам относятся пролактин, половые стероиды, глюкокортикоиды и инсулин. Относительное значение этих гормонов в регуляции биосинтеза витамина D в настоящее время не известно, по возможность участия некоторых гормонов гипофиза половых желез и поджелудочной железы в регуляции биосинтеза и метаболизма витамина D открывает новые интересные области исследования сложных взаимоотношений гормональных эффектов в регуляции метаболизма кальция в костях скелета.
ДЕЙСТВИЕ ГОРМОНОВ: РЕГУЛЯЦИЯ ФУНКЦИИ КЛЕТОК-МИШЕНЕЙ БЕЛКОВЫМИ, ТИРЕОИДНЫМИ И СТЕРОИДНЫМИ ГОРМОНАМИ
ВВЕДЕНИЕ: ОБЩИЕ АСПЕКТЫ ДЕЙСТВИЯ ГОРМОНОВ
Все формы биологической регуляции основаны на взаимодействии между комплементарными молекулами, приводящем к изменению свойств и функции одного или обоих лигандов. Этот тип-передачи молекулярной информации в законченном виде используется рецепторами гормонов и регуляторными ферментами — системами, обладающими многими общими чертами. Действительно, большинство «рецепторов» гормонов и трансмиттеров непосредственно или косвенно сопряжено с ферментными белками, усиливающими эффект связывания лиганда путем передачи его на последующие метаболические и биосинтетические этапы. В самом простом смысле, гемоглобин выполняет роль рецептора кислорода и служит одним из многих связывающих и/или транспортных белков, обеспечивающих распределение небольших молекул в организме. В плазме обнаружено огромное число связывающих белков для циркулирующих лигандов, в том числе стероидные и тиреоидные гормоны, а также металлы, липиды и витамины. Связывание лигандов с такими белками, как правило, не изменяет активности молекул носителя, которые служат главным образом резервуаром, а иногда средством транспорта гормональных и других лигандов. Такие связывающие белки поэтому аналогичны рецепторам только по своим «распознавательным» свойствам.
Особенностью клеточных рецепторов гормонов, если не считать их локализации в чувствительных к гормонам тканях, является способность связывать природные или синтетические гормональные лиганды с высокой специфичностью и активировать реакции, опосредуемые и детерминируемые эффекторными системами клетки-мишени. Способность распознавать и активировать означает, что для перевода внешних сигналов в реакции клетки-мишени рецепторная молекула должна обладать двумя отдельными участками или конформациями. Существование таких связывающих и активирующих доменов в рецепторных белках доказывается данными исследования разнообразных гормональных рецепторов, расположенных как в цитоплазме, так и на плазматической мембране клеток-мишеней.

Рис. 4—1. Общие механизмы действия гормонов на клетки-мишени.
КЛАССЫ ДЕЙСТВИЯ ГОРМОНОВ И ДОМЕНЫ ГОРМОНАЛЬНОГО КОНТРОЛЯ
Эволюция механизмов гормонального контроля в многоклеточных организмах обусловила развитие двух четко определенных регуляторных систем, интегрирующих функции клеток-мишеней эндокринных воздействий (рис. 4—1). Более широко распространена система, контролируемая стероидными гормонами, которые регулируют ферменты, определяющие метаболическую и секреторную активность огромного числа периферических тканей. Эти относительно неполярные и гидрофобные гормоны секретируются надпочечниками и половыми железами и разносятся кровью в связанном с белками плазмы виде, чтобы сохранять эффективную концентрацию свободного стероида во внеклеточной жидкости. Свободные стероиды, по-видимому, диффундируют во все клетки, но оказывают свое метаболическое действие только на ткани-мишени, обладающие специфическими внутриклеточными связывающими белками. Эти внутриклеточные рецепторы в свою очередь опосредуют влияние стероида на ядерные процессы, определяющие синтез белка. В некоторых клетках эффекты стероидов проявляются синтезом регуляторных ферментов, контролирующих метаболические реакции, что подтверждается действием кортикостероидов на углеводный и белковый обмен. В других, более специализированных, тканях стероиды ответственны за клеточную дифференцировку и образование специфических белков, высвобождаемых в кровь или утилизируемых местно для вторичных процессов, что наблюдается в репродуктивных тканях, находящихся под контролем половых стероидов. Как правило, стероиды надпочечников индуцируют образование ферментов, контролирующих внутриклеточные метаболические функции, тогда как половые стероиды стимулируют также синтез белков, секретируемых клеткой-мишенью и участвующих в механизме размножения. Эти две крайности значительно перекрываются, и многие эффекты половых стероидов оказываются связанными с регуляцией внутриклеточных метаболических процессов в периферических тканях-мишенях. Анализ действия половых стероидов, таких, как эстрадиол и прогестерон, на синтез белков яйцеводов, в том числе на овальбумин и авидин, привел к существенному прогрессу в понимании молекулярной биологии эффектов стероидных гормонов.
Свойства и действия тиреоидных гормонов во многих отношениях аналогичны таковым стероидов, несмотря на их очевидное сходство с пептидными гормонами и аминокислотными трансмиттерами. Тиреоидные гормоны, например, обладают липофильными свойствами, что более характерно для стероидов, чем для пептидных гормонов с их гидрофильной природой. Подобно этому, тиреоидные гормоны в крови в основном связаны со специфическими белками плазмы и диффундируют в свои клетки-мишени через небольшой пул свободного внеклеточного гормона. Тиреоидные гормоны также действуют путем связывания с внутриклеточными рецепторами и, подобно стероидам, оказывают в основном свое действие путем регуляции ядерных процессов, что приводит к изменению биосинтетической и метаболической активности клетки-мишени [2].
В отличие от преимущественно ядерных эффектов стероидных и тиреоидных гормонов, действие пептидных гормонов опосредовано рецепторами клеточной поверхности, регулирующими ферментные системы плазматической мембраны и цитоплазмы. Это справедливо и в отношении простых трансмиттерных молекул, таких, как катехоламины и ацетилхолин, и в отношении многих пептидных, белковых и гликопротеиновых гормонов. Такие молекулы взаимодействуют со специальными участками плазматической мембраны, которые распознают и связывают регуляторные лиганды [3]. Специфическое связывание с этими рецепторами клеточной поверхности изменяет активность связанных с мембраной эффекторных ферментов, которые, контролируя мембранные и/или цитоплазматические процессы, опосредуют тем самым острые и долговременные изменения функции клетки-мишени. В некоторых тканях-мишенях, таких, как зависимые от гипофиза периферические эндокринные органы (надпочечники, щитовидная и половые железы), от действия пептидных гормонов зависит сохранение клеточной дифференцировки и функции. В этом смысле, тропные гормоны гипофиза (АКТГ, ТТГ, ФСГ) обладают некоторым функциональным сходством с половыми стероидами, поддерживающими дифференцированное состояние и секреторную активность гормонзависимых клеток-мишеней. Другие пептидные гормоны, такие, как инсулин, пролактин и СТГ, по своей функции больше напоминают стероидные гормоны надпочечников, так как вызывают быстрые и долговременные изменения метаболических процессов, а не обеспечивают дифференцировку клеток-мишеней.
Приведенные обобщения относительно метаболических эффектов стероидных, тиреоидных и пептидных гормонов, удобны для широкой функциональной классификации гормональных эффектов, но не следует упускать из виду областей перекрывания биохимических функций этих разных классов лигандов. По существу гормоны представляют собой циркулирующие «сигналы» или информационные посылки, которые, будучи узнанными и связанными соответствующими поверхностными или внутриклеточными рецепторами, вызывают запрограммированные реакции своих клеток-мишеней. Проводить общее различие между стероидными и тиреоидными гормонами, с одной стороны, и пептидными гормонами, с другой, как регуляторами «ядерных» и «цитоплазматических» процессов соответственно удобно для дифференцирования крайних особенностей действия этих лигандов. В то же время известно, что стероидные и тиреоидные гормоны оказывают и вне-ядерное действие, а некоторые пептидные гормоны влияют, по-видимому, и на экспрессию генов. В связи с этим с позиций способности регулировать метаболическую активность клетки и вызывать функциональные реакции на стимуляцию, два общих класса гормонов не имеют абсолютных различий.
РЕЦЕПТОРЫ ПЕПТИДНЫХ ГОРМОНОВ ОПРЕДЕЛЕНИЯ И ОБЩИЕ ЗАМЕЧАНИЯ
Пептидные гормоны и молекулы трансмиттеров оказывают свое действие на клетки-мишени, связываясь прежде всего со специфическими, обладающими высоким сродством, рецепторными участками на плазматической мембране. Существование таких рецепторов обнаружено прямыми исследованиями по связыванию радиоактивных лигандов в огромном числе клеток-мишеней пептидных гормонов и нейротрансмиттеров. В некоторых тканях насыщенность специфических связывающих мест меченым гормоном коррелирует с активацией характерных для клеток-мишеней реакций, что указывает на биологическую значимость таких мест в качестве рецепторов гормонов. В других тканях пептидные рецепторы идентифицированы условно только по высокому сродству и специфичности связывания биологически активных форм гормональных гомологов. Применение конкурентных антагонистов (если они существуют), блокирующих как связывание гормона, так и последующую реакцию клетки-мишени, позволило получить дополнительные доказательства биологической значимости нескольких гормональных рецепторов. Некоторые рецепторные места, например для ацетилхолина и катехоламинов, охарактеризованы с помощью меченых антагонистов. Относительно низкое сродство ацетилхолиновых рецепторов к холинергическим лигандам или низкая концентрация специфических b-адренергических мест на клетках-мишенях создают трудности для характеристики этих рецепторов путем исследований с применением меченых агонистов.

Рис. 4—2. Концепция, предложенная Sutherland, согласно которой гормону отводят роль первого медиатора, а цАМФ (или другим веществам) — второго (внутриклеточного) медиатора, с помощью которого осуществляется действие пептидных гормонов (Sutherland, Robison [4] в модификации).
Мнение о клеточной мембране как о месте действия пептидных гормонов сформировалось на основании наблюдений Sutherland, согласно которым взаимодействие катехоламинов с плазматической мембраной эритроцитов голубя приводит к активации аденилатциклазы [4]. После этого было показано, что многие пептидные гормоны связываются с рецепторами плазматической мембраны и влияют на локализованную в ней активность, такие, как аденилатциклаза или механизмы ионного транспорта (рис. 4—2). О поверхностной локализации рецепторов пептидных гормонов свидетельствует и тот факт, что кратковременное воздействие гормона вызывает длительную реакцию клеток-мишеней, которую можно отнести за счет связанного гормона, а также способность специфических антисывороток быстро прекращать действие пептидных гормонов in vitro. Известно также, что ферменты или другие агенты, влияющие на мембранные белки и липиды, модифицируют или ликвидируют способность пептидных гормонов стимулировать аденилатциклазу. Наиболее веские доказательства локализации рецепторов пептидных гормонов на плазматической мембране были получены в авторадиографических исследованиях и прямых опытах по связыванию меченых биологически активных гормонов с препаратами мембран или интактными клетками. Эти подходы позволили точно выяснить локализацию и параметры связывания клеточных рецепторных участков, а также их функциональную связь с реакциями клетки-мишени.
Способность пептидных гормонов взаимодействовать с клетками-мишенями (или наоборот) должна зависеть от присутствия специфических участков связывания на плазматической мембране (рецепторов), которые извлекают несущие информацию молекулы из внеклеточной жидкости. Так, «осведомленность» клеток пучковой зоны коры надпочечников в отношении гипофизарных регулирующих влияний определяется концентрацией и профилем секреции АКТГ, поступающего к надпочечным железам. Чрезвычайно низкие концентрации (около 10~10 M) гипофизарных гормонов в крови при миллионнократном избытке других белков требуют, чтобы рецепторы клеток-мишеней обладали как высокой специфичностью (позволяющей узнавать гормон), так и высоким сродством к гормону (позволяющим связывать его при низкой концентрации). Хорошо изученный класс рецепторов для «традиционных» пептидных гормонов (таких, как тропные пептиды гипофиза и гормоны желудочно-кишечного тракта) пополнился аналогичными участками для местных и дистантных трансмиттерных молекул (таких, как ацетилхолин, катехоламины и простагландины), а позднее и для группы, состоящей примерно из 20 нейропептидов (как ранее известных, так и недавно обнаруженных), которые регулируют, по-видимому, функцию периферической и центральной нервной системы. Это огромное число «пептидных» гормонов характеризуется высоким зарядом и относительной гидрофильностью, отсутствием значительного связывания с белками плазмы и способностью связываться со специфическими распознающими участками на открытой области рецепторных молекул. встроенных в плазматическую мембрану клеток-мишеней.
Считают, что другая специализированная область внутренней, ассоциированной с мембраной, части рецепторов пептидных гормонов взаимодействует с внутримембранной частью эффекторных молекул или ферментов, таких, как аденилатциклаза, чей каталитический домен доступен с внутренней, цитоплазматической, поверхности клеточной мембраны. Хотя в настоящее время известно, что многие пептидные гормоны после связывания с поверхностными рецепторами все же проникают в клетку, первоначальное взаимодействие с наружной поверхностью плазматической мембраны является необходимым условием стимуляции реакций клеток-мишеней, поскольку внутриклеточное введение пептидных гормонов не вызывает характерных реакций таких клеток. За связыванием гормона с поверхностным рецептором наступает активация одной или более мембранных эффекторных систем, определяющая изменения в механизмах транспорта и распределения ионов, а также активацию цитоплазматических процессов, которые регулируют функцию клетки-мишени. Многие из этих этапов активации включают, по-видимому, фосфорилирование мембранных или цитоплазматических белков, что приводит к изменению ферментативных функций, ответственных за транспорт пли метаболизм молекул, играющих важную роль в клеточной активности. Главным мембранным ферментом, регулируемым пептидными гормонами, является аденилатциклаза, катализирующая образование цАМФ, необходимого для процессов фосфорилирования, возникающих при стимуляции клетки-мишени. К другим мембранным ферментам, на активность которых влияет гормон-рецепторное взаимодействие, относятся ферменты, участвующие в кругообороте инозитола, метилтрансферазы, принимающие участие в метилировании фосфолипидов, а также фосфолипазы, ответственные за деацилирование мембранных фосфолипидов. Последний процесс служит источником образования предшественников (таких, как арахидоновая кислота) простагландинов, тромбоксанов, простациклинов и других активных метаболитов. Наблюдались также гормональные влияния на Na+, К+-зависимую АТФазу, связанную с мембраной протеинкиназу и катехол-О-метилтрансферазу. Таким образом, на уровне плазматической мембраны гормоны индуцируют множество процессов, участвующих в интегрированных реакциях клеток-мишеней на активацию рецепторов гомологичным лигандом.
ХАРАКТЕРИСТИКА РЕЦЕПТОРОВ ПЕПТИДНЫХ ГОРМОНОВ
Исследования по связыванию, проводимые с помощью меченных радиоактивными атомами гормонов, позволили выявить некоторые характерные особенности, свойственные рецепторам многих пептидных гормонов. Универсальной чертой рецепторов является их способность распознавать и связывать соответствующие химические передатчики или гормоны в присутствии избытка молекул других видов. Это свойство легко проявляется в присутствии меченого гормона как избирательная реакция связывания с высоким сродством, которая приводит к образованию специфического гормонрецепторпого комплекса. За последние несколько лет такие взаимодействия наблюдались во многих гормончувствительных тканях. Во многих исследованиях наличие специфических связывающих мест в соответствующих тканях-мишенях принимали за доказательство присутствия гормональных рецепторов. Специфические связывающие места обнаружены также в клетках, которые не принято считать клетками-мишенями, например рецепторы инсулина и СТГ в лимфоцитах, рецепторы пролактина в печени и надпочечниках. Если учитывать, что правильное представление о рецепторах предполагает присутствие не только распознающего, но и запускающего реакцию компонента, то под такое определение не подходят рецепторы, для которых функциональная реакция пока остается не выясненной, а также рецепторы, которые выделены, солюбилизированы или расположены на нереагирующих клеточных компонентах. Таким образом, рецептор характеризуется специфическим связыванием лиганда и способностью передавать регуляторный сигнал, если даже дистальные элементы реакции отсутствуют или неидентифицированы.
Наиболее полное представление о рецепторе пептидного гормона включает двоякие функциональные свойства: поверхностное распознавание и трансляцию гормонрецепторного взаимодействия в специфическую биологическую реакцию. Независимо от того, является ли клеточной реакцией секреция пептидов, стероидогенез, сокращение или транспорт ионов, механизмы, опосредующие гормональный эффект, обычно включают изменение кальциевых потоков и метаболизма циклических нуклеотидов. На мембранных фракциях или интактных клетках многих тканей-мишеней наблюдали зависимость между связыванием гормона и биохимическими реакциями. Корреляция между насыщенностью рецепторов и активностью аденилатциклазы продемонстрирована на препаратах мембран многих гормончувствительных клеток, например клеток надпочечника в случае действия АКТГ, печени в случае действия глюкагона, почек при добавлении вазопрессина, эритроцитов птиц под влиянием катехоламинов, семенных канальцев в присутствии ФСГ, а также семенников и яичников в присутствии ЛГ и ХГЧ. В интактных тканях и изолированных клетках-мишенях связывание гормона также коррелировало с синтезом и высвобождением цАМФ [6]. Корреляцию связывания гормона с последующими клеточными реакциями наблюдали в отношении инсулина и окисления глюкозы в жировых клетках или транспорта аминокислот в тимоцитах, катехоламинов и транспорта натрия в эритроцитах,. ЛГ и продукции андрогенов семенниками, а также ангиотензина II и продукции альдостерона клетками клубочковой зоны надпочечника.
Иногда полагают, что гормональными рецепторами следует называть только те связывающие места ткани, которые можно отождествить с определенной биохимической реакцией. Однако» специфическое связывание меченых лигандов при условии соблюдения адекватных требований к методике его определения все-же является веским указанием на присутствие гормональных рецепторов. К таким требованиям относятся использование меченого гормона с отчетливой биологической активностью (полученного с помощью монойодирования или тритирования), точная оценка неспецифического связывания и исключение связывания с разрушающими или другими ферментативными активностями, присутствующими в тканевых фракциях. Большинство рецепторов пептидных гормонов проявляет высокую специфичность по отношению к биологически активным гормонам или их производным,, высокое сродство связывания, характеризующееся константами; равновесия ассоциации порядка 109—1011 М~1, и насыщаемость при относительно низких концентрациях гормона. Последние свойства соответствуют низкой концентрации гормональных рецепторов в ткани-мишени, которая составляет обычно всего несколько» тысяч мест на клетку. Реакция связывания всегда зависит от температуры, отличается высокой скоростью и в бесклеточных препаратах обычно обратима. В интактных клетках недавно был обнаружен необратимый компонент связывания гормона, и для тромбина и фактора роста эпидермиса (ФРЭ) было показано ковалентное присоединение лиганда к рецептору. Точное определение констант связывания и термодинамических свойств рецепторов часто затрудняется тем, что в опытах по связыванию, проводимых in vitro при физиологических температурах, может иметь место деградация гормона и рецептора. В условиях же, свойственных экспериментам in vivo, также трудно изучать кинетические и связывающие свойства рецепторов гормонов. На скорость ассоциации и диссоциации гормона большое влияние оказывает температура, а кругооборот молекул гормона в местах рецепции при характерных для организма условиях температуры и перфузии изучен недостаточно.
Белковая природа рецепторов полипептидных гормонов на плазматической мембране доказывается их расщеплением под действием различных протеолитических ферментов и пептидаз. На многие рецепторы влияет также фосфолипаза, что указывает на содержание в них важного фосфолипидного компонента или на роль ассоциации с фосфолипидной структурой мембраны в проявлении связывающей активности. Сообщалось, что некоторые рецепторы (для инсулина, ЛГ и ТТГ) содержат углеводные компоненты, иногда влияющие на связывающую активность. Отдельные рецепторы, такие, как рецепторы ЛГ, ФСГ и пролактина, для сохранения своей биологически активной конформации требуют присутствия дисульфидных групп.
Физико-химическая характеристика рецепторов пептидных гормонов затрудняется в результате их относительной нерастворимости, что свойственно многим белкам, содержащимся в мембране. В нескольких тканях из клеток и клеточных частиц удалось выделить рецепторы с помощью ограниченного ферментативного расщепления или инкубации в условиях, способствующих высвобождению поверхностных белков. Однако растворимые гормональные рецепторы для физико-химического анализа получают обычно путем экстрагирования из мембранных фракций и гомогенатов с помощью неионных детергентов, таких, как тритон Х-100 и люброл. Растворение плазматических мембран детергентами обычно приводит к утрате функционального сопряжения между гормонсвязывающими местами и ассоциированными с мембраной активностями, такими, как аденилатциклаза. Однако после удаления детергента наблюдается частичное восстановление гормонстимулируемой активности аденилатциклазы, а иногда после экстрагирования из тканевых фракций неионными детергентами солюбилизированная аденилатциклаза сохраняет чувствительность к гормону. В настоящее время из клеточных мембран экстрагированы специфические места связывания ацетилхолина, ангиотензина II, инсулина, глюкагона, ЛГ — ХГЧ, ФСГ, пролактина и» гормона роста [8].
Переформированные гормонрецепторные комплексы, образуемые путем насыщения тканей-мишеней меченым гормоном, можно легко экстрагировать с помощью обработки неионными детергентами. Такие гормонрецепторные комплексы обычно более стабильны в растворе, чем свободные, или «ненагруженные» рецепторы, и создают некоторые преимущества для физической характеристики. Яичниковые рецепторы ЛГ, предварительно меченные in vivo путем инъекции радиоактивного гонадотропина, обладают теми же самыми физическими свойствами, что и гормонрецепторные комплексы, образуемые путем метки нерастворимых фракций in vitro до солюбилизации. Некоторые свободные рецепторы и гормонрецепторные комплексы анализировали с помощью гельфильтрации и центрифугирования в градиенте плотности, и их молекулярная масса колебалась от 150 000 до 400 000.
Большинство солюбилизированных детергентом рецепторов при физическом анализе обнаруживают свойства молекул удлиненной формы с относительно большими для их констант седиментации (6,5—9,08) гидродинамическими радиусами в 6—7 нм. Эти свойства во многом обусловлены гликопротеиновой природой и выраженной асимметрией рецепторной молекулы, но отчасти могли бы объясняться и связыванием детергента с солюбилизированным белком. Очистку солюбилизированных детергентом гормональных рецепторов производили с помощью соответствующих методик фракционирования, а также аффинной хроматографии на гель-лигандных комплексах. Обычно такая очистка ограничена; главное исключение составляет холинергический рецепторный белок из ткани электрических органов некоторых рыб. С помощью аффинной хроматографии очищали также изолированные рецепторы инсулина, ЛГ — ХГЧ и пролактина. Хотя выход был весьма небольшим, но очищенные рецепторы оказались относительно стабильными и сохраняли высокое сродство и специфичность связывания гормональных лигандов. Этим методом тестикулярные рецепторы ЛГ были очищены примерно в 15000 раз, т. е. до 50% гомогенности белка. Наиболее высоко очищенный препарат рецептора ЛГ мигрирует при SDS-гель-электрофорезе в виде одного-компонента с молекулярной массой около 90 000, что свидетельствует о том, что экстрагированный детергентом рецептор представляет собой димер, состоящий из двух близких субъединиц [6]. Рецепторы пролактина и СТГ из ткани молочной железы и печени также были очищены с помощью аффинной хроматографии, причем было показано, что антитела, полученные к очищенным рецепторам пролактина, ингибируют биологическое действие этого гормона на его ткани-мишени [9]. Для анализа структурных особенностей, определяющих связывание гормона и активацию ассоциированных с мембраной ферментных систем, которые опосредуют его действие, необходима очистка больших количеств рецепторных мест.
Рис. 4—3. «Плавающий рецептор»—двухстепенная физическая модель взаимодействия пептидного гормона с рецептором и активации аденилатциклазы в клеточной мембране.
РЕЦЕПТОРЫ ПЕПТИДНЫХ ГОРМОНОВ И КОМПОНЕНТЫ МЕМБРАНЫ
Хотя термин «рецептор» удобен для описания связывающих компонентов мембраны, с которыми взаимодействует гормон, использование его означает отсутствие сведений о специфических химических структурах, участвующих в реакции связывания. Если взаимодействующий участок вещества или лиганда известен, то точнее было бы при описании использовать его структуру, а не термин «рецептор». Рецепторы можно характеризовать по их специфической «узнающей» и связывающей функциям или, более широко, по тем изменениям, которые приводят к развертыванию специфической биологической реакции. Для объяснения механизмов, с помощью которых связывание с рецептором приводит к модификации мембранных ферментов, предложено несколько гипотез. На смену первоначальной точке зрения, согласно которой гормональные рецепторы структурно объединены с аденилатциклазой и играют роль регуляторной субъединицы фермента, пришли другие, точнее соответствующие данным о жидкой природе клеточных мембран.
Гипотеза мобильного рецептора, предложенная для объяснения механизма модуляции аденилатциклазы в клеточной мембране гормонрецепторным взаимодействием [10], основана на предположении, что рецепторные и ферментные белки представляют собой отдельные и разные молекулы (рис. 4—3). Считают, что связывание гормона с рецептором повышает сродство последнего к другим мембранным компонентам, участвующим в активации аденилатциклазы. Такая двухстепенная модель гормонрецепторного взаимодействия с аденилатциклазой согласуется с возможностью латеральной диффузии молекул рецепторов и фермента в жидком матриксе плазматической мембраны. Она объясняет также отсутствие аддитивности в активации аденилатциклазы многочисленными гормонами в определенных клетках и модуляцию независимых мембранных процессов одним гормоном, если предположить, что его комплекс с рецептором обладает сродством не к одной, а к нескольким регуляторным молекулам. Мобильность гормональных рецепторов в жидком матриксе мембраны могла бы также иметь значение для активации аденилатциклазы в эпителиальных клетках, обладающих морфологической полярностью, например в кишечнике, почках, печени и мочевом пузыре. Наконец, конкурентные антагонисты пептидных гормонов представляются молекулами, сохраняющими сродство связывания с рецепторами, но лишенные способности вызывать изменения конформации и реактивности последних, необходимые для активации аденилатциклазы.
Хотя рецепторные места для гормонов, по-видимому, физически отделены от аденилатциклазы, эти две молекулы обладают очевидной тесной функциональной связью, подтверждающей предположения о рецепторе как о регуляторном участке аденилатциклазного комплекса. В некоторых тканях соответствие между концентрацией гормональных рецепторов и активностью аденилатциклазы свидетельствует о существовании тесно связанного рецепторциклазного комплекса в мембранах клеток-мишеней. Зависимость гормональной активации аденилатциклазы от фосфо-липидов, наблюдаемая в некоторых мембранных и солюбилизированных препаратах, указывает на необходимость сопрягающего компонента липидной природы для ассоциации этих двух активностей. Изучение взаимоотношений между специфическими гормональными рецепторами и активностью аденилатциклазы в разных физиологических условиях и на разных стадиях развития также выявило тесную корреляцию между обоими параметрами. Так, появление рецепторов гонадотропина в семенниках плода тесно связано с приобретением клетками способности реагировать изменением уровня цАМФ на стимуляцию ЛГ и способности синтезировать тестостерон [11]. Более того, десенситизация клеток-мишеней путем воздействия агонистов часто сопровождается одновременной утратой гормончувствительной аденилатциклазы ц гормональных рецепторов. Опыты с десенситизацией обнаружили также уменьшение общей активности имеющейся аденилатциклазы, что указывает на инактивацию значительной части аденилатциклазы при насыщении рецепторов гормонами. Такие временные и количественные корреляции между двумя активностями подчеркивают тесную физическую связь рецепторов пептидных гормонов с аденилатциклазой в клеточной мембране.
Более современные модели пытаются учитывать функциональную сложность аденилатциклазной системы, содержащей не менее трех участков, с которыми реагируют отдельные лиганды, изменяя активность фермента. К ним относятся участок, взаимодействующий с гормоном, каталитический или ферментативный участок, реагирующий с Mg-АТФ, и промежуточный регуляторный участок, взаимодействующий преимущественно с гуаниловыми нуклеотидами. Изучение влияния гуаниловых нуклеотидов на активацию печеночной аденилатциклазы глюкагоном показало, что аденилатциклазный комплекс существует в различных формах, которые могут переходить друг в друга при согласованном действии гормона и гуанилового нуклеотида [12]. После этого аналогичные эффекты ГТФ наблюдали на многих гормончувствительных тканях. Синтетические аналоги ГТФ, устойчивые к ферментативному гидролизу, также стимулируют большинство аденилатциклазных систем, что указывает на роль гуаниловых нуклеотидов в качестве аллостерических активаторов аденилатциклазы. Один из таких аналогов Gpp (NH) p активирует аденилатциклазу, взаимодействуя с тем же самым участком, с которым реагирует и ГТФ. В некоторых тканях связывание меченого Gpp (NH) p с клеточными мембранами коррелирует со степенью активации аденилатциклазы. Сочетанное воздействие гормона и-Gpp (NH) p вызывает длительную активацию аденилатциклазы,. причем в очень многих тканях животных Gpp (NH) p повышает как исходную, так и стимулированную гормоном активность этого фермента. Такие эффекты ГТФ и его аналогов свидетельствуют о том, что регуляция взаимодействия между нуклеотидами и каталитическим участком аденилатциклазы составляет общую» черту действия пептидных гормонов (рис. 4—4).

Рис. 4—4. Трехкомпонентная модель системы гормональный рецептор (Р) — аденилатциклаза. Гормон-рецепторный комплекс модулирует ГТФ-связывающую активность гуанилнуклеотид регуляторной субъединицы (ГНРС), в свою очередь активирующей аденилатциклазу (АЦ). Вызываемая гормоном (Г) активация комплекса ГТФ-ГНРС прекращается после гидролиза ГТФ на регуляторной субъединице или вблизи ее.
Действие гуаниловых нуклеотидов на аденилатциклазу часто сопровождается уменьшением связывающей способности соответствующих мест рецепции гормона. Как ГТФ, так и Gpp (NH) p-уменьшают сродство рецепторов к глюкагону, ангиотензину II и? катехоламинам, повышая константу скорости диссоциации гормон-рецепторного комплекса. Причина зависимости сродства рецепторов от действия гуаниловых нуклеотидов на активность фермента неясна, но влияние на связывание гормона могло бы представлять собой эффект, отдельный от активации аденилатциклазы.
ПРИРОДА ГОРМОНРЕЦЕПТОРНОГО ВЗАИМОДЕЙСТВИЯ
Известно, что связывание пептидных гормонов с их рецепторами на плазматической мембране клеток обусловлено как гидрофобными, так и электростатическими взаимодействиями. О значении гидрофобных эффектов в связывании пептидного гормона с рецептором свидетельствуют температурные влияния на процесс связывания. Для некоторых пептидов, таких, как АКТГ и ангиотензин II, показана и роль электростатических взаимодействий в связывании с рецепторами. В связывании АКТГ рецепторами надпочечников важную роль играет основной участок молекулы гормона; на связывание ангиотензина II с надпочечниковыми рецепторами также сильно влияет основность N-концевого аминокислотного остатка. Процессы активации, обусловленные связыванием гормона, в свою очередь могут зависеть от электростатических эффектов. Так, низкие концентрации полилизина стимулируют аденилатциклазу и стероидогенез в надпочечниках и клетках Лейдига, по-видимому, путем электростатического взаимодействия с анионными группами плазматической мембраны.
Дальнейшему выяснению роли гидрофобных взаимодействий в рецепторном связывании способствовали рентгенодифракпионные исследования трехмерной структуры инсулина и глюкагона [13]. В молекуле инсулина относительно постоянный участок поверхности, определяющий биологическую активность, содержит много гидрофобных аминокислотных остатков. Предполагают, что связывание инсулина с его рецептором—это процесс, аналогичный димеризации, обусловленный аддитивными эффектами гидрофобных взаимодействий и водородных связей. Влияние модификации специфических аминокислотных остатков на биологическую активность и рецепторное связывание коррелирует с изменением конформации молекулы инсулина, и для полного связывания с рецептором необходимо несколько аминокислотных остатков инсулина.
В отличие от инсулина, имеющего относительно ригидную структуру, определяющую нужное для рецепторного связывания трехмерное расположение аминокислот, молекула глюкагона обладает удлиненной и чрезвычайно гибкой структурой. Подобно инсулину молекулы глюкагона легко агрегируют под действием гидрофобных связей, образуя в этом случае трехмерную структуру. При тех низких концентрациях глюкагона, которые присутствуют в крови, этот гормон, вероятно, циркулирует в виде мономера, имеющего случайную конформацию. Предполагают, что биологически активной конформацией является спиральная структура, взаимодействующая с рецептором двумя гидрофобными участками, расположенными на каждом конце спирали, и что для активации аденилатциклазы существенное значение имеет крупная аминоконцевая часть молекулы.
Эти наблюдения свидетельствуют о том, что молекулы как инсулина, так и глюкагона в процессе отложения в гранулах ассоциируются с помощью своих гидрофобных участков; связывание их с рецепторами также определяется преимущественно гидрофобными взаимодействиями. Существование двух гидрофобных участков, впервые обнаруженное в мономере глюкагона, было отмечено и в молекулах секретина и вазоактивного интестинального пептида. Некоторые меньшие по размерам молекулы, такие, как тиротропин-рилизинг гормон, рилизинг-гормон лютеинизирующего гормона, ангиотензин II и брадикинин, также обладают двойной симметрией. Это позволило предположить, что симметричные свойства пептидных последовательностей отражаются в структуре рецепторов и что такие пептиды связываются с двумя сходными или идентичными субъединицами рецептора. Две субъединицы недавно были обнаружены в рецепторах ЛГ, инсулина и ангиотензина II, тогда как рецептор ацетилхолина состоит из нескольких субъединиц. Такая состоящая из субъединиц структура гормональных рецепторов могла бы отражать их общее свойство, связанное с эволюцией симметрии и внутренней гомологии пептидных гормонов, равно как и с возникновением кооперативных взаимодействий при контакте с рецепторами.
Процессы, обусловливающие окончание гормонрецепторного взаимодействия in vivo, выяснены недостаточно. Хотя реакция связывания может, конечно, быть обратимой, но, в соответствии с законом действия масс, механизм, определяющий продолжительность активации рецептора в интактной клетке, по-видимому, отличается от простой диссоциации. Можно было бы предположить разрушение высвобождающегося из комплекса с рецептором гормона, но разрушение большинства гормонов изолированными клетками-мишенями не зависит от взаимодействия с рецепторами. Кроме того, гормон, который специфически связывается тканями-мишенями, после элюции с рецепторов полностью сохраняет свою биологическую активность. Это свойство можно использовать для очистки радиоактивных гормонов с помощью аффинной хроматографии на осажденных рецепторах, чтобы выделить биологически активные молекулы из меченых гормональных препаратов. Как будет показано далее, часть гормон-рецепторных комплексов инактивируется или разрушается в живых клетках в ходе процессов, включающих интернализацию и лизосомный катаболизм.
НАСЫЩЕННОСТЬ РЕЦЕПТОРОВ И АКТИВАЦИЯ РЕАКЦИЙ КЛЕТОК-МИШЕНЕЙ
Большинство исследований, посвященных результатам гормонрецепторных взаимодействий, свидетельствуют о том, что активация аденилатциклазы и реакций клеток-мишеней является функцией насыщенности рецепторов. Во многих тканях, однако, сродство связывания рецепторов оказывается меньшим, чем концентрация гормона требуемая для развития полумаксимальной биологической реакции, а полная биологическая реакция называется насыщением небольшой части имеющихся рецепторов. Даже в тех случаях, когда все большее насыщение рецепторов сопровождается ростом реакций в широких пределах связывания гормона, степень реакции обычно непропорциональна числу занятых рецепторов. Кроме того, известно, что многие гормоны способны стимулировать продукцию гораздо большего количества цАМФ, чем это необходимо для индукции максимальной биологической реакции в клетке-мишени. Такие наблюдения привели к выводу, что многие гормончувствительные ткани характеризуются «запасом» или «избытком» рецепторов, или «рецепторным резервом», что аналогично ситуации, описанной Stephenson при изучении тканей, чувствительных к лекарственным веществам [14]. Несомненно, что такие рецепторные участки клетки не являются лишними; предполагают, что они играют роль резервуара поверхностных рецепторов, обеспечивающего возможность повышения чувствительности клеток-мишеней к активирующему влиянию низких концентраций гормона. Таким образом, высокая плотность поверхностных рецепторов могла бы способствовать быстрой ассоциации и достижению критических или пороговых уровней насыщенности, обусловливающих активацию клетки-мишени.

Рис. 4—5. Связывание гормона, образование цАМФ и продукция стероидов при стимуляции клеток половых желез и надпочечников тропным гормоном.
1 — реакция (например, продукция стероида); 2 — связанный гормон: 3 — цАМФ.
Важно подчеркнуть, что термин «запас» применяется в относительном смысле и что степень избыточности рецепторов может варьировать в зависимости от регистрируемой биологической реакции. Например, в отношении активации аденилатциклазы редко наблюдается «запас» рецепторов, поскольку существует четкая корреляция между связыванием и активностью аденилатциклазы, хотя иногда может встречаться и нелинейная зависимость между насыщенностью рецепторов и реакцией фермента. Подобно этому, связывание гормона с интактными клетками-мишенями обычно сопровождается прогрессирующим увеличением продукции цАМФ, и большинство тканей не содержит избытка рецепторов, который не был бы сопряжен с аденилатциклазой. Однако при регистрации более «дистальных» реакций, таких, как мышечное сокращение, стероидогенез, окисление глюкозы, липолиз и транспорт ионов, часто обнаруживается, что максимальная биологическая реакция воспроизводится при насыщении только небольшой фракции популяции рецепторов (рис. 4—5). Совершенно очевидно, что относительно большой пул рецепторов в мембране клетки-мишени должен облегчать активацию малого их числа (необходимого для достижения порога индукции клеточной реакции).
Избыток рецепторов легче всего установить путем непосредственного изучения связывания меченых гормонов с интактными плетками- и тканями-мишенями. Это особенно заметно в интерстициальных клетках семенников, где достаточно насытить менее 1% общей популяции рецепторов, чтобы вызвать полную активацию стероидогенеза и продукции тестостерона [15]. Однако в тех же самых клетках дальнейшее связывание меченого гонадотропина сопровождается прогрессированием роста продукции и высвобождения цАМФ. Это свидетельствует о том, что большинство или даже все связывающие места, выявляемые при взаимодействии с радиоактивным гормоном, являются функционально активными рецепторами, способными стимулировать активность аденилатциклазы и образованием цАМФ.
В некоторых тканях связывание гормона и последующая биологическая реакция тесно сопряжены во всем диапазоне насыщенности рецепторов. Так, насыщенность рецепторов ангиотензина II в клубочковой зоне коры надпочечников коррелирует с увеличением стероидогенеза и продукции альдостерона во всем диапазоне связывания гормона. Пусть даже зависимость между связыванием ангиотензина II и продукцией альдостерона и нелинейна, но такая корреляция указывает на отсутствие «запаса» рецепторов в отношении стероидогенеза в клетках этого типа [16]. Подобно этому, на изолированных клетках вилочковой железы наблюдали тесную корреляцию между связыванием инсулина и стимуляцией транспорта аминокислот. Возможно, существуют широкие колебания зависимости между насыщенностью рецепторов и специфической реакцией клеток в разных тканях-мишенях от одной крайности в случае интерстициальных клеток семенников, полная активация которых происходит при минимальной насыщенности рецепторов, до другой — почти непрерывной зависимости между насыщенностью и реакциями, что встречается в клетках клубочковой зоны коры надпочечников и вилочковой железы. В клетках одного типа, например жировых клетках, повышение степени насыщения рецепторов при воздействии инсулина вызывает последовательный ряд реакций. Угнетение липолиза в этом случае происходит при очень низкой насыщенности рецепторов, стимуляция обмена глюкозы оказывается максимальной при насыщении всего 2—3% рецепторов, а стимуляция транспорта аминокислот и синтеза белка наблюдается при высокой степени насыщенности рецепторов [17].
Как правило, в тех случаях, когда связывание гормона и биологические реакции тесно коррелируют между собой, именно рецепторы лимитируют активацию клеток-мишеней. Если же имеется «запас» рецепторов, лимитирующими являются более «дистальные» элементы; лимитирующий этап при этом в случае реакций, опосредуемых цАМФ, локализуется, по-видимому, на уровне активации протеинкиназ.
РЕГУЛЯЦИЯ РЕЦЕПТОРОВ ПЕПТИДНЫХ ГОРМОНОВ
Способность клеток-мишеней реагировать на изменение окружающей концентрации лигандов изменением количества и/или сродства поверхностных рецепторов установлена в отношении очень многих гормонзависимых тканей [18]. Саморегуляция мембранных рецепторов, впервые показанная в отношении поверхностных антигенов, обнаружена в клетках, испытывающих воздействие многих лигандов, в том числе нейротрансмиттеров, пептидов, белковых и гликопротеиновых гормонов, а также поверхностно-модулирующих факторов, например лектинов и иммуноглобулинов. Во многих клетках-мишенях наблюдали феномен десенситизации клеточных реакций под влиянием лигандов-агонистов, причем в некоторых случаях это коррелировало с потерей рецепторных участков, или «снижающей регуляцией». Механизм регуляции рецепторов гомологичными лигандами связан, вероятно, с мобильным поведением рецепторов пептидных гормонов в плазматической мембране. Мобильность гормональных рецепторов становится очевидной при их взаимодействии с эффекторными белками мембраны, такими, как аденилатциклаза, а также при вызываемом лигандами образовании «пятен» или «нашлепок» рецепторов. Изучение судьбы рецепторов в процессе регуляции со стороны лигандов обнаружило способность пептидных гормонов проникать в свои клетки-мишени, что противоречило прежнему представлению о незначительной роли интернализации в действии белковых гормонов. В настоящее время установлено, что эффекты гормональной стимуляции клеток-мишеней включают сложные цепи процессов, которые не только обусловливают характерную клеточную реакцию, но и регулируют отдельные компоненты самого механизма активации, а также изменяют реакцию на последующую стимуляцию гормонами.
ОБЩИЕ АСПЕКТЫ РЕГУЛЯЦИИ РЕЦЕПТОРОВ
Многие рецепторы пептидных гормонов регулируются гомологичным гормоном, а иногда и другими гормонами. Повышение концентрации гормона обычно приводит к уменьшению числа соответствующих рецепторов, что впервые было показано в отношении инсулиновых рецепторов печени и культивируемых лимфоцитов [19]. Такая «снижающая регуляция» инсулиновых рецепторов встречается при ожирении у человека и при генетическом или индуцированном ожирении у грызунов и отражает, по-видимому, влияние избытка инсулина в крови на число своих рецепторов. По всей вероятности, эта потеря рецепторов является общим результатом повышения уровня инсулина в крови, сопровождающего инсулинрезистентные состояния. Обратный эффект, т. е. увеличение числа инсулиновых рецепторов в условиях сниженной секреции инсулина, наблюдали в печени хомяков и крыс с диабетом. Другими примерами «снижающей регуляции» рецепторов гомологичными гормонами служат взаимодействие СТГ, тиротропин-рилизинг гормона (ТРГ), катехоламинов, гонадотропинов и глюкагона со своими рецепторами. Рецепторы некоторых пептидных гормонов, таких, как пролактин и ангиотензин II, могут и увеличиваться в числе после воздействия повышенных концентраций гормона, но в таких случаях правилом является все же потеря рецепторов клеточной поверхностью. Некоторые рецепторы, особенно инсулиновые, при воздействии повышенных концентраций лиганда проявляют отрицательную кооперативность. Если это встречается и в физиологических условиях, то данный феномен мог бы служить еще одной формой регуляции рецепторов, при которой частичная насыщенность их приводит к снижению сродства остальных связывающих мест с острым уменьшением чувствительности клеток-мишеней при увеличении концентрации инсулина.
Важным фактором регуляции рецепторов является неполная обратимость реакции связывания, т. е. неполная диссоциация комплекса, образующегося в начальной фазе взаимодействия гормона с рецептором. При анализе гормонрецепторного взаимодействия традиционно применяют методы, основанные на допущении обратимости образования комплекса, но данные кинетических исследований часто свидетельствуют о том, что гормонрецепторный комплекс, быстро диссоциируя вначале, затем распадается гораздо медленнее и неполностью. Это указывает на появление таких конформационных изменений рецептора после начального взаимодействия с гормоном, которые обусловливают более прочное связывание лиганда, что можно представить следующим уравнением: Г+ Р « ÕР® ÕР.
Одна из форм связывания с более высоким сродством обусловливается взаимодействием занятых рецепторов с компонентами аденилатциклазной системы, причем гуаниловые нуклеотиды могут обеспечивать обратимость этого связывания. Такое состояние повышенного сродства наблюдали после связывания лиганда с рецепторами катехоламинов, глюкагона, простагландина Е, дофамина и мускариновых соединений [20]. Другая форма прочного связывания, которое становится все менее обратимым, характерна для рецепторов инсулина, ФРЭ, пролактина и ЛГ и отражает, по-видимому, предварительный этап по отношению к процессу интернализации гормонрецепторного комплекса. В любом случае длительная занятость недиссоциирующим лигандом всегда является потенциальной причиной функциональной потери рецепторов и должна учитываться при исследовании их регуляции. Помимо уменьшения числа связывающих мест, длительная занятость рецептора лигандом повышает вероятность разрушения или каких-либо иных процессов изменения и разрушения гормонрецепторных комплексов. К таким процессам могло бы относиться проникновение этих комплексов в толщу клеточной мембраны или «сбрасывание» их с клеточной поверхности, но современные данные свидетельствуют в пользу эндоцитоза и последующего лизосомного разрушения интернализованных гормонрецепторных комплексов.
Процессы роста клеток, движения и распознавания координируются супрамолекулярным комплексом поверхностных рецепторов и субмембранных фибриллярных структур, с помощью которых изменения (поверхностная модуляция) конформации, подвижности и распределения рецепторов приводят к изменениям сопряженных цитоплазматических компонентов. Эти структурные взаимодействия, по всей вероятности, определяют образование конгломератов (кластеризация, возникновение «пятен» и «нашлепок») рецепторов под действием перекрестно-связываемых агентов, таких, как двухвалентные антитела и мультивалентные лектины. Моновалентные лиганды, такие, как гормоны, также могут вызывать перераспределение рецепторов на клеточной мембране с кластеризацией мест связывания, образующих конгломераты на поверхности клеток. Такая кластеризация является, вероятно, важным фактором последующей интернализации гормонрепепторных комплексов, но может быть и существенным моментом острой фазы гормонального эффекта (рис. 4—6). Так, двухвалентные антитела к рецепторам инсулина в изолированных адипоцитах могут как связываться с рецептором, так и оказывать инсулиноподобное действие, тогда как моновалентные фрагменты антител Fab связываются с рецептором, но не вызывают биологической реакции. Добавление анти-F (аb`)2-антисыворотки перекрестно связывает рецептор Fab и восстанавливает инсулиноподобное действие антитела [21]. Эти эффекты указывают на то, что перекрестное связывание или микроагрегация рецепторов представляет собой важный этап инсулиноподобных влияний антирецепторных антител и, вероятно, также действия самого инсулина. Такое представление согласуется с данными о мобильности инсулиновых рецепторов и их способности образовывать кластеры на клеточной мембране, а также об инсулиноподобных эффектах некоторых лектинов.

Рис. 4—6. Распределение гормонрецепторных комплексов в мембране клетки-мишени при действии пептидного гормона.
ВЛИЯНИЕ РЕГУЛЯЦИИ РЕЦЕПТОРОВ НА КЛЕТОЧНЫЕ РЕАКЦИИ
Из представлений о регуляции рецепторов следует, что изменение их концентрации должно влиять на реактивность клеток-мишеней. В отсутствие других изменений следовало бы ожидать, что уменьшение количества мембранных рецепторов приведет к снижению чувствительности клеток-мишеней в тканях, в которых есть большой «запас» рецепторов, и к снижению величины реакции в клетках-мишенях, в которых именно концентрация рецепторов становится лимитирующим фактором в отношении способности гормона вызывать реакцию (рис. 4—7). Общая функция регуляции рецепторов как механизма снижения чувствительности клеток-мишеней при повышении концентрации гормонов могла бы придавать организму определенные биологические преимущества. Наглядным примером является гомеостаз глюкозы, когда уменьшение числа инсулиновых рецепторов и снижение чувствительности периферических тканей к инсулину должно было бы «притуплять» влияние гиперинсулинемии на концентрацию глюкозы в крови. Регуляция рецепторов могла бы также сводить к минимуму или смягчать сердечно-сосудистые реакции на избыточные количества ангиотензина II и катехоламинов. Именно это могло бы определять выраженную резистентность к ангиотензину II, которая встречается при многих клинических состояниях, сопровождающихся повышенной секрецией ренина. Однако в отношении других стимуляторов, таких, как СТГ и гонадотропины, оказывающие на свои клетки-мишени более долговременные биологические влияния, задачи регуляции рецепторов не столь очевидны.

Рис. 4—7. Влияние потери рецепторов на биологические реакции (например, стероидогенез) в клетках-мишенях, обладающих и не обладающих «запасом» рецепторов.
Роль регуляции рецепторов в клеточной реакции на гормоны исследовали на различных тканях, особенно тех, в которых действие гормонов опосредуется системой аденилатциклаза — протеинкиназа. При изучении воздействия гормонов на такие ткани важно различать острую десенситизацию (обычно аденилатциклазы) без потери рецепторов и истинную потерю рецепторов, которая представляет собой отдаленное и медленнее обратимое следствие гормонрецепторного взаимодействия.
Анализ уровня, на котором регуляция поверхностных рецепторов сказывается на метаболических реакциях, зависит от возможности измерения сдвигов по ходу активируемого гормоном процесса, «запускаемого» связыванием рецепторов. Для некоторых пептидных гормонов, таких, как инсулин, СТГ и пролактин,. ближайший механизм действия на клетки-мишени все еще не известен. Так, хотя инсулин модулирует активность нескольких мембранных ферментов, включая аденилатциклазу, фосфодиэстеразу и АТФазу, значение этих эффектов для действия гормона на мембранные транспортные системы и анаболические процессы остается не ясным. В том случае, если ранние этапы действия гормонов не идентифицированы, влияние регуляции рецепторов на клеточные реакции можно изучать путем регистрации сдвигов в транспортных системах и процессах биосинтеза. Такой подход применяли при анализе эффектов регуляции инсулиновых рецепторов в адипоцитах и гепатоцитах в отношении транспорта глюкозы и аминокислот, а также синтеза липидов.
Последствия регуляции рецепторов в отношении функции клеток-мишеней широко изучали применительно к стероидогенным клеткам надпочечников и половых желез, реагирующим на тропные гормоны секрецией специфических стероидов, опосредуемой зависимым от аденилатциклазы механизмом. На таких клетках можно анализировать несколько уровней реакции, начиная с взаимодействия с рецепторами, продукции цАМФ и активации киназы и кончая стимуляцией продукции прегненолона и последующих этапов биосинтеза, приводящих к секреции стероидов. Если клетки получены после воздействия десенситизирующих доз тропного гормона, то in vitro регистрируются выраженные изменения содержания рецепторов и метаболических реакций на стимуляцию гормонами. Такие десенситизированные клетки демонстрируют ряд последствий регуляции рецепторов, осуществляемой действием гормона в интактных тканях-мишенях, в том числе снижение образования цАМФ и повреждение процесса биосинтеза стероидов [22].
СУДЬБА ГОРМОНРЕЦЕПТОРНОГО КОМПЛЕКСА
Большинство исследований, посвященных механизму действия пептидных гормонов, сосредоточено на острых реакциях, развивающихся вслед за связыванием гормона с его рецептором на клеточной поверхности. Меньше известно о механизмах столь же важных отдаленных влияний на рост и дифференцировку клеток или о способах прекращения действия гормональных стимулов. Эти процессы могут иметь отношение к судьбе гормонрецепторного комплекса. Как уже отмечалось, есть указания на то, что первоначальное обратимое взаимодействие сменяется состоянием более высокого сродства, обусловливающим сохранение недиссоциирующего комплекса в течение длительного периода времени. Эти данные наряду с накапливающимися сведениями о присутствии гормонов и мест их связывания внутри клеток-мишеней позволяют думать о том, что частым следствием гормонрецепторного взаимодействия является интернализация. Интерес к этому процессу стимулировали данные о поглощении и кругообороте холинергических рецепторов и комплексов липопротеинов низкой плотности (ЛПНП) со своими рецепторами [23]. В силу этого все большее значение стали придавать интернализации и в судьбе гормонрецепторных комплексов в тканях-мишенях. Механизм процесса интернализации по отношению к пептидным гормонам имеет, вероятно, много общих черт с процессами модуляции поверхности лимфоцитов и образования системы «окаймленных ямок», обусловливающей поглощение макромолекул, таких, как ЛПНП (рис. 4—8). Основа увеличения числа рецепторов в клетках-мишенях, вызываемого такими пептидами, как ангиотензин II и пролактин, требует дальнейшего изучения, но, по всей вероятности, этот процесс вначале связан с изменением конформации мембраны, а позднее с увеличением синтеза рецепторов. Для некоторых гормонов, таких, как ангиотензин II, действующий на клубочковую зону коры надпочечников, позднее увеличение числа рецепторов могло бы являться частью общей клеточной реакции на действие тропного гормона.

Рис. 4—8. Способ поглощения липопротеинов низкой плотности (ЛПНП) культивируемыми фибробластами. Считают, что рецепторы ЛПНП, синтезируемые на полирибосомах, в случайном порядке проникают в клеточную мембрану и непрерывно подвергаются кластеризации в «окаймленных ямках», сменяемой интернализацией в составе эндоцитозных пузырьков. После отложения ЛПНП в лизосомах рецепторы, по-видимому, используются в новом цикле, возвращаясь на клеточную поверхность, где они вновь подвергаются кластеризации в «окаймленных ямках». Поступающий холестерин подавляет образование микросомального фермента (ОМГ-СоА-редуктазы), который лимитирует скорость биосинтеза холестерина, стимулирует фермент, ответственный за синтез эфиров холестерина и угнетает синтез рецепторов ЛПНП (Brown, Goldstein [23] в модификации). ГЭР — гладкий эндоплазматический ретикулум.
Результаты ряда исследований указывают на роль цитоплазматических сократительных элементов в мобильности и регуляции рецепторов. В лимфоидных клетках лигандрецепторное взаимодействие сменяется образованием рецепторных «пятен», их агрегацией в несколько более крупные «пятна» или одну «нашлепку» и, наконец, интернализацией или «сбрасыванием» перекрестно-связанных рецепторов. Хотя образование «пятен» и «нашлепок» рецепторов часто происходит в клетках, подвергающихся действию мультивалентных лигандов, таких, как иммуноглобулины и пектины, при взаимодействии рецепторов с моновалентными лигандами, такими, как гормоны и трансмиттеры, переход «пятен» в «нашлепку» может и не наблюдаться. Тем не менее процессы, ведущие к агрегации и интернализации мультивалентных лигандов, все же могут иметь отношение к кругообороту и судьбе рецепторов пептидных гормонов, особенно в ходе регуляции рецепторов при повышении концентрации гормональных лигандов. По данным современных исследований, описанным далее, перераспределение рецепторов гормонов и других одновалентных лигандов предшествует интернализации рецепторных агрегатов с последующим разрушением комплексов.
Зависимость интернализации гормона от вызываемой лигандом потери рецепторов отчетливо показана на примере действия фактора роста эпидермиса (ФРЭ) на фибробласты человека [24]. Связавшийся с клетками митоген быстро распадается в ходе процесса, соответствующего интернализации и лизосомному разрушению, причем одновременно из клетки исчезают поверхностные рецепторы ФРЭ. Потеря рецепторов ФРЭ после связывания пептида продемонстрирована также с помощью аффинной метки, показавшей, что быстрый протеолитический распад гормонрецепторных комплексов сопровождается уменьшением числа рецепторных участков на клеточной мембране. Как изменение числа рецепторов, так и синтез ДНК достигали половины максимума своей реакции при насыщении митогеном 10% рецепторов. Путем увеличения изображения удалось непосредственно наблюдать интернализацию флюоресцирующих аналогов ФРЭ, инсулина и гонадотропин-рилизинг гормона (ГнРГ); при этом выяснилось, что гормонрецепторные комплексы вначале распределяются по клеточной мембране равномерно, а затем быстро агрегируют в «пятна», которые проникают внутрь клетки в форме эндоцитозных пузырьков, присутствующих в цитоплазме [25].
Дальнейшие доказательства интернализации гормона были получены при изучении поглощения и метаболизма гонадотропинов в клетках семенников и яичников. Присутствие гонадотропинсвязывающих мест в цитоплазме яичниковых клеток было показано с помощью методов иммуноцитохимии и авторадиографии. После воздействия ХГЧ in vivo гормон обнаруживался в цитоплазме, на мембране и в перинуклеарном пространстве. Более прямые доказательства были получены в экспериментах на желтом теле овцы, где значительные количества меченного 125I ХГЧ поглощались клеткой в форме эндоцитозных пузырьков и включались в плотные тельца (предположительно лизосомы). Лизосомная деградация гонадотропинов встречалась также в опухолевых клетках Лейдига, в которых на связывание и метаболизм меченного 125I ХГЧ не влияли агенты, изменяющие состояние микронитей и микротрубочек [26]. Потеря рецепторов гонадотропина, вызываемая ХГЧ в яичниках, сопровождалась прогрессирующей интернализацией связанного с рецепторами 125I-ХГЧ, причем после солюбилизации я центрифугирования в градиенте плотности часть транслоцированной радиоактивности удалось идентифицировать в качестве гор-монрецепторного комплекса. Полученные данные свидетельствуют о том, что ингернализация является частым следствием гормон-рецепторного взаимодействия и, по всей вероятности, именно ею определяется снижающая регуляция поверхностных рецепторов после воздействия повышенных концентраций гомологичного гормона [18].
МЕДИАТОРЫ ДЕЙСТВИЯ ГОРМОНОВ
ОБЩИЙ ОЧЕРК: ГИПОТЕЗА «ВТОРОГО МЕДИАТОРА»
Перенос наружных (т. е. внеклеточных) гормональных «сигналов» во внутреннюю среду клетки после лигандрецепторного взаимодействия осуществляется «вторыми медиаторами», которые образуются на мембранном уровне. Первоначальная формулировка этой концепции, принадлежащая Sutherland, показана на рис. 4—2, где представлен общий механизм, с помощью которого пептидные гормоны, действующие на клеточную поверхность, стимулируют образование «вторых медиаторов», таких, как цАМФ. Вначале эта общая схема действия пептидных гормонов на мембранные рецепторы и аденилатциклазу была предложена на основании исследований, проведенных с катехоламинами, вазопрессином, глюкагоном и АКТГ, но затем было показано, что многие пептидные гормоны вызывают активацию аденилатциклазы и повышение внутриклеточного уровня цАМФ. Однако для некоторых пептидных гормонов, таких, как ангиотензин, инсулин и СТГ, механизм активации клеток-мишеней остается невыясненным (табл. 4—1). Даже в тех тканях, в которых «вторым медиатором» действия пептидных гормонов принято считать цАМФ, неполностью ясен способ, которым одна эффекторная система транслируется в целый спектр реакций отдельных клеток-мишеней. Этот вопрос осложняется двойственной природой многих пептидных и белковых гормонов, которые, с одной стороны, являются трофическими факторами с их поздними влияниями на рост и дифференцировку клеток, а с другой, выступают в роли быстрых регуляторов таких клеточных реакций, как стероидогенез и секреция гормонов. Схема этих медленных и быстрых эффектов гормонов, оказывающих как поздние ростовые, так и кратковременные метаболические влияния [27], приведена на рис. 4—9. Связь между двумя указанными аспектами действия пептидных гормонов выяснена недостаточно полно, и большинство наших знаний о клеточных реакциях на гормонрецепторное взаимодействие основано на результатах исследования острых эффектов пептидных гормонов на их клетки-мишени.
Внутриклеточные сигнальные молекулы, генерируемые гормон-рецепторным взаимодействием, действуют затем на мембранные и цитоплазматические белки, изменяя скоростьограничивающие этапы эффекторных систем, контролирующих реакции клетки-мишени. Лучше всего охарактеризованными медиаторами являются цАМФ и кальций, выступающие в роли внутриклеточных трансмиттеров и приводящие метаболизм клетки-мишени в соответствии с потребностями в реакции на внешнюю стимуляцию такими факторами, как гормоны и другие лиганды. Если кальциевый стимул обеспечивается повышением концентрации кальция в цитозоле за счет поглощения кальция из внеклеточной жидкости или перераспределения внутриклеточного кальция, то циклические нуклеотиды образуются из АТФ и ГТФ за счет активации циклазных ферментов, расположенных в плазматической мембране и цитозоле соответственно. Таким образом, образование цАМФ непосредственно связано с насыщением рецепторов клеточной поверхности и активацией аденилатциклазы, локализующейся на внутренней поверхности липидного бислоя плазматической мембраны. В отличие от этого, гуанилатциклаза расположена преимущественно в цитозоле и не активируется непосредственно гормональными «стимулами». Кальций оказывает важное действие как на гуанилатциклазную активность, так и на разрушение гЦМФ фосфодиэстеразой, и внутриклеточная концентрация кальция служит, вероятно, основным регулятором уровня цАМФ и цГМФ в клетке [28].
Таблица 4—1. Пептидные гормоны и аденилатциклаза
1. Гормоны, действующие через цАМФ как «второй медиатор» а. Адренокортикотропный гормон (АКТГ, кортикотропин) б. Лютеинизирующий гормон (ЛГ, лютеотропин) в. Хорионический гонадотропин человека (ХГЧ) г. Фолликулостимулирующий гормон (ФСГ, фоллитропин) д. Гонадотропин сыворотки жеребой кобылы (ГСЖК) е. Тиротропный гормон (ТТГ, тиротропин) ж. Липотропин (ЛПГ) з. Меланоцитстимулирующий гормон (МСГ, меланотропин) и. Антидиуретический гормон (АДГ, вазопрессин) к. Тиротропин-рилизинг гормон (ТРГ) л. Паратиреоидный гормон (ПТГ) м. Кальцитонин (КТ) н. Глюкагон о. Катехоламины (b-адренергические эффекты) п. Простагландины (ПГЕ1)
2. Гормоны, действующие, вероятно, не через цАМФ а. Ангиотензин II б. Гонадотропин-рилизинг гормон (ГнРГ, рилизинг-гормон лютеинизирующего гормона, РГ-ЛГ)
3. Гормоны, действующие не через цАМФ а. Инсулин б. Инсулиноподобные факторы роста в. Соматомедин г. Фактор роста эпидермиса (ФРЭ) д. Фактор роста фибробластов (ФРФ) е. Активность, стимулирующая размножение (АСР) ж. Фактор роста нервов (ФРН) з. Гормон роста (СТГ) и. Пролактин к. Плацентарный лактоген л. Окситоцин м. Соматостатин н. Катехоламины (a-адренергические эффекты) о. Простагландины (ПГF2a) [1]

Рис. 4—9. Общая схема интеграции ранних и поздних реакций на действие гормонов, вызывающих как острые метаболические сдвиги, так и долговременные изменения роста и развития (Tata [27] в модификации).
Роль кальция в сопряжении стимула и реакции при активации сократительных и секреторных процессов была установлена достаточно надежно. Впоследствии, однако, выяснение широко распространенных эффектов цАМФ в качестве «второго медиатора» обусловило тенденцию к умалению роли кальция как внутриклеточно го регулятора. Позднее было показано значение взаимодействий между циклическими нуклеотидами и кальцием [29], и вновь стали подчеркивать примат этого иона в качестве медиатора активации многих процессов в клетках-мишенях [30].
ЦИКЛИЧЕСКИЙ АМФ
Поскольку гормональная стимуляция клеток-мишеней, как правило, имеет прерывистый и преходящий характер, внутриклеточные «вторые медиаторы» должны подвергаться быстрому кругообороту (путем разрушения или поступления в новый цикл) с тем, чтобы повторные и меняющиеся внешние стимулы могли бы превращаться в строго соответствующие количественные реакции клетки. Динамическое равновесие между образованием и элиминацией циклических нуклеотидов контролирует их внутриклеточный уровень в исходном и активированном гормоном состоянии клетки и создает возможность развития быстрых реакций на изменение уровня внеклеточных регуляторов. Эта регуляция опосредуется в основном активацией аденилатциклазы в клеточной мембране, что приводит к увеличению внутриклеточной концентрации цАМФ. Скорость разрушения цАМФ фосфодиэстеразой также является объектом гормональной регуляции и может влиять на внутриклеточную концентрацию нуклеотида (см. рис. 4—2). Все известные на сегодня эффекты цАМФ в эукариотических клетках реализуются через превращение неактивной фосфокиназы (протеинкиназы) в активную форму, которая катализирует фосфорилирование специфических белковых субстратов в клетке-мишени. Таким образом, понимание механизма действия пептидных гормонов требует выяснения путей гормональной регуляции активности аденилатциклазы и фосфодиэстеразы, а также путей активации и функций цАМФ-зависимой протеинкиназы.
Аденилатциклаза и ее регуляция
Открытие цАМФ и аденилатциклазы группой Sutherland было связано с изучением регуляции печеночного гликогенолиза адреналином и глюкагоном [4]. Эти исследователи показали, что такие гипергликемизирующие агенты вызывают активацию гликогенфосфорилазы и последующее расщепление гликогена до глюкозофосфатов. Затем было показано, что активация гликогенфосфорилазы зависит от промежуточного этапа (позднее идентифицированного как фосфорилирование под действием протеинкиназы), который стимулируется термостабильным фактором, образующимся при взаимодействии гормона с нерастворимой фракцией печеночной клетки. Было установлено, что последняя реакция требует АТФ, который в присутствии гормона и иона магния превращается в цАМФ и неорганический фосфат. Далее было показано, что фермент, ответственный за эту реакцию, располагается на внутренней поверхности плазматической мембраны и активируется разными пептидными гормонами (рис. 4—10). Названный первоначально Sutherland аденилциклазой фермент плазматической мембраны впоследствии стали называть аденилатциклазой или аденилилциклазой. Эти термины точнее описывают его специфическое циклизирующее действие на АТФ. Фермент, ответственный за образование цАМФ, следует называть наиболее широко употребительным термином «аденилатциклаза».
Вслед за идентификацией аденилатциклазы в качестве фермента, связанного с мембраной, и определением его регуляции со стороны катехоламинов и пептидных гормонов появилось огромное число сообщений об участии (или неучастии) цАМФ в гормон-зависимых процессах. Вскоре выяснилось, что способностью активировать аденилатциклазу обладают только пептиды и трансмиттеры, которые связываются с поверхностью клетки, тогда как другие гормоны, (тироксин и стероиды) не оказывают закономерного действия на систему аденилатциклаза — цАМФ. Sutherland рассматривал циклазу как фермент, обладающий рецепторной субъединицей (местом распознавания пептидных гормонов) и каталитической субъединицей (превращающей АТФ в цАМФ). Позднее предполагалось, что эти субъединицы существуют в виде отдельных структур, плавающих в липидном бислое клеточной мембраны и объединяющихся в активную форму при взаимодействии гормона с рецепторным местом [10]. Это представление легло в основу двухэтапной теории активации фермента, согласно которой гормонрецепторный комплекс диффундирует по клеточной мембране и взаимодействует с каталитической единицей (активируя ее), расположенной на цитоплазматической поверхности мембраны (см. рис. 4—3).

Рис. 4—10. Активация ранних и поздних реакций в эндокринной клетке-мишени гормонами, стимулирующими аденилатциклазный-протеинкиназный путь. НСБ — нуклеотидсвязывающий белок; Р — рецептор.
Эта относительно простая модель аденилатциклазы впоследствии усложнилась, благодаря выяснению роли промежуточного процесса (трансдукции) между гормонрецепторным взаимодействием и изменением конформации каталитической субъединицы, приводящим к активации фермента. Существование и свойства этого промежуточного (сопрягающего) этапа были продемонстрированы группой Rodbell в процессе изучения глюкагончувствительной аденилатциклазы, присутствующей в плазматических мембранах клеток крысиной печени [31]. На этой системе было показано, что гуаниловые нуклеотиды (особенно ГТФ) усиливают активирующее действие гормона на аденилатциклазу, а также способствуют диссоциации комплекса глюкагона с его рецептором. Исследования Rodbell свидетельствовали о том, что глюкагон облегчает активацию аденилатциклазы гуаниловыми нуклеотидами, а не оказывает прямого стимулирующего влияния на фермент. Регуляторный участок аденилатциклазы, взаимодействующий с гуаниловым нуклеотидом, идентифицирован в различных эукариотических тканях, и предполагается, что он играет фундаментальную роль в действии пептидных гормонов, катехоламинов и простагландинов.
Последующие эксперименты подтвердили общую зависимость активирующего аденилатциклазу действия пептидных гормонов от гуаниловых нуклеотидов, причем было подчеркнуто значение связывания ГТФ с регуляторным участком как обязательного этапа гормонального действия [12].
Современная точка зрения на механизм гормональной активации аденилатциклазы в качестве первичного этапа действия пептидного гормона предполагает зависимое от лиганда присоединение ГТФ к регуляторному участку (см. рис. 4—4). Связывание ГТФ с этим промежуточным регуляторным белком превращает неактивную каталитическую единицу в ее активную циклизирующую форму; процесс активации прекращается при гидролизе связанного ГТФ с образованием ГДФ, и фермент восстанавливает свое исходное состояние. В пользу существования такого механизма свидетельствуют данные о том, что стимулируемая гормоном активность ГТФазы связана с гуапилнуклеотид-регуляторным участком, а также о способности негидролизуемых аналогов ГТФ (Gpp (NH) p и ГТФgS) вызывать выраженную и длительную активацию аденилатциклазы. Последний эффект обусловливается резистентностью синтетических аналогов к гидролитическому действию ГТФазы, что является причиной персистирующей занятости регуляторного участка активным нуклеотидом вместо обычно транзиторного эффекта связывания ГТФ [32]. Этот механизм лежит и в основе выраженного действия холерного токсина на активность аденилатциклазы с «фиксированием» фермента в постоянно активном состоянии. Указанный феномен зависит от присутствия ГТФ и обусловливается ингибированием токсинов гормонзависимой ГТФазной активности [33]. Этот эффект холерного токсина реализуется через стимуляцию переноса АДФ-рибозы (от НАД) на ассоциированный с аденилатциклазой ГТФ-связывающий белок [34], что приводит к угнетению активности ГТФазы.
Все эти данные позволяют считать, что активность аденилатциклазы «включается» возникающим под действием гормона связыванием ГТФ в присутствии АТФ как субстрата и «выключается» путем гидролиза ГТФ в регуляторном участке [33] (рис. 4— 11). «Выключение» реакции блокируется нефизиологическими агентами, такими, как Gpp (NH) p и холерный токсин, а также может служить способом регуляции активности аденилатциклазы другими внутриклеточными сигналами.
Дальнейшие указания на значение регуляторного участка были получены при попытках реконструкции гормончувствительной активности аденилатциклазы путем слияния клеток или добавления растворимых клеточных экстрактов к комплементарным мембранам. В опытах по слиянию клеток гетерокарионы, образуемые из характерных для эритролейкемии клеток крови (лишенных b-рецепторов) и эритроцитов индюшки (с инактивированной аденилатциклазой), обнаруживали катехоламинчувствительную циклазную активность, отсутствовавшую в донорских клетках [35]. Подобно этому, рецепторы ЛГ, содержащиеся в богатых липидами экстрактах яичников, были перенесены в клетки сетчатой зоны коры надпочечников, в которой они опосредовали действие гонадотропинов на продукцию цАМФ и кортикостероидов [6]. В экспериментах по реконструкции солюбилизированная детергентом аденилатциклаза включалась в состав содержащих рецепторы мембран мутантных клеток, дефицитных по аденилатциклазе, с восстановлением стимулируемой катехоламинами активности фермента [36]. Подобно упомянутым результатам исследований со слиянием клеток эти данные подчеркивают пространственную независимость гормональных рецепторов и аденилатциклазы и свидетельствуют о способности рецепторов к движению в латеральном направлении и взаимодействию с нуклеотидрегуляторной единицей аденилатциклазы в клеточной мембране. Такие данные свидетельствуют о том, что между гормональными рецепторами и компонентами аденилатциклазной системы существует общий сопрягающий механизм, проявляющийся при взаимодействии гетеротопных рецепторов и аденилатциклазы клетки-хозяина. Это могло бы указывать на существование области конформационного сходства у всех рецепторов пептидных гормонов при сохранении уникальности их областей, ответственных за специфическое связывание гормонов [36]. Выяснению вопроса о том, действительно ли рецепторы пептидных гормонов обладают общим доменом, определяющим возможность взаимодействия с регуляторными компонентами эффекторных мембранных ферментов, должен был бы способствовать более подробный структурный анализ этих рецепторов.

Рис. 4—11. Роль циклических нуклеотидов в гормональной регуляции аденилатциклазы. Гормонрецепторное взаимодействие приводит к связыванию ГТФ регуляторным участком и активации аденилатциклазы. Гидролиз ГТФ до ГДФ, локализованной в этом участке ГТФфазой, восстанавливает неактивную форму фермента. Токсин холерного вибриона (ТХВ) необратимо инактивирует фермент, блокируй активность ГТФазы. Связывание регуляторным участком негидролизуемых аналогов ГТФ, таких, как Gpp (NH) P, также вызывает длительную активацию фермента (Cassel и соавт. [33] в модификации). Фн — фосфор неорганический.
Результаты опытов по реконструкции, проведенные на мутантных клетках, обладающих b-адренергическими рецепторами и аденилатциклазой, которая, хотя и присутствовала, но была «разобщена» (т. е. не реагировала на катехоламины), показали восстановление стимулируемой катехоламинами активности при добавлении экстрактов клеток дикого типа. Это свидетельствует о том, что сопрягающий фактор (возможно, нормальная нуклеотидрегуляторная единица), включающийся в мембрану мутантной клетки, замещает предположительно дефектный у таких мутантов регуляторный участок [36].
Помимо участия в активации аденилатциклазы, гуаниловые нуклеотиды часто влияют и на кинетику связывания и сродство гормонрецепторного взаимодействия. Анализ солюбилизированных мембранных систем и раздельных эффектов гуаниловых нуклеотидов на связывание гормона и активацию циклазы указывает на структурную и функциональную обособленность участков, влияющих на конформацию рецептора и ферментативную активность [32]. Разделенность «рецепторной» и «каталитической» единицы регуляторного белка надежно доказывается результатами этих и более ранних исследований, но вопрос о механизме взаимодействия компонентов реакции остается нерешенным. Важным аспектом влияния ГТФ на сродство рецепторов к лиганду является способность нуклеотида снижать «прочность» связывания гормона почти с необратимой ассоциации до состояния (в некоторых случаях) с гораздо меньшим сродством. Это наблюдалось в отношении рецепторов глюкагона, а также в отношении связывания лигандов-агонистов с b-адренергическими рецепторами. В отличие от этого, гуаниловые нуклеотиды не изменяли связывание b-антагонистов, что указывает на роль сопряжения с аденилатциклазой в способности нуклеотидов повышать диссоциацию связанного с рецептором агониста [20]. Хотя данные, полученные при исследовании глюкагоновой системы, свидетельствуют в пользу существования обособленных мест действия нуклеотидов на регуляцию рецепторного связывания и активность аденилатциклазы, однако роль этих мест в гормональной активации и рецепторферментном сопряжении все еще остается не выясненной. Состояние низкого сродства рецептора, вызываемое ГТФ, рассматривается как благоприятное предшествующее состояние процесса трансмембранного сопряжения, а разобщенная форма рецептора, обладающая высоким сродством, могла бы отражать неактивное состояние фермента. Последнее могло бы иметь отношение к «десенситизации» аденилатциклазы повышенными концентрациями гормона [20].
Роль фосфорилирования в эффектах цАМФ: протеинкиназы
Вслед за открытием цАМФ и анализом его роли в опосредовании эффектов глюкагона и адреналина на гликолиз было выяснено, что циклический нуклеотид принимает участие в регуляции разнообразных метаболических функций. Свидетельством тому служит глобальное присутствие цАМФ у прокариот и эукариот и его участие в реакциях, связанных не только с действием гормонов [4]. Было установлено, что способность цАМФ активировать фосфорилазкиназу в печеночных клетках является общим свойством эукариотических клеток, в которых все эффекты цАМФ реализуются через фосфорилирование белковых субстратов. Подобно цАМФ в эукариотических клетках присутствует фермент, называемый цАМФ-зависимой протеинкиназой, который опосредует эффекты цАМФ на клеточный метаболизм [37]. У прокариот эффекты цАМФ реализуются через другой механизм — взаимодействие цАМФ-связывающих белков с регуляторными участками генома.
В животных тканях цАМФ-зависимая протеинкиназа катализирует фосфорилирование многих белковых субстратов, перенося фосфат с АТФ на специфические сериновые (и иногда треониновые) остатки. По данному месту фосфорилируется ряд известных белковых субстратов, в том числе ферменты, такие, как фосфорилазкиназа, гликогенсинтетаза и гормончувствительная липаза, и неферментные клеточные белки, такие, как гистоны, ядерные негистоновые, рибосомные белки, белки микротрубочек и мембран [38]. Большинство субстратов, обладающих ферментативной активностью, существует либо в фосфо-, либо в дефосфоформах, взаимопревращение которых из активного в неактивное состояние происходит в результате согласованного действия протеинфосфокиназы и фосфопротеинфосфатазы. Протеинфосфокиназы, в том числе цАМФ-зависимая протеинкиназа, переносят g-фосфатную группу с АТФ на белковые субстраты, тогда как фосфопротеинфосфатазы катализируют гидролиз фосфопротеинов, отщепляя от них фосфатные группы. Этот цикл фосфорилирование—дефосфорилирование считается в настоящее время повсеместно распространенным механизмом регуляции метаболизма, причем применительно не только к ферментам, но и к сократительным реакциям, мембранным активностям и ядерным процессам. На функциональном уровне такие эффекты проявляются физиологическими процессами мышечного сокращения, секреции и деятельности нейронов.
Открытие Greengard того факта, что все животные клетки содержат цАМФ-зависимую протеинкиназу, привело к созданию концепции, согласно которой разнообразные эффекты цАМФ реализуются через этот единственный класс ферментов [39]. С этой точки зрения, специфичность опосредуемых цАМФ реакций определяется характером протеинкиназы и особенно характером белковых субстратов, присутствующих в клетках данного типа. Считается, что каждый белковый субстрат контролирует специфический метаболический или физиологический процесс, скорость которого увеличивается или уменьшается при фосфорилировании регуляторного белка. Способ, с помощью которого фосфорилирование белка опосредует биологические эффекты гормонов и трансмиттеров, действующих через цАМФ, представлен на рис. 4—12.
Следовало бы полагать, что для катализа фосфорилирования отдельных белковых субстратов при опосредовании многочисленных эффектов цАМФ должно существовать множество протеинкиназ. Однако в животных клетках идентифицировано лишь небольшое число основных форм этого фермента; поэтому специфичность каждой реакции фосфорилирования должна определяться локализацией и характером белкового субстрата. Протеинкиназы широко различаются по своей зависимости или независимости от циклических нуклеотидов (табл. 4—2).

Рис. 4—12. Общая схема действия пептидного гормона через аденилатциклазный и протеинкиназный метаболический путь, предполагающая контроль регуляторных белков с помощью фосфорилирования и дефосфорилирования (Greengard [37] в модификации).
Таблица 4—2. Классификация протеинкиназ
1. Ферменты, зависимые и не зависимые от циклических нуклеотидов
2. цАМФ- и цГМФ-зависимые ферменты
3. цАМФ-зависимые ферменты I и II типов
Протеинкиназы, не зависимые от циклических нуклеотидов, присутствуют во всех областях клетки и регулируются, по-видимому, другими внутриклеточными сигналами. Недавно обнаруженный класс протеинкиназ для своей активности требует присутствия липидных компонентов мембраны и кальция; ферменты этого класса могут быть частью трансмембранных контролирующих систем, регулируемых кальцием. Большинство контролируемых гормонами протеинкиназ клеток-мишеней зависит от цАМФ или (реже) от цГМФ. Такие зависимые от циклических нуклеотидов протеинкиназы сосредоточены в цитозоле, по встречаются также в плазматических мембранах и в других клеточных органеллах. Они активируются микромолярными концентрациями циклических пуриновых нуклеотидов (цАМФ и цГМФ) и быстро стимулируются при повышении продукции циклических нуклеотидов в результате действия гормона на клеточную мембрану. Оба типа зависимых от циклических нуклеотидов протеинкиназ активируются при связывании нуклеотида специальным участком фермента. цАМФ-зависимая протеинкиназа в неактивной форме представляет собой тетрамер, состоящий из субъединиц двух типов: для связывания цАМФ и для катализа переноса фосфата. Неактивный тетрамер состоит из двух связывающих, или регуляторных (Р), субъединиц и двух ферментных, или каталитических (К), субъединиц. При связывании цАМФ с Р2-субъединицами тетрамер Р2К2 диссоциирует, высвобождая активные каталитические субъединицы, обладающие фосфотрансферазной активностью [38]. Эту реакцию можно представить следующим образом:
Р2К2 (неактивная) + 4цАМФ « Р2•цАМФ4 + 2К (активная).
После своего образования свободная К-субъединица обнаруживает функциональное сходство с цАМФ-независимыми протеинкиназами, но ее можно отличить по характерному размеру (молекулярная масса 38000) и реакции на термостабильный ингибиторный белок, который блокирует ее каталитическую активность и предотвращает рекомбинацию с регуляторной субъединицей. Каталитические субъединицы, по всей вероятности, едины во всех формах цАМФ-зависимых протеинкиназ, тогда как регуляторные субъединицы обнаруживают индивидуальные особенности. Считается, что регуляторные субъединицы, высвобождающиеся при диссоциации протеинкиназы, остаются в виде Р2-димера и позднее подвергаются повторной ассоциации со свободными каталитическими субъединицами, в результате чего восстанавливается неактивный голофермент. В отсутствии цАМФ регуляторные и каталитические субъединицы связаны друг с другом с высоким сродством и в физиологических условиях присутствуют преимущественно в виде неактивного голофермента [40]. цГМФ-зависимые протеинкиназы вначале были обнаружены у беспозвоночных, но позднее их нашли и в тканях млекопитающих, где они функционируют иным образом, чем цАМФ-зависимый фермент. Их сродство к цАМФ гораздо ниже, чем к цГМФ, а ферментативная активность обычно также уступает таковой цАМФ-зависимого фермента. Активация осуществляется путем связывания цГМФ регуляторным участком фермента, причем считают, что подобно цАМФ-зависимой протеинкиназе этот фермент также диссоциирует с высвобождением активной каталитической единицы. Недавно была установлена гомология между двумя формами зависимых от циклических нуклеотидов ферментов, что привело к мысли об их общем эволюционном происхождении из примитивной фосфотрансферазы [41].
Растворимые формы цАМФ-зависимой протеинкиназы из тканей млекопитающих с помощью ионообменной хроматографии удается разделить на два главных типа (табл. 4—3).
Протеинкиназа I типа имеет менее кислый оптимум, быстро диссоциирует под влиянием субстрата (гистонов) или высокой концентрации соли (0,5 М NaCl) и медленно реассоциирует после вызванной цАМФ диссоциации. Фермент II типа имеет более кислый оптимум и медленнее диссоциирует под действием гистонов и соли, но быстро реассоциирует, образуя неактивный олигомер. В большинстве тканей присутствуют обе формы протеинкиназ, но их соотношение в клетках разного типа варьирует. Так, в скелетной мышце кролика преобладает фермент I типа, а в сердечной мышце крупного рогатого скота—фермент II типа. Оба голофермента обычно сходны по составу и молекулярной массе субъдиниц: каждая связывает по две молекулы цАМФ, а их каталитические субъединицы, по всей вероятности, идентичны. Различия касаются молекулярной массы и функции регуляторных субъединиц, причем главное различие заключается в том, что фермент I типа связывает Mg-АТФ, тогда как фермент II типа катализирует фосфорилирование своей собственной регуляторной субъединицы за счет АТФ. Связывание АТФ ферментом I типа снижает его сродство к цАМФ и, по-видимому, способствует сохранению неактивного состояния фермента. Субъединица I типа, хотя и связывает АТФ, не фосфорилируется каким бы то ни было ферментом, что отличается от «аутофосфорилирования», свойственного ферменту II типа [42].
Таблица 4—3. Свойства цАМФ-зависимой протеинкиназы
|
Тип I |
Тип II |
|
|
Тканевой источник |
Скелетная мышца кролика Клетки Лейдига крысы |
Сердечная мышца быка Сердечная мышца свиньи Головной мозг быка |
|
Структура субъединиц |
Р2К2 |
P2K2 |
|
Молекулярная масса |
||
|
Голофермент |
165 000 |
174000 |
|
Р2 |
98000 |
98000 |
|
К |
38000 |
38000 |
|
Элюция с ДЭАЭ-целлюлозы |
0,1 М NaCl |
0,2 М NaCl |
|
Диссоциация под действием соли и гистонов |
Быстрая |
Медленная |
|
Реассоциация после удаления цАМФ |
Медленная |
Быстрая |
Функциональное значение этих двух эффектов на Р-субъединицы не ясно, хотя фосфорилирование ферментов II типа могло бы представлять собой эволюционно более позднюю форму связывания субстрата (АТФ), характерного и для фермента I типа. Фосфорилирование протеинкиназы II типа сопровождается снижением скорости воссоединения диссоциированных Р- и К-субъединиц. Таким образом, фосфорилирование могло бы служить фактором контроля за активностью диссоциированного фермента и регулировать скорость восстановления его неактивной формы. Ускорение дефосфорилирования Р-субъединицы должно было бы способствовать рекомбинации голофермента Р2К2, приводящей к высвобождению и разрушению цАМФ. Таким способом могла бы осуществляться регуляция соотношения активного и неактивного ферментов в отсутствие изменений концентрации цАМФ. Другая возможность заключается в том, что ферменты II типа, участвующие в быстрых циклах метаболических процессов, что наблюдается в сердечной и нервной тканях, приобрели способность более тонко регулироваться (инактивироваться) эффектами этапа фосфорилирования: дефосфорилирование на регуляторную субъединицу по механизму ультракороткой обратной связи.
После установления роли цАМФ-зависимой протеинкиназы в фосфорилировании и активации фосфорилазы киназы было показано, что этот фермент фосфорилирует основные белки, в том числе гистоны, казеин и протамин, как и многие денатурированные белки (такие, как протеин яичного белка, лизоцим и бычий сывороточный альбумин), в своем нативном состоянии не являющиеся субстратами фосфорилирования. Небольшие основные пептиды также фосфорилируются этим ферментом, как и синтетические пептидные последовательности, сходные с участками фосфорилирования нативных и денатурированных белковых субстратов. Эти данные указывают на то, что реакция фосфорилирования, осуществляемая протеинкиназой, является не слишком специфичной в отношении аминокислотных последовательностей отдельных белков, но обладает сравнительно высокой специфичностью по отношению к остаткам серина, локализованным в определенных участках первичной аминокислотной последовательности многих белков. При анализе структур, необходимых для фосфорилирования, обнаружили, что пептидные субстраты протеинкиназы обладают двумя близко расположенными основными аминокислотами, одной из которых является аргинин, локализующийся через 2—5 остатков от фосфорилируемого серинового остатка на аминоконцевой стороне пептида [43].
В физиологически важных белковых субстратах цАМФ-зависимой протеинкиназы были определены две формы аминокислотной последовательности на участке фосфорилирования
![]()
В этих последовательностях на месте Х может стоять любая аминокислота, хотя остатки, располагающиеся в непосредственной близости к серину, обычно имеют гидрофобные боковые цепи. Участок фосфорилирования I типа, где основные аминокислоты отделены от серина двумя остатками, присутствует в b-субъединице фосфорилазы киназы и в гликогенситетазе. Участок II типа ним промежуточным остатком) присутствует в пируваткиназе и регуляторной субъединице цАМФ-зависимой протеинкиназы II типа. Поскольку скорость фосфорилирования главным образом зависит от сравнительно часто встречающейся первичной последовательности на определенном участке пептидной цепи, специфичность отдельных белков как субстратов фосфорилирования должна определяться их вторичной и третичной (т. е. трехмерной) конформацией, которая может ограничивать присутствие потенциально фосфорилируемых участков для каталитической единицы фермента. Предполагаемая роль вторичной структуры в определении субстратной специфичности сводится к положению фосфорилируемого серина на гидрофильной поверхности белкового субстрата, в сформированных водородными связями складках b-структуры, которая может быть «узнана» протеинкиназой [44].
Механизмы гликогенолиза и липолиза
Гормональная регуляция межуточного обмена и продукции энергии является одной из наиболее изученных областей действия пептидных гормонов. Общие аспекты гормональной регуляции гомеостаза глюкозы выяснены сравнительно полно, но клеточные механизмы оказались более сложными, чем считали ранее. В периоды голодания основным источником глюкозы крови служит печень, высвобождающая сахар со скоростью, зависящей от содержания глюкозы в крови и действия катаболических гормонов, таких, как глюкагон и катехоламины. В физиологических условиях главным ингибитором высвобождения глюкозы является инсулин, причем секретируясь после приема пищи, он противодействует эффектам катаболических гормонов. Глюкоза, высвобождаемая печенью при голодании, вначале продуцируется за счет гликогенолиза, но после истощения запасов гликогена в органе — за счет глюконеогенеза из лактата и аминокислот.
Исследования Rail и Sutherland по гликогенолизу в печени собак показали, что цАМФ, образуемый аденилатциклазой в ответ на действие глюкагона и адреналина, вызывает активацию гликогенфосфорилазы [45]. Эта реакция зависит от превращения фосфорилазы киназы из неактивной (дефосфо-) формы в активный фосфорилированный фермент, который затем катализирует превращение гликогенфосфорилазы b в активную фосфорилазу а в ходе последующего этапа фосфорилирования. Активная фосфорилаза разрушает гликоген до глюкозо-1-фосфата, превращающегося в глюкозо-6-фосфат, а затем в свободную глюкозу, высвобождаемую в кровь (рис. 4—13). цАМФ-зависимый фермент, ответственный за активацию фосфорилазы киназы, названный вначале киназой фосфорилазкиназы, оказался широко распространенным в природе-и способным катализировать фосфорилирование многих белковых субстратов, а не только фосфорилазу киназы. Это привело к мысли о том, что все эффекты цАМФ у высших организмов опосредуются реакциями фосфорилирования белков, осуществляемыми цАМФ-зависимой протеинкиназой, выступающей в роли внутриклеточного рецептора цАМФ [39].
Общая схема метаболизма гликогена в печени, приведенная на рис. 4—13, начинается с активации протеинкиназы катаболическими гормонами, вслед за чем происходит фосфорилирование фосфорилазкиназы и гликогенсинтетазы [46]. Фосфорилирование активирует киназу и инактивирует синтетазу, вызывая ускорение фосфоролитического расщепления гликогена и снижение его синтеза из. УДФ-глюкозы. Протеинкиназа опосредует влияние цАМФ на распад гликогена и в скелетной мышце, обеспечивая ткань глюкозо-1-фосфатом для гликолиза. В печени, помимо стимуляции распада гликогена до глюкозы и угнетения синтеза гликогена, цАМФ стимулирует также глюконеогенез из таких предшественников, как аланин, лактат и пируват.

Рис. 4—13. Регуляция печеночного гликогенолиза гормонами, действующими через цАМФ-зависимую протеинкиназу и кальцийзависимые процессы. Каталитическая субъединица (КС); отделяющаяся под действием цАМФ от голофермента протеинкиназы, фосфорилирует и активирует гликогенфосфорилазу (через фосфорилазу киназы) и обусловливает фосфорилирование и инактивацию гликогенсинтетазы (вероятно, через тот же фермент), что приводит к распаду гликогена и увеличению продукции глюкозы. Повышение содержания кальция в цитозоле, обусловленное поглощением или мобилизацией кальциевых запасов, действует как фактор, опосредующий влияние a-агонистов (а также вазопрессина и ангиотензина II) на активацию фосфорилазкиназы, путем связывания с кальмодулином — d-субъединицей фосфорилазо-b-киназы. PC — регуляторная субъединица; Фн — фосфор неорганический.
Хотя главным регулятором быстрого высвобождения глюкозы из печени считается глюкагон, но катехоламины также, по-видимому, играют важную роль в этом процессе у некоторых видов животных и человека. Первоначально считали, что действие как глюкагона, так и катехоламинов на активацию фосфорилазы опосредуется цАМФ; кальцию отводили дополнительную роль в стимуляции фосфорилазкиназы. Что касается глюкагона, то до сих пор еще полагают, что его влияние на печеночный гликогенолиз (и глюконеогенез) зависит от цАМФ, действующего, вероятно, в концентрациях, гораздо более низких, чем те, которые создаются при экспериментальной стимуляции печеночных клеток глюкагоном. Однако в отношении катехоламинов современные данные свидетельствуют о том, что в отличие от действия глюкагона стрессорные гормоны, такие, как катехоламины, вазопрессин и ангиотензин II, стимулируют гликогенолиз и глюконеогенез не через цАМФ, а с помощью других механизмов. Хотя адреналин активирует аденилатциклазу через печеночные b-адренергические рецепторы, повышая образование цАМФ, в настоящее время считают что влияние катехоламинов на печеночный гликогенолиз опосредуется главным образом a-адренергическими рецепторами и не зависит от цАМФ. Вместо этого a-адренергическая активация фосфорилазы зависит, по-видимому, от ионов кальция [47].
Вазопрессин и ангиотензин II также стимулируют печеночную фосфорилазу с помощью цАМФ-независимого механизма, в котором важную роль играет «кальциевый статус» гепатоцита, опосредующий действие всех трех стрессорных гормонов. Считают, что эти пептиды активируют печеночную фосфорилазу путем мобилизации внутриклеточных запасов кальция (что приводит к повышению его концентрации в цитозоле) и далее к стимуляции фосфорилазо-b-киназы [48]. Роль внутриклеточных источников кальция, мобилизуемого при действии гормонов, приписывают митохондриям, микросомам и плазматической мембране; в последней это является результатом ускоренного кругооборота фосфатидилинозитола. Современные данные свидетельствуют в пользу митохондриального кальциевого пула как источника, из которого катехоламины (а также вазопрессин и ангиотензин II) черпают кальций, поступающий в цитоплазму и внеклеточную жидкость. Это означает, что второй медиатор, образуемый гормонрецепторным взаимодействием в плазматической мембране, приводит к мобилизации внутриклеточных кальциевых запасов, увеличивая результирующий выход кальция из митохондрий [47]. При a-адренергической стимуляции печеночных клеток наблюдали и повышение уровня пГМФ, но это, вероятно, отражает изменения концентрации свободного внутриклеточного кальция и последующую активацию гуанилатциклазы. Функциональное значение эффектов гормонов этой группы на печень может заключаться в их связи с острым стрессом, поскольку они индуцируют печеночный гликогенолиз в таких концентрациях, которые присутствуют в крови лишь при шоке и обезвоживании [49].

Рис. 4—14. Регуляция липолиза цАМФ-зависимой протеинкиназой. Активация гормончувствительной липазы путем фосфорилирования приводит к ускорению распада триглицеридов с образованием глицерина и свободных жирных кислот (по данным Steinberg и соавт. [5] в модификации). КС — каталитическая субъединица; PC — регуляторная субъединица. Фн — фосфор неорганический.
Помимо действия на гликолиз, обеспечивающего присутствие глюкозы как источника энергии, цАМФ играет также важнейшую роль в мобилизации свободных жирных кислот из жировой ткани. Это обусловливается фосфорилированием и активацией гормончувствительной липазы, которая регулирует скорость-ограничивающий этап гидролиза эфирных связей в процессе распада триглицеридов (рис. 4—14). Быстро действующие гормоны, в том числе глюкагон, адреналин и АКТГ, повышают активность гормончувствительной липазы путем фосфорилирования, которое определяется цАМФ-зависимой протеинкиназой. Поскольку жировая ткань содержит также фосфорилазу и гликогенсинтетазу, то присутствие трех ферментных систем, контролируемых цАМФ-зависимой протеинкиназой, повышает необходимость существования «пост-цАМФ овых» механизмов, которые регулировали бы и интегрировали отдельные ферментативные процессы, «запускаемые» протеинкиназой [50].
Насколько общей является роль фосфорилирования в эффектах цАМФ?
Тот факт, что многие гормоны повышают содержание цАМФ в своих клетках-мишенях и что в большинстве клеток млекопитающих присутствуют близкие уровни цАМФ-зависимой протеинкиназы, привел к представлению о том, что эффекты цАМФ в эукариотических тканях реализуются путем фосфорилирования регуляторных белков. Этот механизм действия радикально отличается от того, который функционирует у прокариот, у которых цАМФ действует с помощью стероидоподобного механизма, заключающегося в том, что цАМФ-связывающий белок, регулирует транскрипцию генов после связывания с бактериальной ДНК [54]. Как уже отмечалось, можно полагать, что бактериальный цАМФ-связывающий белок и регуляторная цАМФ-связывающая субъединица образовались в процессе эволюции из примитивной глюкотрансферазной системы. У эукариотических организмов связывание цАМФ с высоким сродством полностью ограничено только регуляторной субъединицей протеинкиназы, которая действует в функциональном соответствии с аденилатциклазой, реализуя эффекты различных гормонов. Поскольку число отдельных цАМФ-зависимых протеинкиназ ограничено двумя или тремя основными типами, то, как уже отмечалось, функциональное разнообразие гормональных эффектов должно зависеть от специфичности ферментов и присутствия специфических субстратов или специфических участков белковых субстратов.
Хотя в некоторых тканях млекопитающих были идентифицированы и другие цАМФ-связывающие белки, они не обнаруживали свойственных регуляторной субъединице протеинкиназы высокого сродства и специфичности связывания. цАМФ в качестве субстрата связывается и с фосфодиэстеразами, присутствующими в большинстве клеток, но опять-таки эта связь не имеет той высокой специфичности и сродства, которые характерны для связи цАМФ с регуляторной субъединицей протеинкиназы. Таким образом, современная точка зрения, согласно которой цАМФ действует только через протеинкиназу, по всей вероятности, соответствует действительности; это относится и к представлению о том, что в действии цАМФ всегда участвует фосфорилирование. Рассматривалась и возможность миграции комплекса цАМФ-Р в ядро и другие клеточные участки с развитием в них регуляторных эффектов,, но чаще предполагается транслокация в ядра голофермента или свободной каталитической субъединицы. Некоторые данные о перемещении связывающих или ферментных субъединиц между цитоплазмой и фракциями клеточных частиц наверняка могли зависеть от условий эксперимента, но другие, по-видимому, отражают истинную транслокацию фосфокиназной активности в ядро. Поскольку большинство эффектов белковых гормонов не зависит от изменения синтеза РНК и белка, вряд ли можно думать, что ядерные влияния цАМФ являются компонентом быстрых регуляторных действий циклического нуклеотида. Хотя цАМФ-зависимая протеинкиназа может играть роль в фосфорилировании ядерных белков [52] и регуляции транскрипции и синтеза РНК, значение этих эффектов протеинкиназы в качестве механизма, с помощью которого цАМФ мог бы регулировать функцию клеток-мишеней, нуждается в дальнейшей оценке.
Гормоны, использующие цАМФ в качестве второго медиатора
Хотя известно, что многие пептидные гормоны действуют путем опосредованной рецептором активации аденилатциклазы и образования цАМФ, в других случаях невозможно продемонстрировать роль цАМФ в механизме действия пептидов. К предполагаемым внутриклеточным медиаторам действия пептидных гормонов относятся кальций, цГМФ, калий, простагландины и изменения мембранного потенциала и внутриклеточного окислительно-восстановительного потенциала. На самом деле, существует мало надежных доказательств роли большинства из этих факторов в действии пептидных гормонов, хотя на кальций как на главный внутриклеточный регулятор в стимулированных гормонами клетках указывают достаточно многочисленные косвенные данные. Изменение концентрации ионов во внутриклеточных пространствах измерить очень трудно, что создает проблемы при попытке приписать кальциевым и калиевым сигналам специфические эффекторные свойства при действии гормонов. В отличие от этого уровень индуцированного гормоном цАМФ может быть относительно велик по сравнению с базальным внутриклеточным содержанием нуклеотида, причем при стимуляции клеток-мишеией пептидными гормонами значительные количества цАМФ часто высвобождаются во внеклеточную жидкость. Внеклеточный цАМФ у низших организмов (например, слизистая плесень) играет биологическую роль, но у высших животных за ним не признают значения межклеточного медиатора. В тканях млекопитающих внеклеточные уровни цАМФ повышаются только при чрезмерной гормональной стимуляции, что наблюдают в почках при инфузии или гиперсекреции паратиреоидного гормона.
Как правило, однако, изменения уровня цАМФ, вызываемые физиологическими концентрациями пептидных гормонов, весьма малы, что иногда создает впечатление расхождений между реакциями клеток-мишеней и степенью продукции цАМФ. Такие кажущиеся противоречия были объяснены с помощью тщательных измерений уровня цАМФ в отдельных клеточных пространствах (например, связанного с регуляторной субъединицей протеинкиназы). Такой подход обнаружил корреляцию между уровнями Р-цАМФ и реакциями стероидогенеза в семенниках, яичниках и надпочечниках, возникающими при действии соответствующих тропных гормонов [6]. Вместе с тем применение аналогичных подходов к анализу действия других пептидных гормонов, таких, как ангиотензин II и ГнРГ, выявило отсутствие корреляции между реакциями цАМФ и других клеточных процессов (например, секреции альдостерона и высвобождения ЛГ) на гормон, что указывает, вероятно, на большую роль других факторов (таких, как кальций) в качестве второго медиатора действия этих лигандов. Значение кальция как внутриклеточного регулятора гормонального эффекта подробнее описывается в следующем разделе.
Пептидные гормоны с указанием роли цАМФ в опосредовании их действия перечислены в табл. 4—1. Некоторые пептиды и белки можно считать наверняка зависимыми от роли цАМФ в качестве второго медиатора (АКТГ, ЛГ, ФСГ, ТТГ, глюкагон), тогда как другие (ангиотензин II, ГнРГ) в большей степени зависят, вероятно от кальция, а третьи определенно не опосредуют свое действие циклическим нуклеотидом (СТГ, пролактин, инсулин и другие факторы роста). Даже в тех случаях, когда действие пептидного гормона на конкретную клеточную реакцию можно отнести за счет цАМФ как второго медиатора, это не исключает существования других эффектов (например, на клеточный рост и сохранение дифференцированных функций), которые могут опосредоваться и не циклическими нуклеотидами.
КАЛЬЦИЙ
Значение кальция как активатора клеточных функций было выяснено почти 100 лет назад, когда Ringer показал его роль в сократимости сердечной мышцы лягушки. Помимо участия кальция в мышечном сокращении и нейромышечной передаче, было установлено, что он играет существенную роль в секреторных процессах, а также участвует в более общих механизмах внутриклеточной регуляции [53]. Функция кальция в качестве внутриклеточного медиатора постулируется гипотезой сопряжения стимула и секреции, которая исходит из того, что ионы кальция служат первичным соединительным звеном между стимулом и секрецией [54]. Позднее выяснилось значение кооперативных взаимодействий между кальцием и циклическими нуклеотидами при действии гормонов [29]. В настоящее время кальций и циклические нуклеотиды считаются главными компонентами внутриклеточной сигнальной системы, которая регулирует активность клеток в ответ на внешние стимулы [29, 30]. Каждый из этих медиаторов совершает быстрый кругооборот, так что их внутриклеточная концентрация отражает динамическое равновесие между возникновением и исчезновением сигнала. Этот динамический баланс и быстрый кругооборот молекул медиатора обусловливает возможность быстрого реагирования на прекращение стимула. Повышение внутриклеточного содержания «вторых медиаторов» при действии гормонов обычно обусловливается ускорением их образования, что наблюдается при стимуляции аденилатциклазы или притоке кальция. В некоторых случаях, однако, изменение уровня сигнала определяется снижением скорости его исчезновения, что происходит при изменении уровня цАМФ вследствие изменения активности фосфодиэстеразы. В этом отношении взаимодействия, существующие между кальцием и генерацией и метаболизмом циклических нуклеотидов, весьма важны, поскольку ферменты, контролирующие как синтез, так и разрушение цАМФ и цГМФ, регулируются зависимыми от кальция механизмами обратной связи, которые интегрируют активность «вторых медиаторов» при гормональной стимуляции [30].
Регуляция внутриклеточной концентрации кальция
Функция кальция в качестве медиатора требует возможности быстрых изменений его концентрации в нужных участках клетки во время действия гормонов с последующим влиянием на конкретные метаболические процессы. Это влияние обычно зависит от модуляции активности специфических регуляторных ферментов, например, перечисленных в табл. 4—4.
Таблица 4—4. Некоторые ферменты, активность которых модулируете» кальцием
|
Аденилатциклаза |
Кальцийзависимая протеинкиназа |
|
Гуанилатциклаза |
Фосфорилаза киназы |
|
Фосфодиэстераза циклических нуклеотидов |
Гликогенсинтаза |
|
Ca2+/Mg2+-ATФaaa |
Пируватдегидрогеназа |
С точки зрения гормонального эффекта влияние кальция на активность аденилат- и гуанилатциклазы, а также фосфодиэстеразы является важнейшим фактором динамического контроля за внутриклеточным содержанием циклических нуклеотидов. В настоящее время известно, что регуляторные влияния кальция на ферментные системы зависят от его связывания белком с низкой молекулярной массой, называемым кальций-зависимым регулятором (КЗР) или кальмодулином. Этот белок, первоначально идентифицированный в качестве регулятора активности фосфодиэстеразы в головном мозге [55], известен в настоящее время как выполняющий важную промежуточную функцию в контроле кальциевой регуляции ферментов во многих тканях. В некоторых случаях активность кальмодулина тесно связана с регулируемым ферментом, и комплекс Са2+—кальмодулин служит регуляторным лигандом, опосредующим эффекты свободного Са2+ на активацию или ингибирование фермента.
Первичным сдвигом при опосредованных кальцием клеточных реакциях на внешние стимулы является поступление ионов кальция в цитоплазму клетки. Кальций, участвующий в этом движении, должен поступать из одного, из двух главных источников: либо из внутриклеточных запасов, либо из внеклеточной жидкости, в которой концентрация свободного кальция составляет примерно-1,25 мМ. Хотя внутриклеточная концентрация свободного кальция очень низка (от 0,1 до 10 мкМ), в митохондриях и микросомах концентрация его сравнительно высока (1—20 мМ). Плазматическая мембрана также содержит существенные количества связанного кальция и обнаруживает высокий трансмембранный кальциевый градиент. Помимо высокого концентрационного градиента между внеклеточным и внутриклеточным кальцием, трансмембранный электрический градиент способствует поступлению кальция в клетку, хотя скорость притока кальция в отсутствие внешних стимулов обычно низка. Эта ограниченная проницаемость вкупе с наружным перимембранным пулом связанного кальция придает многим клеткам относительную толерантность к изменениям концентрации кальция в окружающей среде, особенно в условиях покоя. Однако повышенная чувствительность к кальцию, часто сопровождающая стимуляцию, свидетельствует о том, что важным этапом активации клеток является изменение проницаемости мембран [30]. Таким образом, хотя перераспределение внутренних запасов кальция могло бы служить фактором повышения внутриклеточного уровня этого иона, основной формой регуляции является, вероятно, изменение проницаемости плазматической мембраны или процессов транспорта кальция в клетку.
Поступление кальция через плазматическую мембрану может обусловливаться изменением проницаемости мембраны или мембранного потенциала под действием стимула. Хотя это, вероятно, имеет меньшее отношение к действию пептидных гормонов, изменение мембранного потенциала связано, по-видимому, со способностью высоких концентраций калия стимулировать многие гормон-зависимые процессы за счет деполяризации мембраны и увеличения поступления кальция. В общем, увеличение внутриклеточного содержания кальция вследствие изменений мембранной проницаемости сопровождается выходом кальция из клетки, что можно видеть при проведении опытов с 45Са. Однако изменения потока радиоактивного кальция обычно невелики и могут стимулироваться повышением обмена кальция между его внутриклеточными запасами. Прирост количества внутриклеточного кальция в нервных и мышечных клетках активно ликвидируется за счет его обмена на натрий, а в невозбудимых клетках — за счет работы мембранного кальциевого насоса (вероятно, Ca/Mg-АТФазы). В связи с этим стимулы, опосредуемые перераспределением внутриклеточного кальция, часто сопровождаются увеличением выхода 45Са из клетки вследствие быстрого вытеснения мобилизованного кальция через плазматическую мембрану.
Механизмы действия кальция как второго медиатора: кальмодулин
Биологические эффекты кальция реализуются с помощью трех главных механизмов: взаимодействия с сократительными элементами, изменения проницаемости мембран для ионов и регуляции активности ферментов. Влияние кальция на аденнлат- и гуанилатциклазу и фосфодиэстеразу играет существенную роль в регуляции динамических уровней циклических нуклеотидов и в сопряжении двух внутриклеточных систем медиаторов за счет механизмов обратной связи, интегрирующих биологическую активность этих систем (рис. 4—15).
Основной прогресс в понимании эффектов кальция был связан с открытием кальцийзависимого регуляторного белка, или кальмодулина, и выяснением его структурного и функционального сходства с тропонином С [55]. При мышечном сокращении кальций связывается тропонином и образующийся комплекс одновременно облегчает взаимодействие между актином и миозином и активирует миозиновую АТФазу, что необходимо для повторения актино-миозинового взаимодействия. Присутствие актина в несокращающихся клетках указывает на роль сократительных элементов. в клеточной мобильности, движении клеточных органелл, высвобождении гранул и эндоцитозе. Поскольку содержащие актин микрофиламенты часто концентрируются под плазматической мембраной и иногда оказываются прикрепленными к мембранным белкам, они могли бы служить фактором, опосредующим эффекты кальция на подвижность клеток, текучесть мембраны и перегруппировку или интернализацию связанных с мембраной белков и ассоциированных с ними наружных лигандов.

Рис. 4—15. Общая связь между главными межклеточными и внутриклеточными регуляторными лигандами и их рецепторными белками, т. е. пептидными гормонами, кальцием и циклическими нуклеотидмонофосфатами (цНМФ). В3аимодействие между этими медиаторами затрагивают их метаболизм и функции, равно как и их комплементарные роли в отношении скорости, расстояния и продолжительности действия (Cheung f55] в модификации).
Хотя было показано, что многие клетки содержат широкую сеть актино- и миозиноподобных нитчатых белков, прикрепленных к внутренней поверхности плазматической мембраны и часто к. мембранам секреторных гранул, присутствие характерного для мышцы тропонинового компонента в несокращающихся клетках было установлено не сразу. Недавнее открытие тропониноподобных кальцийсвязывающих белков в клетках многих типов привело к созданию представления об общем кальцийзависимом регуляторном (КЗР) белке, или кальмодулине. В общем, кальмодулин, по-видимому, играет роль, аналогичную тропонину С, опосредуя кальциевые эффекты в несокращающихся тканях. Присутствующий в; этих тканях кальмодулин иногда связан с сетью микронитей, а в других случаях тесно ассоциирован с кальцийрегулируемыми ферментами в виде прочно связанной или входящей в их состав субъединицы. Помимо того, что он служит внутриклеточным рецептором кальция, кальмодулин влияет на транспорт кальция и; кальциевую регуляцию уровня циклических нуклеотидов и метаболизма гликогена, а также регуляцию таких процессов, как секреция и клеточная подвижность. Кальмодулин является также динамическим компонентом митотического аппарата, где он может регулировать полимеризацию микротрубочек, активность актомиозина и мембранных кальциевых насосов [56а].

Рис. 4—16. Ферменты и клеточные процессы, регулируемые кальмодулином (Cheung в модификации).
После индентификации кальмодулина в качестве термостабильного регуляторного белка нескольких ферментов головного мозга он был выделен из многих тканей, очищен и охарактеризован как рецепторных белок с молекулярной массой 17 000, обладающий высокой специфичностью и сродством связывания Са2+. Каждая молекула кальмодулина содержит 4 кальцийсвязывающих участка, насыщение которых приводит к изменению конформации белка, приобретающего преимущественно a-спиральную конфигурацию, придающую кальмодулину способность регулировать зависимые от пего ферментные системы. Белок состоит из 148 аминокислот с высоким содержанием фенилаланина и кислых остатков и обнаруживает значительную гомологию последовательности с тропонином С из скелетной и сердечной мышцы. Присутствие кальмодулиноподобных белков во многих тканях млекопитающих и беспозвоночных указывает на вероятность опосредования физиологических эффектов кальция такими рецепторными белками, которые в свою очередь регулируют активность отдельных ферментов.
Значение кальмодулина как медиатора кальциевых эффектов впервые было установлено на ткани головного мозга, где выяснилось, что активация кальцийзависимой фосфодиэстеразы требует присутствия модуляторного белка. К ферментам, активация которых кальцием, как известно, в настоящее время, зависит от кальмодулина, относятся аденилатциклаза и фосфодиэстераза головного мозга, Ca/Mg-АТФаза мембраны эритроцитов, фосфорилазкиназа и киназа легкой цепи миозина (рис. 4—16). Как активация фермента модуляторным белком, так и связывание модулятора с ферментом зависят от присутствия кальция. При повышении концентрации кальция модуляторный белок связывает его и подвергается конформационному изменению, переходя в активное состояние, в котором он и связывается с ферментом, повышая его каталитическую активность. Не исключено, что при взаимодействии кальмодулина с разными регулируемыми системами степень насыщения 4 кальцийсвязывающих участков неодинакова; это может помочь объяснить расхождение его биологических эффектов. Роль кальмодулина в фосфорилировании киназы легких цепей миозина может быть связана с регуляцией сокращения гладких мышц (рис. 4—17). Насыщение b-рецепторов адреналином и стимуляция образования цАМФ приводит к активации протеинкиназы и фосфорилированию миозинкиназы, что ослабляет связывание кальмодулина. При низком уровне кальмодулина миозинкиназа менее активна и может преобладать активность фосфатазы, что обусловит сохранение меньшего числа молекул миозина в фосфорилированном состоянии. Вследствие этого не возникает взаимодействия между актином и миозином, и гладкая мышца расслабляется.

Рис. 4—17. Схема механизма регуляции сокращения гладкой мышцы под влиянием кальция и цАМФ. Доступность Са2+-кальмодулина определяет баланс между фосфорилированной (неактивной) и дефосфорилированной (потенциально активной) миозинкиназой. Фосфорилированная киназа связывает кальмодулин с более низким сродством, чем нефосфорилированный фермент. В связи с этим при одной и той же концентрации кальмодулина фосфорилированная киназа неактивна, а нефосфорилированная киназа находится в активной форме (Conti, Adelstein [56] в модификации).
Позднее в головном мозге был идентифицирован белок, связывающий кальмодулин и ингибирующий фосфодиэстеразу. Этот так называемый модуляторный связывающий белок может представлять собой еще один регуляторный фактор в системе гомеостаза кальция либо являться другим кальмодулинрегулируемым ферментом или, возможно, общей связывающей субъединицей кальмодулинрегулируемых ферментов. Относительно малое количество этого белка, присутствующего в мозге, указывает на большую вероятность его функционирования в качестве фермента или субъединицы.
Взаимодействие между кальцием и циклическими нуклеотидами
Накапливается все больше данных о некоторых реципрокных взаимодействиях между кальцием и циклическими нуклеотидами, создающих сеть реакций обратной связи, с помощью которых две сигнальные системы регулируют активность друг друга (рис. 4— 18). В3аимоотношения между цАМФ и кальцием подразделяются на два типа в соответствии с их ролью в качестве одно- или двухуправляемых контрольных систем в отдельных тканях-мишенях (30).

Рис. 4—18. Схематическое изображение взаимодействий между кальцием и циклическими нуклеотидами и основных процессов, регулирующих внутриклеточный уровень этих медиаторов. Некоторые стимулы (1) увеличивают приток кальция (а), а также способствуют высвобождению кальция из внутриклеточных запасов (б). Цитоплазматический свободный кальций связывается с кальмодулином, регулируя большинство известных кальцийзависимых ферментов. Кальций удаляется из цитоплазмы, вытесняясь из клетки (в) или накапливаясь в кальциевых резервуарах (г). Другие стимулы (2) активируют аденилатциклазу (д) и увеличивают образование цАМФ. Наряду со скоростью гидролиза фосфодиэстеразой (е), это определяет внутриклеточный уровень цАМФ. Синтез цГМФ гуанилатциклазой (ж) изменяется под влиянием внутриклеточного уровня кальция; цГМФ также разрушается фосфодиэстеразой (з) обычно быстрее, чем цАМФ. Прерывистые линии показывают некоторые из механизмов обратной связи во взаимоотношениях между циклическими нуклеотидами и кальцием, а агенты, стимулирующие или ингибирующие поступление кальция и аденилатциклазу, указаны в верхней части рисунка (Berridge [30] в модификации).
Одноуправляемые системы — это системы, присутствующие в клетках, регулируемых одним стимулом, где функционирует лишь простая регуляция типа «включение—выключение» в зависимости от присутствия или отсутствия стимула. В разных видах клеток в качестве второго медиатора может действовать кальций либо цАМФ и если образуется цАМФ, то он усиливает кальциевый сигнал. К тканям, в которых функционируют одноуправляемые контрольные системы, относятся нервная ткань, мозговой слой надпочечников, передняя доля гипофиза, эндокринная и экзокринная части поджелудочной железы, кора надпочечников, мочевой пузырь, слюнные железы и фоторецепторные органы. Во всех этих тканях клеточная активность регулируется только в одном направлении («выключена ® включена»), причем активность прекращается после удаления стимула. В большинстве случаев вторым медиатором является, по-видимому, кальций, а цАМФ оказывает косвенное или усиливающее действие на кальциевые эффекты. В тканях, контролируемых тропными гормонами гипофиза (т. е. в надпочечниках, семенниках, яичниках и щитовидной железе), цАМФ играет более важную роль как второй медиатор, но опять-таки действует в тесной связи с кальцием, что можно наблюдать при регуляции ферментов стероидогенеза и секреции тироксина.
Двухуправляемые контрольные системы функционируют в клетках, регулируемых двумя независимыми стимулами, например когда один стимул «запускает» клеточную активность, а второй останавливает реакцию, обычно противодействуя первому стимулу. В таких тканях, как правило, именно кальций служит первичным сигналом 1-го стимула, а цАМФ опосредует ингибиторный эффект 2-го стимула, модулируя внутриклеточный уровень кальция. Таким образом, в отличие от синергизма между цАМФ и кальцием в одноуправляемых системах, в двухуправляемых эффекты цАМФ и кальция антагонистичны. Примерами тканей, в которых функционирует последняя форма контроля, являются гладкая и сердечная мышцы, меланофоры, тромбоциты, тучные клетки и печень. В каждом из этих типов клеток активация обусловливается повышением уровня кальция, выходящего из внутриклеточных запасов или поступающего извне, а противодействующие стимулы снижают содержание кальция в цитоплазме за счет действия цАМФ. Печень и жировая ткань обладают некоторыми чертами одноуправляемых систем, поскольку цАМФ повышает внутриклеточный уровень кальция и способствует однонаправленным гликогенолитическим эффектам адреналина и глюкагона. Однако инсулин противодействует влиянию этих катаболических гормонов, вероятно, за счет снижающего действия на внутриклеточный уровень цАМФ, выступающего в роли основного «второго медиатора» в этой ткани. В более общем случае двухуправляемых систем противодействующие эффекты кальция и цАМФ проявляются весьма отчетливо. Хотя предполагалось, что и цГМФ противодействует эффектам цАМФ, становится все более очевидным, что уровень цГМФ часто регулируется внутриклеточной концентрацией кальция и тем самым отражает эффекты кальция, а не является первичным антагонистом цАМФ. Данные о зависимости между активацией рецепторов и последующими изменениями в мобилизации кальция и образовании цАМФ суммированы на рис. 4—19.
ДЕЙСТВИЕ ГОРМОНОВ И МЕТАБОЛИЗМ ФОСФОЛИПИДОВ
Недавно проведенные исследования в области действия пептидных гормонов показали, что мембранные фосфолипиды и продукты их метаболизма играют важную роль в реакции клеток-мишеней на гормональную стимуляцию. Фосфолипиды участвуют в действии гормонов, по меньшей мере, тремя основными путями 1) как источник производных арахидоновой кислоты — предшественников для синтеза простагландинов и родственных соединений с вторичными эффектами на ткань-мишень; 2) за счет ускорения кругооборота фосфатидилинозитола и образования полнфосфоинозитидов, влияющих на метаболизм клетки-мишени (например, стероидогенез); 3) за счет повышения метилирования фосфолипидов, приводящего к образованию фосфатидилхолина из фосфатидилэтаноламина с последующими изменениями текучести плазматической мембраны и подвижности рецепторов в ней.

Рис. 4—19. Взаимоотношения между путями активации, «запускаемыми» гормональными рецепторами и связанными с мобилизацией кальция и аденилатциклазой. Этот пример подчеркивает роль Са2+-кальмодулина в определении скорости разрушения циклического нуклеотида фосфодиэстеразой. Другие области взаимодействия между двумя системами показаны на рис. 4—13, 4—15, 4—17 и 4—18 (Schulster, Levitski [45в] в модификации).
Г — гормон: Рец — рецептор; АЦ — аденилатциклаза: ПК — протеинкиназа (кат-каталитическая, per — регуляторная субъединица); КМ — кальмодулин; ФДЭ — фосфодиэстераза; белок-Ф—фосфорилированный белок.
Фосфолипиды: структура, метаболизм и функция

Рис. 4—20. Общая структура фосфолипидов.
Природные фосфолипиды являются производными глицерофосфата или сфингозинфосфата, содержащими две жирные кислоты и гидрофильный заместитель, такой, как холин, этаноламин, инозитол или серин. Они служат главными составными частями липопротеинов и клеточных мембран и в большом количестве присутствуют в периферической нервной ткани и головном мозге. Фосфоглицериды обладают общей структурой (рис. 4—20), образующейся путем эстерификации глицерофосфата с двумя длинноцепочечными жирными кислотами и гидрофильным компонентом. Важной особенностью фосфолипидов является их способность взаимодействовать как с гидрофобными, так и с гидрофильными доменами и занимать поверхность раздела между органическими и водными средами. Так, в липопротеинах они выступают в роли связующего звена между белковой частью и транспортируемым нейтральным липидом, а в клеточной мембране они образуют характерный липидный бислой, который ограничивает внутриклеточное пространство.
В плазматической мембране около 60% фосфолипидов приходится на долю фосфатидилхолина, который частично синтезируется в самой мембране путем метилирования фосфатидилинозитола. Фосдатидилинозитол и фосфатидилсерин присутствуют в меньших количествах, причем жирокислотные заместители в разных тканях варьируют по длине и степени насыщенности. Фосдатидилхолины, или лецитины, синтезируются в животных тканях тремя путями. В ходе основного пути, аналогичного таковому для синтеза фосфатидилинозитола, холин фосфорилируется АТФ, образуя фосфохолин. Последний соединяется с ЦТФ, превращаясь в ЦДФ-холин, который реагирует с диацилглицерином в присутствии фосфохолинтрансферазы, образуя фосфатидилхолин. Второй путь синтеза фосфатидилхолина заключается в ацилировании лизофосфатидилхолина (образующегося при гидролизе лецитина фосфолипазой А). Наконец, 3-й путь, имеющий особенное отношение к современным исследованиям гормональных влияний на фосфолипиды мембраны, сводится к последовательному метилированию фосфатидилэтаноламина в клеточной мембране. Эти реакции в схематическом виде представлены на рис. 4—21.
Гормональные влияния на метаболизм фосфолипидов. Стимуляция образования арахидоновой кислоты и синтеза простагландинов.
Многие пептидные гормоны повышают продукцию простагландинов тканью-мишенью, что иногда сопровождается вторичными реакциями сосудов и клеток. Хотя простагландины, по-видимому, не играют роли медиаторов действия пептидных гормонов, но стимуляция этих местно образующихся тканевых гормонов при активации клеток-мишеней составляет важный компонент клеточной реакции на взаимодействие пептидных гормонов с их рецепторами [57]. Простагландины и родственные им простациклины и тромбоксаны быстро синтезируются из полиненасыщенных жирных кислот—предшественников, особенно из арахидоновой кислоты, при стимуляции клеток-мишеней. Ненасыщенные жирные кислоты присутствуют в клетке в виде фосфоглицеридов, которые для того, чтобы превратиться в субстрат для метаболизма в простагландины и другие активные интермедиаты, должны деацилироваться под действием фосфолипаз. На долю арахидоновой кислоты приходится наибольшее количество ненасыщенных жирных кислот в тканевых фосфолипидах; эта кислота подвергается метаболизму в двух основных направлениях, называемых циклооксигеназным и липооксигеназным. Ближайшими продуктами циклооксигеназного пути являются эндоперекиси (ПГG2 и ПГН2), которые превращаются в простагландины (ПГЕ2, ПГF2a и ПГD2) под действием ферментов, носящих общее название простагландинсинтетазы, а также в тромбоксаны (ТКА2 и ТКВ2) и простациклины (ПГI2) под действием соответствующих синтетаз (рис. 4—22). Классификация этих метаболитов эндоперекисей связана со степенью ненасыщенности их жирокислотных предшественников; эйкозатетраеновая кислота превращается в продукты 1-го класса (ПГЕ1, ПГF1a, TKA1 и др.), а арахидоновая кислота—в продукты 2-го класса (ПГЕ2, ПГF2a, ТКА2, ТКВ2 и ПГI2) [58].

Рис. 4—21. Пути биосинтеза фосфатидилхолина.
Тромбоксаны и простациклины также образуются при дальнейшем метаболизме эндоперекисей, появляющихся в ходе циклооксигеназного пути; они представляют собой важные регуляторы взаимодействий тромбоцитов с сосудистой стенкой. Простациклин (ПГI2) в больших количествах продуцируется эндотелиальными и гладкомышечными клетками сосудов, где его образование модулируется гидроперекисными метаболитами липооксигеназного пути [59]. ПГI2 является высокоактивным ингибитором агрегации тромбоцитов, а его продукция в эндотелиальных клетках стимулируется тромбином и тормозится липопротеинами низкой плотности. Имеются также данные, свидетельствующие о возможной роли снижения способности гладкомышечных клеток сосудов продуцировать ПГI2 в развитии атеросклероза.
Позднее обнаруженный липооксигеназный путь обусловливает превращение арахидоновой кислоты в оксижирные кислоты, в том числе в гидропероксиэйкозатетраеновую кислоту (ГПЭТЕ), которая затем разрушаясь превращается в оксиэйкозатетраеновую кислоту (ОЭТЕ). Эти метаболиты липооксигеназного пути играют существенную роль в воспалительных реакциях, в том числе хемотаксисе нейтрофилов и других следствиях активации циклооксигеназы в тромбоцитах и продукции ПГI2 в ткани сосудов. Недавно полученные данные свидетельствуют также о том, что липооксигенированные метаболиты арахидоновой кислоты могут опосредовать действие ГнРГ на высвобождение гормонов гипофизарными гонадотрофами [60].

Рис. 4—22. Образование и метаболизм арахидоновой кислоты. Ненасыщенная жирная кислота, высвобождаемая фосфолипазой А2 из мембранных фосфолипидов, превращается в активные производные в ходе липоксигеназного, циклоксигеназного и простагландинсинтетазного ферментативных процессов.
Любой из перечисленных путей продукции активных метаболитов арахидоновой кислоты зависит от адекватного поступления ненасыщенного жирокислотного предшественника из мембранных фосфолипидов. В настоящее время известно, что многие формы опосредованной рецепторами активации клеток сопровождаются повышением активности связанных с мембранами фосфолипаз, которые катализируют гидролиз эфирных связей в глицерофосфолипидах. Наиболее важна в этом отношении фосфолипаза А2, отщепляющая жирные кислоты во 2-м положении диацилглицерофосфолипидов, которая образует лизофосфолипид и ненасыщенную жирную кислоту, обычно арахидонат. Деацилированный фосфолипид быстро реацилируется за счет переноса активированной СоА жирной кислоты, что легко можно измерить по включению меченой арахидоновой кислоты в фосфолипиды клеток. Этот кругооборот глицерофосфолипида служит источником арахидоновой кислоты для метаболизма по цикло- и липооксигеназному путям (рис. 4—23) и может влиять на проницаемость мембраны и активность других связанных с мембраной ферментов [61].
Активация фосфолипазы А2 зависит от кальция; она происходит при стимуляции клеток надпочечников АКТГ, что приводит к ускорению кругооборота арахидонилфосфатидилинозитола [62]. Этот эффект вызывается также кальциевым ионофором А23187 и может отражать повышение внутриклеточного уровня кальция при действии АКТГ и вторичной стимуляцией фосфолипазы А2 в качестве ранней реакции, сопутствующей АКТГ-рецепторному взаимодействию. Известно, что действие АКТГ на стероидогенез в надпочечниках зависит от кальция, а не только от образования цАМФ. По крайней мере, часть потребностей в кальции для действия АКТГ может быть связана с опосредуемым фосфолипазой A2 кругооборотом мембранных фосфолипидов при активации коры надпочечников.
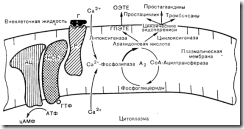
Рис. 4—23. Кругооборот фосфоглицеридов в плазматической мембране с эффектами опосредованного рецепторами (Р) потока кальция на фосфолипазу А2 и продукцию арахидоновой кислоты.
ОЭТЕ — оксиэйкозатетраеновая кислота: Г — гормон; АЦ — аденилатциклаза НСБ — нуклеотид связывающий белок; ГПЭТЕ — гидропероксиэйкозатетраеновая кислота.
Хотя механизм, включающий активацию фосфолипазы, может отражать общее свойство гормонрегулируемых секреторных клеток, при гормональной стимуляции специфических клеток-мишеней меняются и другие этапы метаболизма фосфолипидов. Так, в клетках гранулемы яичника, где ЛГ увеличивает продукцию простагландинов, гормон не повышает образование арахидоновой кислоты, а действует на более поздних этапах, увеличивая активность простагландинсинтетазы [63]. Этот эффект Л Г на синтез простагландинов в граафовом фолликуле (пузырчатый яичниковый фолликул), по-видимому, не опосредует стероидогенного действия гонадотропина, но играет важную роль в развитии овуляции [64].
Стимуляция кругооборота фосфатидилинозитола и образования полифосфоинозитидов.
Инозитоловые фосфолипиды составляют небольшую, но важную часть фосфолипидов плазматической мембраны в большинстве эукариотических клеток. Главным инозитоловым липидом в большинстве клеток является фосфатидилинозитол (ФИ), в котором миоинозитол присоединен к диэфирной фосфатной группе диацилглицеринового скелета. Полифосфоинозитиды (ди- и трифосфоинозитолы), содержащие моно- или дважды фосфатированные гидроксильные группы пнозитола, присутствуют в плазматической мембране в меньших количествах. Инозитоловые фосфолипиды превращаются друг в друга под действием АТФ-зависимых киназ и фосфомоноэстераз и разрушаются фосфодиэстеразами до инозитолфосфатов и диацилглицерина.
Уже в течение нескольких лет известно, что при стимуляции секреторных клеток усиливается метаболизм ФИ с увеличением включения радиоактивного фосфата и инозитола в ФИ и его предшественник фосфатидат. В настоящее время установлено, что эта реакция отражает распад и ресинтез ФИ и, как постулировал Nichell [65], является общим следствием взаимодействия между лигандами и рецепторами клеточной поверхности. Позднее выяснилось, что эта реакция характеризует гормонрецепторные взаимодействия, приводящие к повышению внутриклеточной концентрации кальция.
Реакция ФИ часто не зависит от внеклеточной и внутриклеточной концентрации кальция и представляется общим процессом, сопутствующим активации рецепторов, приводящей к притоку или мобилизации кальция и повышению его концентрации в цитозоле. Отсюда было сделано предположение, что распад ФИ принимает участие в общем механизме, с помощью которого активация рецепторов клеточной поверхности контролирует мобилизацию кальция [65]. Повышение концентрации кальция в цитоплазме могло бы определяться увеличением проницаемости плазматической мембраны или высвобождением кальция из запасов в плазматической мембране или митохондриях. До сих пор в стимулируемых гормонами тканях отмечали отчетливую корреляцию между реакцией ФИ и мобилизацией кальция. В отличие от этого было показано, что некоторые гормоны, которые повышают внутриклеточный уровень цАМФ, но не кальция, практически не влияют на метаболизм фосфоинозитидов. Таким образом, реакция ФИ — это не просто общий ответ клеток на активацию их поверхностных рецепторов, но, по-видимому, характерная особенность стимулов, для которых мобилизация кальция является существенным компонентом реакции клеток-мишеней [65].
Дополнительной особенностью гормонрецепторных взаимодействий, обусловливающих реакцию ФИ, является повышение активности гуанилатциклазы и уровня цГМФ в клетке. Как уже отмечалось, это, вероятно, представляет собой следствие повышения внутриклеточной концентрации кальция, а не необходимый этап процесса активации, который вызывает характерную реакцию клетки-мишени на гормональную стимуляцию. Хотя между реакцией ФИ и мобилизацией кальция при активации многих клеточных рецепторов наверняка существует тесное сопряжение, природа связи между этими процессами пока не ясна. По всей вероятности, опосредование рецепторами кругооборота ФИ происходит в плазматической мембране клетки, в результате чего и увеличивается проницаемость для кальция и/или высвобождение кальция в цитоплазму. Стимулируемый гормоном распад ФИ мог бы являться важным компонентом некоторых механизмов, связанных с активацией рецепторов, вызывая открытие кальциевых каналов на клеточной поверхности, а также модулируя эффекты других рецепторов, которые активируют аденилатциклазу [65].
Другой важный аспект метаболизма ФИ связан с возможной ролью полифосфоинозитидов в действии пептидных гормонов. Эти сильно заряженные липиды подвергаются быстрому метаболическому кругообороту, особенно в головном мозге, и ускоряют свой распад при стимуляции a-адренергических и мускариновых рецепторов. В отличие от реакции ФИ, эти изменения зависят от уровня кальция и могут представлять собой вторичные ответы на повышение его концентрации в цитозоле подобно общему изменению активности гуанилатциклазы [28]. Потенциальная роль полифосфоинозитидов в действии гормонов установлена для коры надпочечников, в которой АКТГ остро повышает содержание дифосфо-и трифосфоинозитидов. Эти эффекты воспроизводятся и цАМФ, причем, как и эффекты АКТГ, они блокируются ингибиторами синтеза белка. Добавление дифосфоинозитида к надпочечниковым митохондриям или изолированным клеткам повышает продукцию прегненолона и кортикостерона, что свидетельствует об опосредующей роли полифосфоинозитидов в стимуляции стероидогенеза в надпочечниках под влиянием АКТГ и цАМФ [66].
Стимуляция метилирования фосфолипидов
Синтез фосфатидилхолина из фосфатидилэтаноламина в клеточной мембране проходит через два последовательных этапа метилирования, осуществляемых путем переноса метильных групп с S-аденозилметионина под контролем двух ферментов, называемых фосфометилтрансферазами I и II. Первый фермент переносит одну метильную группу, образуя фосфатидилмонометилэтаноламин; как субстрат фосфатидилэтаноламин, так и первый метилтрансферазный фермент локализуются на цитоплазматической стороне клеточной мембраны. Второй фермент переносит еще две метильные группы опять-таки с S-аденозилметионина, образуя фосфатидилхолин. Как продукт фосфатидилхолин, так и вторая метилтрансфераза располагаются на наружной поверхности мембраны. Такое асимметричное распределение ферментов и их субстратов способствует быстрому переносу фосфолипидов через плазматическую мембрану в ходе последовательного метилирования [67]. Внутримембранный синтез промежуточного продукта фосфатидилмонометилэтаноламина вызывает резкие изменения текучести мембраны, создавая условия для ускоренного латерального движения собственных мембранных белков. Стимуляция процесса метилирования фосфолипидов в ретикулоцитах под действием b-адренергических агонистов и снижение вязкости мембраны при этом сопровождается демаскированном скрытых b-адренергических рецепторов, ускорением латерального движения рецепторов и усилением сопряжения между рецепторами и аденилатциклазой. Метилирование мембранных фосфолипидов увеличивает число рецепторов некоторых гормонов, в том числе пролактина и ЛГ. К другим мембранным ферментам и процессам, на которые влияют синтез и транслокация метилированных фосфолипидов, относятся кальцийзависимая АТФаза, хемотаксис лейкоцитов, секреция гистамина тучными клетками и митогенез лимфоцитов (рис. 4—24). В клетках астроцитомы стимуляция b-адренергических и бензодиазепиновых рецепторов повышает метилирование фосфолипидов аддитивным образом, что свидетельствует о независимой стимуляции двумя лигандами метилтрансфераз, локализованных в отдельных доменах вблизи соответствующих рецепторов [68].

Рис. 4—24. Механизм действия катехоламинов (КА) на метилирование фосфолипидов и мобильность b-адренергических рецепторов (Р). Предполагают, что повышение текучести мембраны облегчает взаимодействие рецепторов с гуанилнуклеотидсопрягающим фактором (ГНСФ) и аденилатциклазой (АЦ) (Hirata, Axelrod [68]).
КА — катехоламин: МТ — метилтрансфераза: ФХ — фосфатидилхолин: ФЭ — фосфатидилэтаноламин; ФМЭ — фосфатидилмонометилэтаноламин.
Такие вызываемые лигандами изменения в метилировании фосфолипидов и текучести мембраны, по всей вероятности, отражают общий феномен модификации структуры и функции мембраны при многих формах регуляции клеток гормонами и другими агентами. Они могут объяснять также кратковременное увеличение числа рецепторов гомологичного и других гормонов, наблюдаемое после стимуляции клеток-мишеней. Так, ЛГ в семенниках крысы вызывает временное увеличение рецепторов как самого ЛГ, так и пролактина, а АКТГ вызывает начальное повышение числа рецепторов пролактина в надпочечниках. В каждом из этих случаев увеличение числа рецепторов предшествует изученному процессу потери рецепторов, или «снижающей регуляции», который in vivo начинается через несколько часов после взаимодействия лигандов с рецепторами. Степень, в которой повышение текучести мембраны контролирует рецептор-циклазное сопряжение в клетках-мишенях гормонов, пока не известна, но этот механизм может быть важным компонентом регуляции клеточной чувствительности и реактивности к гормональной стимуляции.
СТЕРОИДНЫЕ ГОРМОНЫ
Основные классы стероидных гормонов, секретируемых половыми и надпочечными железами, включают андрогены, эстрогены, прогестины, глюко- и минералокортикоиды. Стадии биосинтеза этих стероидов определяются комплектом ферментов, присутствующих в отдельных стероидогенных клетках-мишенях, а общая скорость синтеза стероидов в каждом случае регулируется одним или несколькими тропными гормонами гипофиза: ЛГ, ФСГ, АКТГ и пролактином.
Типы действия стероидов: роль структуры
Каждая специализированная стероидсекретирующая ткань продуцирует один основной стероид со сравнительно ограниченным спектром действия на ткани-мишени. Поскольку стероидные гормоны образуются в ходе общего биосинтетического пути из холестерина, а их биологические особенности определяются весьма немногочисленными структурными модификациями, не удивительно, что эффекты близких стероидных молекул перекрывают друг друга. Обычно такое перекрывание проявляется лишь при высоких концентрациях гормонов, но может встречаться и при введении их в терапевтических дозах, как, например, сользадерживающее, или минералокортикоидное, действие стероидов (глюкокортикоидов), оказывающих главные эффекты в углеводном обмене. Эти эффекты обусловлены перекрестным реагированием гетерологичного стероида с рецепторами, в норме взаимодействующими с гомологичным лигандом, в данном случае с альдостероном. Поскольку домен биологического действия каждого подвида стероидов прежде всего определяется рецепторами, через которые они оказывают свое действие, и сопряженными процессами активации, то гормональные действия можно было бы наиболее точно классифицировать в соответствии с рецепторами, опосредующими каждый характерный эффект [69]. Все основные стероидные гормоны взаимодействуют со специфическими рецепторами, присутствующими в соответствующей клетке-мишени, но не в других тканях. Гормон-рецепторные комплексы, образующиеся в цитоплазме и, возможно, в ядре, подвергаются активации, а затем связываются с хроматином, регулируя транскрипцию специфических мРНК, которые кодируют ферменты и другие интермедиаты, определяющие характерную реакцию клетки-мишени. Половые стероиды — андрогены, эстрогены и прогестерон — участвуют преимущественно в регуляции роста и функции тканей репродуктивной системы, тогда как надпочечниковые стероиды служат главным образом регуляторами метаболизма, контролируя межуточный обмен и гомеостаз электролитов (табл. 4—5).
Некоторые эффекты стероидных гормонов каждого класса, реализуемые через их специфические рецепторы, определяются прежде всего конформацией их молекул. Как это характерно для всех регуляторных лигандов, в том числе фармакологических веществ и гормонов, проявление активности агониста обусловливается его способностью связываться и активировать специфические рецепторы, которые контролируют последующую метаболическую реакцию (или реакции), меняющуюся под влиянием лиганда. Исходная кольцевая структура стероидных гормонов модифицируется в процессе биосинтеза за счет отщепления боковых цепей, восстановления, гидроксилирования и (в случае эстрогенов) ароматизации кольца А. Структуры природных стероидов, типичные для основных их классов, вместе с синтетическими соединениями, применяемыми с терапевтической целью, приведены на рис. 4—25 [70].
Таблица 4—5. Виды эффектов стероидных гормонов
|
Ткань |
Стероидный гормон |
Эффекты |
|
Семенники |
Андрогены |
Вторичные мужские половые признаки; репродукция: сперматогенез |
|
Яичники: |
||
|
фолликулы |
Эстрогены |
Вторичные женские по |
|
желтое тело |
Прогестин |
ловые признаки; репродукция: беременность |
|
Надпочечники: |
||
|
пучковая зона |
Глюкокортикоиды |
Регуляция метаболизма |
|
клубочковая зона |
Альдостерон |
Гомеостаз натрия |
Роль связывания в плазме
Циркулируя в крови, половые и надпочечниковые стероиды присутствуют в виде свободных гормонов и связанных форм, образующих комплексы с белками плазмы. Хотя секретируемые стероиды в тех низких концентрациях, которые содержатся в плазме (примерно 10~9 M), растворимы в воде, основная масса циркулирующих гормонов транспортируется в виде стероидбелковых комплексов [71]. С белками плазмы связано более 98% половых стероидов, около 90% содержащегося в крови кортизола и около 50% альдостерона. Поскольку на уровне клеток-мишеней активны именно свободные гормоны, роль связывания в плазме может заключаться в создании резервуара или буфера, который контролирует доступность гормона для рецепторов клеток-мишеней. Хотя каждый стероидный гормон может связываться тем или другим белком плазмы, но степень и прочность (или сродство) связывания разных стероидов значительно варьируют. Так, около 40% содержащегося в крови альдостерона слабо связано с сывороточным альбумином, тогда как более 90% кортизола и тестостерона связаны с высоким сродством специфическими белками, называемыми соответственно кортикостероидсвязывающим глобулином (КССГ), или транс-

Рис 4—25. Структура главных классов стероидных гормонов. Лроизводные андрогенов R 1881 и R 2956 носят кодовые номера фармацевтической компании Roussel (Mainwaring [70] в модификации). кортином, и сексгормонсвязывающим глобулином. Последний белок связывает и эстрадиол, хотя в физиологических условиях, вероятно, степень его связывания не слишком велика.
В отношении типичных стероидных гормонов, равно как и в отношении аналогичных гормонов, таких, как витамин D и тироксин, отсутствуют указания на важность роли их связывания в плазме в механизме биологического действия. Как уже отмечалось, именно свободный гормон представляет собой биологически активную фракцию и именно его уровень коррелирует с величиной реакции на гормон. Кроме того, стероиды активны и в отсутствие своих связывающих белков, а синтетические аналоги стероидов, которые обычно не связываются с транспортными белками, сохраняют способность вызывать биологические эффекты в тканях-мишенях за счет взаимодействия со специфическими внутриклеточными рецепторами. Когда в условиях патологии или под влиянием терапевтических мероприятий концентрация связывающих белков повышается или снижается, концентрация свободного стероида остается относительно постоянной, несмотря на изменение общего уровня гормона в крови.
Хотя связывание в плазме, по-видимому, не имеет непосредственного значения для гормонального эффекта (кроме значения в качестве резервуара циркулирующего стероида), оно может, очевидно, оказывать влияние на скорость клиренса крови от секретируемого, инъецируемого или принимаемого внутрь гормона. Связывание с белками плазмы может также служить буфером, сводящим к минимуму влияние эпизодической секреции гормона на концентрацию свободного стероида, поступающего к клетке-мишени. При лечении стероидными гормонами связывание с транспортными белками плазмы могло бы снижать скорость метаболизма вводимого стероида и создавать резервуар, из которого постепенно освобождается свободный гормон. Степень, в которой эти эффекты связывания в плазме влияют на продолжительность и интенсивность реакций на отдельные стероиды, не ясна, но она могла бы иметь очевидное значение для фармакокинетики стероидных препаратов [69]. Связывание с альбумином не снижает доступности стероидных гормонов для головного мозга, тогда как гормон, связанный с глобулинами, не транспортируется в мозг. Таким образом, доля содержащегося в плазме гормона, которая может транспортироваться в головной мозг, не ограничивается свободной фракцией, а включает и более крупные, связанные с альбумином, комплексы [72]. В крысиной плазме эта доля могла бы составлять 60% прогестерона, 40% тестостерона и 15% кортикостероидов, тогда как свободные фракции этих гормонов в плазме колеблются в пределах 2—8%.
Другой физиологически важный аспект связывания стероидов с белками плазмы заключается в значении избирательности этого процесса для действия альдостерона на его специфические минералокортикоидные рецепторы в почках. Поскольку главные участки связывания альдостерона в почках обнаруживают также высо- кое сродство к дезоксикортикостерону (ДОК) и меньшее, но отчетливое, сродство к кортизолу, эти стероиды могли бы, очевидно, занимать почечные рецепторы, так как их концентрации в крови близки (ДОК) или на несколько порядков выше (кортизол), чем концентрация альдостерона. Однако более 90% ДОК и кортизола, присутствующих в крови, связаны с альбумином и КССГ, тогда как только 40% альдостерона в циркуляции связано с альбумином. В связи с этим ДОК и глюкокортикоиды конкурируют за рецепторы альдостерона in vivo много слабее, чем in vitro в условиях отсутствия плазмы (например, для ДОК 1—5% против 80%). Без избирательности связывания ДОК и глюкокортикоидов в плазме альдостерон не мог бы насыщать минералокортикоидные рецепторы и оказывать характерное регулирующее действие на гомеостаз натрия. Этим способом связывание в плазме способствует предотвращению связывания «неадекватных» стероидов (таких, как ДОК, кортикостерон и кортизол, которые могут действовать как минералокортикоиды, но секретируются под контролем АКТГ) с обладающими высоким сродством л низкой емкостью рецепторными участками в клетках-мишенях минералокортикоидов [73].
Следует отметить, что циркулирующие в крови стероидсвязывающие белки в некоторых отношениях отличаются от внутриклеточных рецепторов стероидов, опосредующих реакцию клетки-мишени. С физической точки зрения, связывающие белки плазмы — это относительно стабильные, растворимые глобулярные гликопротеины, тогда как рецепторы асимметричны, сравнительно более гидрофобны и менее стабильны. С функциональной же стороны, транспортные белки связывают преимущественно природные стероидные молекулы и хуже (или вообще не связывают) более активные синтетические аналоги. Рецепторные же молекулы, напротив, связывают как природные, так и синтетические стероиды (или их метаболиты) соответственно их биологической активности.
Поглощение стероидов клетками-мишенями
Если не считать поглощения холестерина, который проникает в клетку в ходе опосредованного рецепторами эндоцитоза липопротеинов плазмы [23], существует мало данных, свидетельствующих о существовании механизмов транспорта, контролирующих поглощение стероидных гормонов клетками. Более того, принято считать, что стероиды свободно и быстро диффундируют через клеточную мембрану, которая, по-видимому, не ограничивает доступности стероидов для цитоплазматических рецепторных участков. Хотя большинство имеющихся данных свидетельствует о том, что поглощение стероидов действительно не зависит от мембранных барьеров или процессов транспорта, можно привести некоторые примеры действия стероидов на мембранные процессы, указывающие на возможность участия более сложных механизмов, чем простая диффузия, в проникновении стероидных гормонов в клетку Так, влияние прогестерона на дифференцировку ооцитов лягушки? начинается именно с наружной поверхности клеточной мембраны [74], где инициируется реакция мейотического созревания. Эта способность прогестерона взаимодействовать с мембраной ооцита [75] равно, как и другие признаки взаимодействия стероидов с поверхностью клеток-мишеней [76], свидетельствуют о том, что не следовало бы пренебрегать ролью плазматической мембраны в процессах поглощения клеткой и действия стероидных гормонов.
Рецепторы стероидов
На способность стероидных гормонов регулировать ядерные процессы вначале указывали данные об увеличении синтеза РНК в матке [77] и предстательной железе [77] под влиянием соответственно эстрогенов и андрогенов. Впоследствии было показано, что все классы стероидных гормонов после введения их с тритиевой меткой накапливаются в ядрах соответствующих клеток-мишеней. Так, было обнаружено, что меченые эстрогены концентрируются в женских репродуктивных тканях, которые характеризуются высоким содержанием цитоплазматических рецепторов эстрадиола в. отличие от малого их количества, присутствующего в других тканях [79]. Рецепторы эстрогенов локализуются преимущественно в цитозоле матки кастрированных или неполовозрелых крыс, а после воздействия эстрогенов in vivo или in vitro транслоцируются в ядро [80]. Б дальнейшем оказалось, что стероиды всех классов вначале связываются со специфическими цитоплазматическими рецепторами, которые подвергаются активации и транслокации в ядро.
Цитоплазматические рецепторы эстрогенов при центрифугировании в градиенте плотности в присутствии 0,4 М КС1 обнаруживают свойства 4S белка, который при активации и транслокации в ядро превращается в 58-форму. Способность антиэстрогенов, таких, как кломифен и нафоксидин, снижать поглощение эстрогенов и сопутствующую этому реакцию роста матки указывает на значение рецепторного связывания в качестве раннего этапа действия эстрогенов. Известно, что рецепторы эстрогенов, первоначально-идентифицированные в цитозоле матки как белки с константой седиментации в низкосолевой среде 8—9S, при внутриклеточных условиях ионной силы существуют в 4S-форме [80]. При воздействии эстрогенов и нагревании цитозольные 4S-рецепторы превращаются в 5S-форму, обнаруживающую выраженное сродство к изолированным ядрам и хроматину. Природа 4S—5S превращения не ясна, но этот процесс зависит, по-видимому, не просто от конформационного изменения, а предполагает какую-то форму вызываемой гормоном димеризации [81]. Такой же тип цитоплазматических рецепторов и процесса транслокации в ядро наблюдали во многих эстрогензависимых тканях, в том числе в передней доле гипофиза и опухоли молочной железы. Ткань гормонзависимого рака молочной железы человека поглощает больше эстрогенов, чем ткань автономных опухолей, и содержание рецепторов эстрогенов в раковой ткани можно использовать для прогнозирования последующей реакции на кастрацию у больных с далеко зашедшим раком молочной железы.
Очистка цитозольных и ядерных эстрогенрецепторных комплексов вызывала большие трудности из-за их нестабильности и склонности к агрегированию. Однако цитозольные рецепторы стабилизируются в присутствии кальция и при низкой или высокой концентрации соли приобретают свойства 4,5S-форм. Ядерные эстрадиолрецепторные комплексы в процессе очистки теряют склонность к агрегированию и были выделены в виде 4,8S-белка с молекулярной массой 66000. Позднее с помощью иммунизации кроликов, коз и мышей очищенными препаратами ядерных рецепторов эстрадиола из матки телок были получены антитела к рецепторам эстрогенов. Эти антитела давали перекрестную реакцию с рецепторами из эстрогенчувствительных тканей и опухолей животных нескольких видов [82]. Одной из многих возможных областей применения таких антител является разработка иммунохимических методов определения рецепторов эстрогенов в тканях-мишенях, включая рак молочной железы у человека, для оценки их дстрогенной зависимости.
Рецепторы прогестерона присутствуют в женских репродуктивных тканях, в том числе яйцеводах, матке и влагалище, и охарактеризованы как 6,5—8S-цитозольные компоненты, которые диссоциируют на 4S-форму в присутствии соли, подобно рецепторам эстрогенов. Эстрогены оказывают выраженное влияние на характер и число прогестероновых рецепторов. Комплексы прогестерона с рецепторами из матки нестимулированных крыс седиментируют при низкой ионной силе с константой 4—5S, а после воздействия эстрогенов превращаются в более крупные компоненты (6,5—8S),[83]. Кроме того, в ходе эстрального цикла в проэструсе преобладают крупные цитозольные формы (6,7S), а в диэструсе — меньшие (4, 5S) формы, что согласуется с эффектами вводимых эстрогенов. Концентрация прогестероновых рецепторов в репродуктивных тканях под влиянием эстрогенов заметно повышается. Число связывающих мест в матке животных достигает максимума в проэструсе, а у человека в гиперпластическом эндометрии выше, чем во время пролиферативной и секреторной фаз менструального цикла.
Свойства прогестероновых рецепторов интенсивно изучались на яйцеводах незрелых цыплят, в которых эстрогены способствуют дифференцировке клеток канальцевых желез, секретирующих крупные протеины яичного белка, овальбумин, кональбумин и ли-зоцим, и стимулируют образование прогестероновых рецепторов. После элиминации эстрогенов синтез овальбумина прекращается, но может возобновляться после воздействия либо эстрогенами, либо прогестероном. Воздействие прогестероном вызывает также дифференцировку эпителия в бокаловидные клетки, синтезирующие авидин — белок яйцеводов, с чрезвычайно высоким сродством связывающий биотин. Цитоплазматические прогестероновые рецепторы седиментируют как 3,8S-комплексы и в присутствии прогестерона подвергаются транслокации в ядро в ходе зависимого от температуры процесса. Ядерные прогестеронрецепторные комплексы представляют собой 4S-белки, аналогичные таковым в цитозоле, и не обнаруживают изменения седиментационных свойств, что характерно для ядерных эстрогеновых рецепторов, которые в процессе активации и транслокации превращаются из 4S в 5S-форму. Цитозольный 8S-рецептор прогестерона был очищен и разделен на два 4S-компонента с молекулярными массами 110000 (А) и 117 000 (В). Было установлено, что компонент В специфически связывается с хроматином клеток яйцеводов и может определять специфичность тканевого связывания активированного прогестеронового рецептора [84].
Рецепторы андрогенов были идентифицированы в мужских половых органах и акцессорных половых тканях в исследованиях по связыванию меченных тритием тестостерона и дигидротестостерона. Рецепторы андрогенов, присутствующие в цитозоле предстательной железы, семенных пузырьков и других мужских тканей, седиментируют как 8—9S-формы при низкой ионной силе и как 4S-формы в присутствии соли. Подобно рецепторам эстрогенов и прогестерона, цитоплазматические андрогенрецепторные комплексы подвергаются зависимой от температуры транслокации в ядро, откуда их можно экстрагировать в виде 3S-формы [85]. Важной особенностью андрогенрецепторной системы в мужских акцессорных половых тканях является необходимость превращения тестостерона в дигидротестостерон, предшествующего связыванию с рецептором и его транслокации. Таким образом, 3S-ядерный андрогенрецепторный комплекс в этих тканях содержит не тестостерон, а дигидротестостерон, образующийся под действием 5a-редуктазы до связывания с цитоплазматическими рецепторами. Необходимость ферментативного превращения андрогенных гормонов в дигидротестостерон для активации рецепторов во многих мужских тканях-мишенях имеет отношение к некоторым формам генетически детерминированной резистентности к андрогенам. Синдром тестикулярной феминизации — крайняя форма мужского псевдогермафродитизма может обусловливаться как нарушением синтеза дигидротестостерона, так и рецепторным дефектом при действии андрогенов.
Сходный синдром у грызунов (Tfm) определяется дефектом андрогеновых рецепторов, а не нарушением восстановления тестостерона в дигидротестостерон [86].
Глюкокортикоидные рецепторы первоначально были обнаружены в печеночных и лимфоидных клетках, а в настоящее время открыты в большинстве тканей млекопитающих, что согласуется с представлением о широко распространенном регуляторном влиянии кортизола и родственных кортикостероидов. В отсутствие стероида рецепторы нестабильны и проявляют высокое сродство и стереоспецифичность к природным глюкокортикоидам и их активным синтетическим аналогам, таким, как дексаметазон и триамсинолон. Подобно другим стероидрецепторным комплексам, глюкодюртикоид-рецепторный комплекс подвергается быстрой температурной активации с приобретением способности транслоцироваться в ядро и связываться с хроматином. Глюкокортикоид-рецепторные комплексы седиментируют как 7S-формы при низкой ионной силе и превращаются в 48-форму при высокой ионной силе. Активация стероидрецепторного комплекса не изменяет его седиментационных свойств, но вызывает снижение изоэлектрической точки, что обусловливает изменение подвижности на ионообменных средах (фосфоцеллюлозе и ДЭАЭ-целлюлозе), а также повышение сродства к ДНК и хроматину [87]. Такие изменения ионных свойств позволяют разделять активированные и неактивированные комплексы на ДЭАЭ-целлюлозе. Анализ цитозоля клеток вилочковой железы с помощью этой методики показал, что неактивированные комплексы присутствуют только в 1-ю минуту после воздействия дексаметазоном, а в течение следующих нескольких минут быстро превращаются в активированные [88].
Альдостероновые рецепторы были обнаружены в тканях-мишенях минералокортикоидов, таких, как почки, мочевой пузырь, околоушная железа и кишечник. В секреторном эпителии такие рецепторы крайне лабильны и с трудом поддаются анализу, причем их изучение осложняется присутствием в тканях-мишенях других рецепторов для структурно и биологически сходных глюкокортикоидов [89]. Сравнительное сродство двух классов рецепторов к альдостерону и глюкокортикоидам таково, что альдостерон в низких и физиологических концентрациях преимущественно связывается с I (минералокортикоидным) типом связывающих мест, а в более высоких концентрациях со все большим количеством глюкокортикоидных рецепторов. И наоборот, глюкокортикоиды в физиологических концентрациях лишены минералокортикоидной активности, но в сверхфизиологических количествах (эндо- или экзогенных) связываются с I типом рецепторов и оказывают сользадерживающее действие [73]. При исследовании с помощью методики, позволяющей нивелировать вмешательство глюкокортикоидных рецепторов, оказалось, что альдостероновые рецепторы связывают минералокортикоиды в соответствии с их биологической активностью и реагируют с кортизолом (при достаточно высокой концентрации последнего), равно как и с более активными сользадерживающими стероидами — альдостероном и дезоксикортикостероном, Главные цитоплазматические альдостеронрецепторные комплексы седиментируют как 8,5S-формы при низкой ионной силе и как 4S-формы при высокой ионной силе [90]. Ядерные рецепторы, экстрагированные 0,3 М КСl, также седиментируют как 48-формы и подвергаются максимальной транслокации из цитозоля через 10 мин после инъекции альдостерона.

Рис. 4—26. Диаграмма этапов действия стероидных гормонов. Активация внутриклеточных рецепторов стероидными гормонами сменяется ядерным связыванием комплекса и стимуляцией синтеза мРНК (Baxter, McLeod [69] в модификации). С — стероид, Р — рецептор.
Влияние стероидов на рецептор: активация и связывание ядром
Стероидные гормоны любого из основных классов, включающих эстрогены, прогестины, андрогены, глюкокортикоиды и минералокортикоиды, действуют в соответствии с общей схемой, т. е. связываются со специфическими цитоплазматическими белками, или рецепторами, после чего происходит активация комплекса и транслокация его в ядро. Здесь связывание комплекса ядерными акцепторными участками хроматина клеток-мишеней модулирует активность специфических генов, ответственных за синтез определенных видов мРНК (рис. 4—26). Как уже отмечалось, любые цитозольные комплексы стероида с рецептором подвергаются индуцируемой гормоном конверсии, называемой активацией рецептора, которая вызывает их накопление и связывание в ядре.
Процесс активации рецептора индуцируется гормоном и зависит от температуры; он включает обычно изменение кажущейся молекулярной массы, заряда или конформации комплекса. Однако не существует постоянных изменений, которые характеризовали бы процесс активации применительно ко всем классам стероидных гормонов. Увеличение скорости седиментации с 4 до 5S обнаруживают только эстрогеновые рецепторы. Андрогенрецепторные и некоторые прогестеронрецепторные комплексы после активации снижают скорость седиментации, а глюкокортикоидные рецепторы не изменяют ее, но обнаруживают изменение заряда. Хотя процесс «активации» рецепторов стероидных гормонов необходим для ядерного связывания и действия, он варьирует для отдельных стероидных рецепторов, и общая его основа остается неясной.
Агонисты и антагонисты стероидов
Как и многие другие типы биологически активных лигандов, будь то лекарственные вещества, трансмиттеры или гормоны, стероидные гормоны и их производные можно разделить на агонисты, антагонисты и неактивные соединения. Активность агонистов пропорциональна сродству их связывания с рецепторами и эффективности активации биологической реакции гормонрецепторным комплексом. Антагонисты также обнаруживают высокое сродство к рецептору, но не связываются с ядром или не обладают способностью активировать ядерные процессы. Аллостерическая модель действия стероидных агонистов и антагонистов на конформацию и активность рецепторов приведена на рис. 4—27. Важно подчеркнуть, что различия между агонистами и антагонистами редко бывают абсолютными и что многие соединения действуют как частичные агонисты (или частичные антагонисты), связываясь с рецепторами и, даже при полном насыщении рецепторных участков, не вызывая максимальной реакции. «Чистые» агонисты могут быть «слабыми» или «сильными» в зависимости от их сродства к рецепторам, но они не действуют как антагонисты. Так, «слабые» агонисты могут вызывать ту же биологическую реакцию, что и «сильные», если присутствуют в концентрации, достаточно высокой, чтобы насытить ту же самую долю рецепторов. В отличие от этого, частичные агонисты не могут вызвать полную реакцию, даже насыщая большинство или все рецепторы, и затем могут оказывать антагонистическое влияние или блокировать эффекты добавляемых соединений-агонистов. Частичные агонисты можно рассматривать как вещества, занимающие определенное место в спектре активности между чистыми агонистами и чистыми антагонистами. Для большинства клинических и экспериментальных целей лучше пользоваться чистыми агонистами и антагонистами. Однако многие антагонисты обладают некоторой степенью активности агониста, что необходимо учитывать при их применении для лечения и при анализе рецепторного связывания. Следует отметить также, что если активность данных агонистов в различных тканях относительно постоянна, то частичные агонисты и антагонисты могут проявлять непостоянную агонистическую и антагонистическую активность в отдельных тканях-мишенях или в разных экспериментальных условиях [69].

Рис. 4—27. Аллостерическая модель взаимодействий стероидного лиганда с рецептором. Рецептор включает как стероидсвязывающий (ССУ),. так и функциональный участок (ФУ), необходимые для проявления биологической активности, и может существовать в неактивной или активной конфигурации (Mainwaring [70] в модификации).
Антагонисты эстрогенов
Некоторые нестероидные аналоги эстрогенов, такие, как нафоксидин и тамоксифен, препятствуют проявлению вызываемых эстрогенами реакций: роста матки и гиперплазии клеток-мишеней. Такие вещества связываются с цитоплазматическими эстрогеновыми рецепторами и стимулируют транслокацию антагонистрецепторного комплекса в ядро. Здесь комплекс связывается с хроматином и задерживается на длительный период, вызывая начальную стимуляцию РНК-полимеразы и клеточной гипертрофии. Однако связывание антагонист-рецепторного комплекса не сменяется последующим восстановлением числа цитозольных рецепторов, будь то за счет повторных циклов или ресинтеза их, что наблюдается после транслокации рецепторов под действием эстрогеновых агонистов [91].
Антагонисты андрогенов
Наиболее активным природным антиандрогеном является прогестерон, и некоторые из наиболее мощных антагонистов андрогенов представляют собой активные прогестиновые производные. Антиандрогены противодействуют эффектам тестостерона или дигидротестостерона, конкурируя за андрогенсвязывающие участки рецепторов, присутствующих в андрогензависимых тканях-мишенях. Такие соединения имеют потенциальную значимость в лечении гирсутизма и других маскулинизирующих синдромов, а также в лечении гиперплазии и рака предстательной железы. Высокоактивные прогестиновые антиандрогены, такие, как ципротерон-ацетат, взаимодействуют с андрогеновыми, равно как и с прогестероновыми, рецепторами. Однако не все прогестины являются антагонистами андрогенов, а хломадинон-ацетат обладает относительно низкой антиандрогенной активностью, несмотря на его близкое структурное сходство с ципротерон-ацетатом. Присутствие циклопропа-новой группы в кольце А ципротерон-ацетата является основным структурным отличием его от хломадинон-ацетата и может играть важную роль в определении антиандрогенной активности [92а]. Некоторые антиандрогены подавляют также гонадотропную секрецию с последующим снижением продукции тестостерона, равно как и блокадой действия андрогенов. Медроксипрогестерон угнетает и активность 5a-редуктазы, нарушая тем самым образование ДГТ. Важно отметить, что некоторые прогестиновые антиандрогены обладают и другими видами гормональной активности, например ципротерон-ацетат проявляет не только андрогенные, но и антиэстрогенные и антигонадотропные свойства. Кроме того, длительное лечение ципротероном для достижения антиандрогенного эффекта может приводить к подавлению функции надпочечников за счет торможения секреции АКТГ, вероятно, через центральные механизмы высвобождения кортикотропина. Спиронолактон также взаимодействует с эстрогеновыми и андрогеновыми рецепторами, равно как и с рецепторами альдостерона, и может оказывать эстрогенные и антиандрогенные влияния, в том числе-появление гинекомастии и потерю либидо. К нестероидным антагонистам андрогенов относится флутамид, который не обладает гормональной активностью, а по своим антиандрогенным свойствам сходен с ципротерон-ацетатом. Подобно прогестинам, флутамид в тканях-мишенях угнетает поглощение и задержку в ядрах андрогенов, конкурируя за связывание с их цитозольными рецепторами.
Антагонисты глюкокортикоидов
Б настоящее время не существует клинически применимого антагониста глюкокортикоидных эффектов, поскольку увеличение секреции АКТГ быстро преодолевает действие блокады этих эффектов за счет повышения секреции кортизола надпочечниками. Однако некоторые стероиды проявляют частичную или тканезависимую способность к конкурентному торможению действия кортизола и родственных глюкокортикоидов. Большинство глюкокортикоидов обладает аксиальной 11 b-гидроксильной группой, которая может играть важную роль в связывании и активации рецептора [92а]. Такие стероиды, как кортизон и кортексолон (11-дезоксикортизол или соединение S) и производные прогестерона, связываются с глюкокортикоидными рецепторами, но практически не обладают собственной глюкокортикоидной биологической активностью. Эти соединения могут действовать как частичные агонисты или антагонисты, особенно in vitro, когда они не метаболизируются дальше в глюкокортикоиды. In vivo последний процесс может препятствовать проявлению полного антиглюкокортикоидного действия таких стероидов, за исключением неметаболизируемых соединений, таких, как ципротерон-ацетат и позднее полученные антагонисты [93].
Антагонисты минералокортикоидов
Такие соединения, как спиронолактон, действуют в качестве антагонистов альдостерона, конкурентно ингибируя связывание последнего с минералокортикоидными рецепторами и образуя антагонист-рецепторный комплекс, не подвергающийся транслокации и связыванию в ядре. Эти антагонист-рецепторные комплексы по седиментационным свойствам отличаются от альдостерон-рецепторного комплекса, что может отражать неактивное состояние рецептора или изменение конформации, вызываемое связыванием антагониста [94]. Помимо описанных эффектов, спиронолактон в высоких дозах угнетает биосинтез альдостерона, оказывая тем самым дополнительное антиминералокортикоидное действие.
К другим соединениям, взаимодействующим с минералокортикоидными рецепторами, относятся нестероидные агенты, такие, как противовоспалительные средства (например, фенилбутазон) и глицирретиновая кислота. Эти агенты конкурируют за связывание с почечными рецепторами и вызывают задержку натрия и другие стероидные эффекты. Таким образом, взаимодействие таких соединений-агонистов с альдостероновыми рецепторами может приводить к развитию реакции клеток-мишеней предположительно за счет того же ядерного механизма, который опосредует эффекты эндогенных минералокортикоидов на транспорт электролитов.
Связывание стероидных рецепторов в ядрах
Для проявления биологических эффектов стероидных гормонов необходимо взаимодействие активированных цитоплазматических гормонрецепторных комплексов с ядрами клеток-мишеней. Активированный стероидрецепторный комплекс приобретает способность связываться с хроматином, равно как и с ДНК и другими полианионами, и накапливаться в ядре. Данные о присутствии в ядре, так же как в цитоплазме нестимулированных клеток свободных эстрогеновых рецепторов, свидетельствуют о том, что они могут распределяться по всей клетке-мишени, несмотря на зависимость их накопления в ядре от превращения в активированную хроматинсвязывающую форму со сдвигом равновесия между распределением в ядре и вне его [81].
В ядре активированные комплексы связываются с акцепторными участками хроматина и инициируют синтез специфических мРНК и белков [95]. Точная природа ядерных акцепторных участков не известна, но о значении ДНК в реакции свидетельствует способность ДНКазы препятствовать связыванию стероидрецепторных комплексов с ядрами и высвобождать из ядра ранее связанные комплексы. Хроматин из ядер клеток-мишеней андрогенов и прогестерона связывает больше гормонрецепторных комплексов, чем хроматин из тканей, не реагирующих на эти стероиды. Подобно этому, рецепторы, выделенные из клеток некоторых резистентных к глюкокортикоидам лимфом, обладают сниженным сродством к ядрам и ДНК. Связывание комплексов с ДНК определяется, по-видимому, ионными взаимодействиями между положительно заряженным участком молекулы рецептора и отрицательно заряженными фосфатными группами ДНК, а также неионными силами. Считают, что ДНК-связывающий участок рецепторной молекулы содержит лизиновый, аргининовый и гистидиновый остатки и изменяется под влиянием агентов, действующих на сульфгидрильные группы.
По крайней мере один из видов рецепторных молекул (для прогестерона) состоит из двух субъединиц: одной (А), обладающей неспецифическим связывающим сродством к ДНК, и второй (В), имеющей специфическое сродство к хроматину клеток яйцеводов. Избирательное. связывание прогестерон-рецепторных комплексов определяется взаимодействием В-субъединицы с особой фракцией негистоновых белков хроматина, которая может обусловливать тканевую специфичность действия прогестерона. Такой двойной процесс связывания мог бы повышать матричную активность хроматина, обеспечивая доступность мест инициации синтеза авидиновой и других мРНК, кодирующих белки яйцевода [84].
Несмотря на эти данные о значении связывания с ДНК и хроматином для ядерных эффектов стероидных гормонов, все же остаются сомнения относительно природы акцепторных участков и роли большинства процессов связывания, наблюдаемых в ядре. Эстрадиолрецепторный комплекс можно экстрагировать из ядер матки в комбинации с рибонуклеопротеидом, а активированные стероидрецепторные комплексы прочно связаны с ядерными гистонами и основными негистоновыми белками ядра. Таким образом, как ядерные белки, так и ДНК, по-видимому, принимают участие в процессе связывания хроматином, который протекает, очевидно, как в нуклеосомах, так и в промежуточных участках хроматина, доступных для нуклеазного переваривания [96]. Кроме того, специфическое связывание эстрогенов и андрогенов обнаружено в бесхроматиновом ядерном матриксе тканей-мишеней половых гормонов: в областях репликации ДНК, а также процессинга и транспорта ядерных РНК (яРНК) [97].
Высокую связывающую емкость ядра по отношению к гормон-рецепторным комплексам трудно согласовать с представлением о том, что активированные комплексы связываются с ограниченным числом ядерных акцепторных мест, регулируя лишь несколько специфических генов. Действительно, насыщение ядерных мест гормонрецепторными комплексами наблюдается не всегда, и при стимуляции физиологическими концентрациями гормона транслокации может подвергаться до 10 000 комплексов. Эти данные свидетельствуют о связывании транспонированных гормонрецепторных комплексов со многими ядерными участками, обладающими низким сродством, что маскирует взаимодействие с небольшим числом акцепторных мест, определяющее регуляцию генов [81]. Тем не менее линейные корреляции между биологическими реакциями (такими, как синтез мРНК) и насыщенностью рецепторов удается наблюдать вплоть до нескольких тысяч рецепторов в одном ядре [69].
Влияние гормонрецепторных комплексов на хроматин
После этапа активации, обусловливаемого взаимодействием стероидных гормонов с их специфическими внутриклеточными рецепторными белками, гормонрецепторные комплексы приобретают способность быстро связываться с хроматином и влиять на транскрипцию специфических молекул мРНК. Отдельные белки, синтез которых, как было установлено, индуцируется действием стероидных гормонов на образование яРНК, перечислены в табл. 4—6.
По всей вероятности, будет показано, что многие другие белки, о которых известно, что на их содержание влияют стероидные гормоны, также регулируются через первичное действие гормонрецепторных комплексов на транскрипцию генов и скорость образования мРНК.
Таблица 4—6. Специфические белки, регулируемые стероидными гормонами через контроль синтеза мРНК
|
Стероидные гормоны |
Белок |
|
Эстрогены |
Овальбумип |
|
Кональбумин |
|
|
Апо-ЛПОНП |
|
|
Вителлогепии |
|
|
Пролактин |
|
|
Прогестерон |
Авидин |
|
Утероглобин |
|
|
a2a-глобулин |
|
|
Альдолаза |
|
|
Глюкокортикоиды |
Тирозинаминотрансфераза |
|
Триптофаноксигеназа |
|
|
Глутаминсиитетаза |
|
|
Гормон роста |
|
|
Кортикотропин |
|
|
Вирус опухоли молочной железы |
Известны многие другие зависимые от стероидных гормонов белки (например, субстрат ренина, тироксинсвязывающий глобулин, кортикостероидсвязывающий глобулин), но уровень регуляции их продукции пока не установлен прямыми определениями образования мРНК при действии гормонов [1].
Точный механизм регуляции экспрессии специфических генов все еще изучается, но недавно были начаты исследования структуры и функции генов с целью определения главных стадий этого процесса. Большинство соответствующих сведений было получено при изучении влияния эстрогенов на синтез РНК и белка в двух тканях-мишенях: незрелой матке крыс [80] и яйцеводах цыплят [95]. При первичной стимуляции этих тканей эстрогенами в течение фазы клеточного роста и дифференцировки происходит синтез ДНК, всех видов РНК и многих белков [98]. В матке ранней реакцией на эстроген является синтез мРНК, кодирующей характерный «индуцированный белок» [99]. В яйцеводе цыпленка начальная реакция пролиферации клеток трубчатых желез сопровождается синтезом нескольких протеинов яичного белка, главным компонентом которых является овальбумин. После регресса первичной реакции на эстроген повторное воздействие эстрогеном или прогестероном вызывает в яйцеводе быстрое увеличение продукции мРНК, контролирующих синтез специфических «экспортируемых» белков, в том числе овальбумина и кональбумина. Скорость синтеза овальбуминовой мРНК, регистрируемая либо путем трансляции in vitro, либо с помощью гибридизации с комплементарной ДНК (кДНК), после введения эстрогена быстро увеличивается и тесно коррелирует со скоростью синтеза овальбумина. После отмены эстрогена число молекул овальбуминовой мРНК быстро уменьшается, что согласуется с представлением о необходимости присутствия эстрогенов для продолжения транскрипции мРНК на матрице овальбуминового гена [1, 95].
Эти, а также аналогичные данные об эффектах андрогенов и глюкокортикоидов in vivo и in vitro, подтверждают предположение о том, что стероидные гормоны действуют путем повышения синтеза специфических мРНК, исчезающих после удаления индуцирующего гормона. В некоторых случаях повышенный синтез мРНК снижается при добавлении второго гормона, ингибирующего действие первого, что наблюдается при добавлении антагонистов эстрогенов или андрогенов. Хотя эффекты стероидных гормонов заключаются обычно в увеличении скорости синтеза мРНК, но бывают случаи, когда гормональное воздействие приводит к «выключению» специфических мРНК, как это происходит, например, при ингибиторном действии глюкокортикоидов на синтез и секрецию АКТГ клетками передней доли гипофиза. Здесь уровень специфического 31 К-предшественника кортикотропина и b-липопротеина увеличивается после адреналэктомии и снижается при действии глюкокортикоидов, что свидетельствует о регуляции ими скорости образования молекул мРНК предшественника [100]. Аналогичный эффект глюкокортикоидов наблюдается в культуре клеток опухоли гипофиза, хотя острое подавление секреции АКТГ под действием глюкокортикоидов представляется слишком быстрым, чтобы быть обусловленным только снижением синтеза мРНК [101]. За исключением этой формы ингибиторного контроля, которая, вероятно, имеет общее значение для эффектов стероидных и тиреоидных гормонов по механизму обратной связи на секрецию соответствующих тропных гормонов, большинство воздействий стероидных гормонов на синтез белка первично реализуется, по-видимому, через дерепрессию специфических генов. Полный эффект гормон-рецепторных комплексов в ядрах клеток-мишеней включает, вероятно, несколько аспектов синтеза и процессинга РНК с главным влиянием на повышение синтеза РНК [81].
Гормонрецепторные комплексы оказывают прямое воздействие на активность РНК-полимеразы в изолированных ядрах, а также на матричную функцию хроматина клеток-мишеней. Эстрогены и андрогены стимулируют активность ядрышковой [I] и нуклеоплазменной [II] РНК-полимераз в соответствующих клетках-мишенях (матке и предстательной железе), а прогестеронрецепторные комплексы повышают матричную активность хроматина из яйцеводов цыплят, но не из тканей, не являющихся мишенями для прогестерона. Эти данные позволяют считать, что системы синтеза и процессинга РНК в гормонзависимых тканях и опухолях в отсутствие гормона ограничиваются или подавляются, отчасти за счет ограничения матричной функции хроматина, и что гормонрецепторные комплексы снимают это ингибирование. Поскольку пры стимуляции ткани, например эстрогенами, в клетках-мишенях синтезируется огромное количество белков, следует полагать, что в трофических эффектах гормонов должны принимать участие многие гормонрецепторные комплексы, даже если экспрессия генов главных секретируемых белков зависит от активации очень небольшого числа участков генома.
Накопление мРНК при действии стероидных гормонов могло бы определяться как прямыми быстрыми влияниями на транскрипцию" так и вторичными эффектами белков, образующихся вследствие начальной стимуляции синтеза мРНК. Так, влияние экдизона на хроматин слюнных желез насекомых заключается в индукции кратковременных вздутий (пуффов) на хромосомах, которые представляют собой активные гены, причем синтез белка необходим для образования поздних, но не ранних пуффов [102а]. Экдизон локализуется в специальных участках политопных хромосом, реагирующих образованием пуффов. Удаление стероида приводит к регрессии ранних, но не поздних пуффов. Это свидетельствует о том, что ранние эффекты стероида включают синтез белка,, индуцирующего поздние пуффы. Гормональные влияния на накопление мРНК могли бы опосредоваться и изменениями в скорости-их деградации, как это видно, например, по гораздо более длительному периоду полужизни овальбуминовой мРНК в яйцеводах получавших эстроген цыплят, чем у цыплят, лишенных эстрогенов. Таким образом, эффекты стероидрецепторных комплексов могли бы включать индукцию белка, увеличивающего стабильность мРНК, равно как и первичное действие, сводящееся к повышению синтеза мРНК. Быстрый прогресс представлений о структуре в организации гена обнаружил неожиданную сложность основных транскрипционных единиц в эукариотических клетках, а также процессинга мРНК, образующейся под влиянием стероидных гормонов и других регуляторов генов.
Структура гена и процессинг продуктов транскрипции (мРНК)
Известно, что между транскрипцией РНК на матрице ДНК и появлением транслируемой мРНК в цитоплазме существует несколько стадий. До недавнего времени полагали, что транскрипция приводит к образованию высокомолекулярной РНК, процессинг которой сводится к простому нарезанию специфических молекул мРНК, которые затем и проходят в цитоплазму, где транслируются с образованием соответствующих белков. Однако в настоящее время выяснилось, что стадии процессинга, участвующие в образовании мРНК, более сложны и включают такие модификации, как полиаденилирование 3 -конца и присоединение метилированного гуанозина и к 5 -концу молекулы мРНК. Последовательности-ДНК, определяющие первичную структуру мРНК, также оказались не смежными, как полагали раньше, а, как правило, разъединенными «вставками» (или интронами), которые отсутствуют в комплементарной структуре соответствующих мРНК. Таким образом, мРНК не прямо копируется с генной последовательности, а-транскрибируется вначале в виде гораздо более крупного продукта, из которого в ходе процессинга вырезаются промежуточные последовательности с образованием зрелой мРНК, непосредственно транслирующейся на рибосомном уровне [104].
Присутствие промежуточных последовательностей ДНК в эукариотических генах впервые было обнаружено в генах b-глобулина, легких цепей иммуноглобулинов и альбумина. Позднее такие вставки были найдены также в генах овальбумина, кональбумина и овомукоида, равно как и в других генах специфических белков [1, 104]. Современная точка зрения на организацию овальбуминового гена, отраженная на рис. 4—28, заключается в том, что структурный ген разъединяется по меньшей мере 7 промежуточными последовательностями. Стимуляция эстрогеном вызывает координированное повышение транскрипции структурных и промежуточных последовательностей овальбуминового гена с накоплением как высокомолекулярной РНК, содержащей ов альбуминовую последовательность, так и цитоплазматической овальбуминовой мРНК [105]. Молекулы крупного предшественника мРНК, содержащего промежуточные последовательности, подвергаются воздействию ферментов с вырезанием вставок и последующим сшиванием, что приводит к образованию зрелой мРНК (см. рис. 4—28). Функция промежуточных последовательностей (или интронов) в эукариотических структурных генах не выяснена. Одно из предположений заключается в том, что они ограничивают участки гена, кодирующие домены белка, ответственные за отдельные части его общей функции, и что структурные участки ДНК (или экзоны) сближались в процессе эволюции при участии интронов [106]. Применимы ли эти объяснения к овальбумину, не ясно, поскольку специфические функции этого белка яйцеводов не известны. Однако данные о том, что ген кональбумина (овотрансферрина) содержит 17 экзонов, позволяют проверить эту концепцию путем анализа функциональных доменов, принимающих участие в секреции (сигнальная последовательность) белка и связывании железа [107].

Рис. 4—28. Структурная организация и транскрипция гена овальбумина. Эстроген стимулирует экспрессию всего гена, а промежуточные последовательности затем вырезаются со сшиванием отрезков и образованием зрелой мРНК овальбумина цыплят (Chan и соавт. [1] в модификации). ов — овальбумин; светлый участок — структурный ген темный участок — вставочные последовательности ДНК: линия — боковые последовательности ДНК.
Анализ генома клеток яйцеводов вблизи овальбуминового гена позволил недавно обнаружить два соседних гена с последовательностями, гомологичными овальбуминовому гену [108]. Эти два дополнительных гена имели и интроны, сходные с таковыми в гене овальбумина, и экспрессировались при стимуляции эстрогенами, хотя и в меньшей степени, чем овальбуминовый ген. Такой кластер родственных генов мог бы возникнуть в процессе эволюции-путем параллельной сборки из смеси родственных и неродственных участков или путем удвоения исходного гена, в котором сочетание нитронов и экзонов было зафиксировано с самого начала [109]. Отражает ли разная экспрессия трех генов при действии эстрогенов различия в эффективности транскрипции или различия в последующем процессинге и стабилизации мРНК, пока не установлено. Организация овальбуминовой области генома аналогична таковой генов глобина, и кластеризация структурно и функционально близких генов может быть общей чертой генома эукариотических клеток [108].
ТИРЕОИДНЫЕ ГОРМОНЫ
Тиреоидные гормоны оказывают многочисленные и разнообразные эффекты на дифференцировку, развитие и метаболический гомеостаз, контролируя синтез и активность регуляторных белков, в том числе ключевых ферментов метаболизма, гормонов и рецепторов. Известное действие тиреоидных гормонов на потребление кислорода определяется отчасти стимуляцией натриевого насоса за счет индукции мембранного фермента: натрий-, калийзависимой АТФазы [110а]. Этот и другие метаболические эффекты тиреоидных гормонов зависят от гормональной индукции синтеза РНК, осуществляемой путем регуляции экспрессии генов на ядерном уровне. Хотя постулировались прямые влияния тиреоидных гормонов и на клеточную мембрану и на митохондрии, но многие из эффектов этих гормонов на процессы метаболизма опосредуются, по-видимому, активацией ядерных реакций связывания с увеличением образования специфических РНК.
Основным йодтиронином, секретируемым щитовидной железой, является тироксин (Т4), которому сопутствует небольшое количество активного трийодтиронина (Т3). В тканях-мишенях Т4 дейодируется в Т3, который представляет собой главную внутриклеточную форму гормона. Это превращение происходит на плазматической мембране и в эндоплазматическом ретикулуме, и в разных тканях варьирует по степени, будучи интенсивным в передней доле гипофиза и менее выраженным в печени и почках. Большая зависимость гипофиза от превращения циркулирующего в крови Т4 в Т3 могла бы определяться потребностью в быстром увеличении гипофизарной продукции ТТГ при небольших изменениях в секреции Т4 щитовидной железой.
Большая часть циркулирующих в крови тиреоидных гормонов связана с белками плазмы: тироксинсвязывающим глобулином (ТСГ), тироксинсвязывающим преальбумином (ТСПА) и альбумином. Все они связывают Т4 более прочно, чем Т3, причем ТСГ переносит около 70% связанного Т4 плазмы; из остального количества около 10% связано с ТСПА, а 20% с альбумином [111]. Как и в отношении стероидных гормонов, именно свободные тиреоидные гормоны ответственны за контроль активности клеток-мишеней, и функция связывающих белков, помимо того, что они являются резервуаром циркулирующего гормона, неясна. Интересной особенностью ТСПА является то, что он в некоторых отношениях напоминает клеточный рецептор тиреоидного гормона, в том числе присутствием предположительного ДНК-связывающего участка, богатого заряженными аминокислотами и триптофановыми остатками.
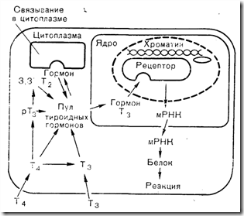
Рис. 4—29. Эффекты и взаимопревращение Т4 и Т3 В клетках, реагирующих на поступление тиреоидных гормонов. Процесс активации ядра зависит от связывания Т3 с ядерными рецепторами, а не от отдельно существующих цитоплазматических рецепторов, как это имеет место в клетках-мишенях стероидных гормонов (Eberhardt и соавт. [111] в модификации).
Клеточные рецепторы тиреоидных гормонов
Хотя показано присутствие связывающих Т3 белков в цитоплазме, но они обладают относительно низким сродством по сравнению с ядерными участками, которые считаются в настоящее время истинными рецепторами, ответственными за эффекты тиреоидных гормонов [112]. Так, в отличие от стероидных гормонов, тиреоидные гормоны, по-видимому, не нуждаются во взаимодействии с цитозольными рецепторами для последующей транслокации в ядро (рис. 4—29). Ядерные участки связывания Т3 обладают высоким сродством и низкой емкостью и ассоциированы с ядерными негистоновыми белками; их молекулярная масса после солюбилизации составляет примерно 50000 [111]. Они присутствуют во всех гормончувствительных тканях (печень, почки, сердце и гипофиз) и отсутствуют в тканях, не реагирующих на тиреоидные гормоны (семенники, селезенка), и, возможно, в тканях больных с семейной резистентностью к тиреоидным гормонам. Ядерное связывание многочисленных аналогов Т3 тесно коррелирует с их биологической активностью, а вслед за насыщением рецепторов происходит увеличение активности полимеразы и образования РНК.
Ядерные эффекты тиреоидных гормонов
Стимуляция ядерных процессов тиреоидными гормонами была впервые установлена Tata [114]; она включает повышенное образование высокомолекулярных яРНК и мРНК, как и в случае стероидных гормонов. У животных с гипотиреозом скорость образования как предшественника РНК, так и мРНК снижена на 40%, но она быстро восстанавливается до нормы после введения Т3. Помимо своих генерализованных эффектов на геном, Т3 оказывает также избирательное действие на мРНК, кодирующий a2-макроглобулпн в печени и СТГ в клетках гипофиза. Вероятно, стимулирующее действие Т3 на активность других белков, таких, как митохондриальный фермент a-глицерофосфатдегидрогеназа (a-ГФД) и цитоплазматический маликфермент, также опосредуется повышением синтеза специфических мРНК [ИЗ].
Общие особенности действия тиреоидных гормонов в разных тканях проявляются в разной степени как из-за видовой и тканевой специфичности эффектов, так и из-за индивидуальных различий в зависимости между насыщенностью рецепторов и биологическими реакциями. Так, влияния Т3 на a-ГФД и маликфермент заметно варьируют в разных тканях и у разных видов животных, причем каждая ткань, по-видимому, реагирует на Т3 индивидуально [113]. Другой особенностью действия Т3 является его участие в мультигормональной регуляции синтеза мРНК. Это наглядно проявляется на примере продукции a2-макроглобулиновой мРНК, на которую влияют кортизол, андрогены и СТГ, равно как и Т3. Кортизол и Т3 оказывают также синергичное действие на синтез мРНК гормона роста в клетках гипофиза. Наконец, метаболические факторы также модифицируют влияния Т3 на экспрессию отдельных генов, что проявляется особенно отчетливо при голодании и после введения углеводов. Так, индукция маликфермента под влиянием Т3 зависит от приема углеводов и не происходит при голодании. Однако голодание не препятствует реакции a-ГФД на Т3, что опять-таки свидетельствует о значении местных клеточных факторов в проявлении эффектов тиреоидных гормонов [113]. Очевидно, что большинство модуляций эффектов тиреоидных гормонов в отдельных тканях и в разных физиологических условиях могло бы происходить на пострецепторном уровне, реализуясь путем изменения скорости синтеза и процессинга мРНК в ядре и их последующей трансляции в специфические белки в цитоплазме


