Основы токсикологии
Основные задачи токсикологии
1-я задача – обнаружение и характеристика токсических свойств химических веществ, которые способны вызвать в организме животных или человека патологические изменения, а также изучение условий, при которых эти свойства возникают, наиболее ярко проявляются и исчезают.
Взаимодействие яда с организмом изучается в двух аспектах:
- как влияет вещество на организм - этим занимается токсикодинамика;
- что происходит с веществом в организме – токсикокинетика.
2-я задача – определение зоны токсического действия изучаемого химического вещества (токсикометрия).
Основные параметры токсикометрии:
Limас – порог однократного (острого) действия токсического вещества – минимальная пороговая доза, вызывающая изменения показателей жизнедеятельности организма, выходящие за пределы приспособительных физиологических реакций;
DL50 ( DL100) – среднесмертельная (смертельная) доза, вызывающая гибель 50% (100%) подопытных животных при определённом способе введения (в желудок, на кожу) и двухнедельном сроке последующего наблюдения, мг/кг;
CL50 (CL100) - среднесмертельная (смертельная) концентрация, вызывающая гибель 50% (100%) подопытных животных при ингаляции, мг/м3;
ПДК - предельно допустимая концентрация вещества в воздухе, мг/м3;
ОБУВ –ориентировочный безопасный уровень воздействия вещества, мг/м3.
Токсическую опасность химического вещества характеризуют также величиной зоны острого токсического действия, отношением DL50 /Limас; чем больше эта величина, тем безопаснее вещество.
3-я задача - изучение клинических и патоморфологических признаков отравления при различных путях поступления яда в организм.
Большое значение имеет определение избирательной токсичности яда, т.е. его способности в большей степени повреждать определенные клетки или ткани, не затрагивая другие. Эта информация необходима для поиска антидотов (противоядий).
4-я задача - экстраполяция экспериментальных данных для животных на человека. Клинические испытания новых лекарственных препаратов обязательны, но смертельные дозы и концентрации, естественно, не определяют. Их экстраполируют, руководствуясь при этом следующими правилами:
- если Dl для 4-х видов лабораторных грызунов (мыши, крысы, морские свинки, кролики) различаются не больше, чем в три раза, существует высокая вероятность (70%) того, что для человека Dl будет той же;
- ориентировочно Dl для человека может быть найдена путем построения линии регрессии из нескольких точек в системе координат, где:
- а – смертельная доза для данного вида животного;
- б – масса его тела.
Контролируемый эксперимент в токсикологии невозможен. Условия взаимодействия яда с организмами разных людей не идентичны и зависят от:
- состояния здоровья;
- перенесенных ранее болезней;
- разной чувствительности к ядам вследствие привыкания или проводимого медикаментозного лечения;
- наличия хронических отравлений (алкоголизм, курение и т.п.);
- климатических условий;
- социальных обстоятельств.
Классификация ядов и отравлений
По химическим свойствам яды бывают:
- органические;
- неорганические;
- элементорганические.
По цели применения:
- промышленные яды (органические растворители, топливо, красители, хладогенты, пластификаторы и др.)
- ядохимикаты** - вещества, применяемые для борьбы с вредителями сельскохозяйственных культур:
- хлорорганические пестициды (гексохлоран и др.);
- фосфорорганические инсектициды (карбофос, хлорофос и др.);
- ртутьорганические вещества (гранозан);
- производные карбаминовой кислоты – севин.
- лекарственные средства.
- бытовая химия (пищевые добавки, средства личной гигиены и санитарии, косметика, средства по уходу за одеждой и автомобилем );
- биологические растительные и животные яды, которые содержатся в различных растениях и грибах (аконит, цикута и пр.), животных и насекомых (змеи, пчелы, скорпионы) и вызывают отравление при попадании в организм;
- боевые отравляющие вещества (БОВ).
По степени токсичности вещества делят на 4 категории:
І Вещества чрезвычайно опасные;
ІІ Вещества высокоопасные;
ІІІ Вещества умеренно опасные;
ІV Вещества малоопасные.
По виду токсического действия:
Таблица 1.1 – Токсикологическая классификация ядов
|
№ пп |
Общий характер токсического воздействия |
Характерные представители веществ |
|
1 |
Нервно-паралитическое действие (бронхоспазм, удушье, судороги, параличи) |
Фосфорорганические инсектициды (хлорофос, карбофос и др.), никотин, анабазин, БОВ. |
|
2 |
Кожно-резорбтивное действие (местные воспалительные процессы и некротические изменения в сочетании с общетоксическими резорбтивными явлениями) |
ДХЭ, гексахлоран, БОВ, уксусная эссенция, мышьяк и его соединения, сулема |
|
№ пп |
Общий характер токсического воздействия |
Характерные представители веществ |
|
3 |
Общетоксическое действие (гипоксические судороги, кома, отек мозга, параличи) |
HCN и её соли, СО, алкоголь, БОВ, окислы азота, фосген |
|
4 |
Удушающее действие (токсический отек легких) |
Окислы азота и фосген |
|
5 |
Слезоточивое и раздражающее действие (раздражение наружных слизистых оболочек) |
Хлорпикрин, пары крепких кислот и щелочей |
|
6 |
Психотическое действие (нарушение психической активности – сознания) |
Наркотики (кокаин, опий), атропин, БОВ, ЛСД – диэтиламид, лизергиновая кислота |
По «избирательной токсичности»:
Таблица 1.2 - Классификация ядов по избирательной токсичности
|
Характер избирательной токсичности |
Характерные представители токсических веществ |
|
«Сердечные яды» Кардиотоксическое действие - нарушение ритма и проводимости сердца, токсическая дистрофия миокарда |
Сердечные гликозиды (дигиталис, дигоксин, лантозид); трициклические антидепрессанты (имипрамин, амитриптилин); растительные яды (аконит, чемерица, заманиха, хинин); животные яды (тетродотоксин); соли бария и калия |
|
«Нервные яды» Нейротоксическое действие – нарушение психической активности, токсическая кома, токсические гиперкинезы и параличи |
Психофармакологические средства (наркотики, транквилизаторы, снотворные); фосфорорганика, СО; производные изониазида (тубазид, фтивазид); алкоголь |
|
«Почечные яды» Нефротоксическое действие - токсическая нефропатия |
Соли тяжелых металлов, ЭГ, щавелевая кислота |
|
«Печеночные яды» гепатоксическое действие - токсическая гепатопатия |
Хлорир. углеводороды; ядовитые грибы, фенолы и альдегиды |
|
«Кровяные яды» Гематоксическое действие – гемолиз, метгемоглобинея |
Анилин и его производные; нитриты, мышьяковистый водород |
Продолжение таблицы 1.2
|
Характер избирательной токсичности |
Характерные представители токсических веществ |
|
«Желудочно-кишечные яды» Гастроэнтеротоксическое действие - токсический гастроэнтерит |
Крепкие кислоты и щелочи, соединения тяжелых металлов и мышьяка |
Классификация отравлений
По причине возникновения:
- случайные:
- производственные;
- бытовые (алкоголизм, наркомания);
- преднамеренные (самоубийство или убийство).
По клиническому принципу:
- острые: (случайные; криминальные; суицидальные)
- подострые – форма острого отравления, но развитие замедленно и вызывает продолжительное расстройство здоровья;
- хронические.
По степени тяжести:
- легкие;
- средней тяжести;
- тяжелые;
- смертельные.
Это деление зависит от выраженности клинической симптоматики и в меньшей степени от величины дозы.
По пути поступления:
- пероральные (в основном пищевые отравления);
- ингаляционные (в основном производственные);
- перкутанные (накожные);
- инъекционные (укусы змей и насекомых).
По происхождению токсического вещества:
- экзогенные (яд из окружающей среды);
- эндогенные (токсические метаболиты, которые могут образовываться и накапливаться в организме при нарушениях функций выделительных органов).
Всасывание, распределение, биотрансформация и выделение ядов
2.1 Транспорт ядов через клеточные мембраны
Поступление чужеродных веществ в организм, их распределение между органами и тканями, биотрансформация и выделение предполагают их проникновение через ряд биологических мембран.
Мембраны - подвижные структуры, обладающие ограниченной проницаемостью для различных соединений.
Мембрана имеет два белковых слоя, один из которых обращен в сторону цитоплазмы, а другой - наружу, внутри слой двойного липида. Снаружи - карбогидратная «шуба», состоящая из различных олиго- и полисахаридов. Одна из предполагаемых функций этой "шубы" - она способна "отличать" клетки собственного организма от чужих. Молекулы фосфолипида ориентированы таким образом, что гидрофильные группы направлены в сторону белка, а гидрофобные - соприкасаются.
Белки и липиды в клеточных мембранах могут иметь разный состав. В клеточных мембранах могут быть щели, поры и каналы. Мембраны могут иметь заряд. С учетом всего этого предложено несколько механизмов транспорта ядов через мембрану в клетку.
Тип 1. Мембраны первого типа не пропускают ионы, но пропускают нейтральные молекулы (по законам диффузии). Переход вещества сквозь мембрану в клетку происходит тогда, когда концентрация его в клетке меньше, чем в околоклеточной жидкости. Таким образом переносятся липофильные вещества и малые неполярные молекулы.
Тип 2. Для большинства полярных молекул и ионов мембраны непроницаемы. Однако возможно комплексообразование и транспорт в виде комплексов вещества с молекулами транспортной системы, которые входят в состав мембраны. Транспортными системами могут быть ферменты, некоторые белковые компоненты мембран и другие. Проникнув в клетку, комплекс распадается. Таким образом проникает, например, глюкоза в эритроциты крови.
Тип 3.Транспорт аналогично типу 2. Переход происходит в виде соединений с транспортной системой, но при этом транспортируемые вещества переходят из среды с меньшей концентрацией в среду с большей концентрацией. Для такого переноса нужна энергия. Источником энергии может быть химическая реакция, например, гидролиза. Так происходит транспорт ионов калия из плазмы в эритроциты, где их концентрация в 35 раз выше, чем в плазме, под действием энергии, выделенной при гидролизе аденозинтрифосфата (АТФ).
Тип 4. Мембраны этого типа имеют поры, через которые проникают молекулы воды, некоторые неэлектролиты и анионы небольших размеров. Катионы не проходят, т.к. в порах есть положительно заряженные частицы.
Специфика мембран зависит от наличия в них мукополисахаридов, липидов (хорестерина, кардиолипина ) и набора различных ферментов.
Существуют специальная группа веществ "мембранотоксины". Они обладают фосфолипазной активностью, в результате которой происходит дезорганизация и разрушение основной жидкокристаллической структуры мембран с последующей гибелью клеток. Например, показано, что как избыток, так и недостаток витаминов D и Е, повышают проницаемость лизосомальных мембран
С другой стороны есть соединения, которые способствуют стабилизации мембран (холестерин, кортизон, синтетические вещества: аминазин, салицилаты). Эти вещества используют при лечении отравлений.
Рецепторы токсичности
Химические вещества, попавшие в организм, проявляют своё действие, только тогда, когда они взаимодействуют с соответствующими реакционноспособными структурами, которые называются рецепторами и находятся в клетках. Для того, чтобы проявились токсичные свойства вещества в структуре рецептора должны быть группы, способные взаимодействовать с этими веществами. Функции рецепторов могут осуществлять: сульфгидрильные, гидроксильные, карбоксильные, амино- и фосфорсодержащие группы белковых и других соединений. Свойства рецепторов могут иметь аминокислоты, ферменты, витамины, гормоны и другие.
Таким образом, любое химическое вещество может производить биологическое действие, если обладает двумя независимыми признаками: сродством к рецепторам и физико-химической активностью.
Токсическое действие вещества пропорционально площади рецепторов, занятой молекулами этого вещества. Максимальное токсическое действие яда проявляется, когда минимальное количество его молекул способно связывать и выводить из строя наиболее жизненно важные клетки-мишени.
Например, токсины бактерий ботулинуса способны накапливаться в окончаниях периферических двигательных нервов и в количестве 8 молекул на каждую нервную клетку вызывают их паралич. Таким образом, 1 мг этого токсина может «уничтожить» до 1,2 т живого вещества, а 200 г способно погубить все население Земли.
Большое значение имеет скорость образования комплексов яда с рецептором, их устойчивость и способность к обратной диссоциации, что нередко играет более важную роль, чем степень насыщения рецепторов ядом.
Однако, в токсическом действии многих веществ отсутствует строгая избирательность. Их вмешательство в жизненные процессы основано не на специфических химических процессах взаимодействия с определенными клеточными рецепторами, а на взаимодействии со всей клеткой в целом.
Яды могут образовывать с рецепторами различные типы связей, причем большое значение имеет обратимость этой связи. Большинство токсичных веществ, по-видимому, непрочно связывается с рецепторами, и их можно отмыть. Но есть и ковалентные связи. Например, соединения мышьяка, ртути и сурьмы образуют ковалентные связи при взаимодействии с сульфгидрильными группами белков; эфиры фосфорной кислоты (фосфорорганические антихолинэстеразные препараты) алкилируют или ацилируют определенные функциональные группы белков фермента холинэстеразы. Однако сульфгидрильные группы пораженной ртутью клетки можно в какой-то мере регенерировать, применив антидот унитиол (2,3 - димеркаптопропансульфонат натрия), содержащий реакционноспособные SH-группы. Проалкилированные или проацилированные группы можно подвергнуть гидролизу.
Таким образом, методы детоксикации базируются на возможности разрушения комплекса яд - рецептор. Для этого применяют антидоты в сочетании с методами очищения (диурез, диализ, сорбция).
Распределение токсических веществ в организме
Распределение токсических веществ в организме зависит от трёх основных факторов: пространственного, временного и концентрационного.
2.3.1 Пространственный фактор определяет пути наружного поступления и распространения яда. Распространение связано с кровообращением органов и тканей и количество яда, поступающего к данному органу, зависит от его объёмного кровотока, отнесённого к единице массы ткани. Наибольшее количество яда в единицу времени поступает обычно в лёгкие, почки, печень, сердце и мозг.
При ингаляционных отравлениях основная часть яда поступает в почки, а при пероральных - в печень.
Физико-химические свойства токсических веществ тоже влияют на их распределение. Токсические вещества, растворимые в липидах (анестетики, снотворные, седативные вещества, хлорсодержащие инсектициды), легко проникают через мембраны и распределяются в органах и тканях, содержащих липиды и насыщенных кровью - в основном в головном и костном мозге. Но, например, в спинном мозге больше липидов, чем в головном, поэтому при хлороформенном наркозе в спинном мозге его на 50% больше, чем в головном. Растворимые в липидах лекарственные вещества и яды медленно выводятся из организма и медленно трансформируются.
Токсические вещества могут депонироваться в соответствующих органах и тканях:
- в жировых тканях - жирорастворимые яды (органические растворители, хлоруглеводороды);
- в костной ткани - свинец, барий, фтор, антибиотики тетрациклинового ряда;
- в костном мозге накапливается бензол; в головном мозге - аминазин;
- в коже - золото и серебро;
- в почках - ртуть;
- в белках, содержащих сульфгидрильные группы, накапливается ртуть, висмут, мышьяк.
Водородрастворимые вещества находятся в межклеточной и внутриклеточной жидкости (на 70 кг веса приходится 14 л межклеточной и 28л внутриклеточной жидкости).
Место локализации ядов зависит и от характера отравлений: при остром отравлении ртуть и мышьяк локализуются в печени и почках, а при хроническом - в ногтях, костях, нервных тканях, в волосах (мышьяк ).
2.3.2 Временной фактор - это скорость поступления яда в организм и скорость его выведения из организма, т.е. он отражает связь между временем действия яда и его токсическим эффектом.
2.3.3 Концентрационный фактор - концентрация яда в биологических средах, в частности в крови. Это основной показатель в клинической токсикологии. По этому фактору различают токсикогенную и соматогенную фазы отравления и оценивают эффективность дезинтоксикационной терапии. Графически это выглядит следующим образом. В токсикогенной фазе отравлений имеется два основных периода: период резорбции, продолжающийся до момента достижения максимальной концентрации токсического вещества в крови, и период элиминации - от этого момента до полного очищения крови от яда.

Основные синдромы токсикогенной фазы (особенно в период резорбции): экзотоксический шок, токсическая кома, желудочно-кишечные отравления, асфиксия и др.
В соматогенной фазе обычно развиваются патологические синдромы, лишённые выраженной токсикологической специфичности (так называемые осложнения): пневмония, острая почечная недостаточность (ОПН) или острая почечно-печеночная недостаточность (ОППН), сепсис и др.
Выделение ядов из организма
Токсические вещества выделяются в неизменном виде или в виде метаболитов. Основные пути выведения: почки, печень, лёгкие, кишечник.
Например, этиловый спирт: большая часть его метаболизируется, 10% неизмененного этилового спирта удаляется с выдыхаемым воздухом и понемногу остальными путями.
Через почки выводятся прежде всего водорастворимые вещества, причем, чем меньше молекулярная масса, тем легче; ионы легче, чем неионизированные. На выведение слабых кислот и оснований влияет рН мочи, т.к. от рН зависит их диссоциация: если моча кислая, то лучше выводятся слабые основания: (хинин, кофеин, ацетанилид, антипирин и др); слабые кислоты (барбитураты, салициловая кислота, некоторые сульфанилиды) лучше переходят в мочу, имеющую более щелочную реакцию, чем плазма крови. Липофильные вещества почти не выводятся почками, но если их метаболиты водорастворимые, то выводятся.
В печени происходит метаболизм многих токсических веществ. Чем больше молекулярная масса веществ, тем быстрее они выводятся с желчью. Желчь поступает в кишечник, и там токсические вещества снова могут всасываться в кровь, а те, которые из кишечника снова поступают в кровь, потом выделяются почками.
Через лёгкие выводятся летучие жидкости и газообразные вещества, которые имеют высокое давление паров при температуре тела. Эти вещества проникают из крови в альвеолы через их мембраны. Таким образом выводятся в неизменном виде пероксид углерода, сероводород, этиловый спирт, диэтилоый эфир, некоторые продукты метаболизма.
С потом выделяются соединения мышьяка, некоторые тяжёлые металлы, бромиды, иодиды, камфора, этиловый спирт, ацетон, фенол и др. ( незначительные количества ).
С молоком выводятся: этиловый спирт, аспирин, барбитураты, кофеин, никотин и др. Коровье молоко может содержать пестициды.
Метаболизм (биотрансформация) ядов в организме
Метаболизм - это процесс превращения веществ, поступивших в организм, под действием ферментов. Продукты этого превращения - метаболиты.
Метаболические превращения занимают особое место в детоксикации чужеродных токсических веществ, поскольку они являются как бы подготовительным этапом для их удаления из организма.
Биотрансформация в основном происходит в два этапа: первый этап - метаболические реакции гидроксилирования (окисление, восстановление, гидролиз); второй этап - реакции синтеза (соединения с белками, аминокислотами, глицином ).
Смысл этих реакций - образование нетоксичных гидрофильных соединений, которые гораздо легче, чем исходное вещество, могут вовлекаться в другие метаболические превращения и выводиться из организма.
Особенно важно изучение метаболических процессов, в результате которых нетоксичное или малотоксичное вещество превращается в соединение более токсичное, чем исходное. Такое явление называется летальным синтезом.
Яркий пример - метанол, токсичность которого полностью определяется продуктами его окисления: СН2О и НСООН:
СН3ОН → НСНО→ НСООН
Метаболизм этанола начинается с образования ацетальдегида, который на порядок токсичнее исходного вещества.
Тяжесть отравления этиленгликолем прямо пропорциональна степени окисления его до щавелевой кислоты:
СН2ОН СН2ОН СН2ОН СООН
I → I → I → … → I
СН2ОН СНО СООН СООН
Еще один пример: теофос ( паратион ) сам он не обладает антихолинэстеразным действием, но после введения в организм происходит замещение серы на кислород, в результате образуется параоксон - мощный ингибитор холинэстеразы.
Одним из путей метаболизма токсических веществ в организме является образование свободных радикалов.
Четыреххлористый углерод - сильный гепатотропный яд, он вызывает некроз и жировую дистрофию гепатоцитов. Обычный метаболизм (CCl4→CHCl3; CCl4→Cl3CH2-OH)происходит всего на 20%.
И хлороформ и трихлорэтанол менее токсичны, чем четырехслористый углерод.
Предположили, что идет распад CCl4 с образованием радикалов ×CCl3 + Cl×.
Радикал ×CCl3 повреждает ферментные системы и инициирует цепную реакцию переокисления липидов. В результате увеличивается проницаемость мембран для ионов H+, K+, Na+, Ca++ и далее мембрана разрушается и гепатоцид погибает.
Таким образом. метаболизм - не всегда детоксикация. Во многих случаях организм сам синтезирует яд. К сожалению сведения о метаболизме большого количества соединений недостаточны. Пути метаболизма изучают на животных, а экстраполяция результатов на человека не всегда корректна. Только клиническая практика позволяет найти новые подходы к решению проблемы.
Основные и дополнительные факторы, определяющие развитие отравления
2.6.1 Основные факторы, относящиеся к ядам:
- физико-химические свойства;
- токсическая доза и концентрация в биосредах;
- характер связи с рецепторами токсичности;
- особенности распределения в биосредах;
- степень химической чистоты и наличие примесей;
- устойчивость и характер изменений при хранении.
2.6.2 Дополнительные факторы, относящиеся к конкретной «токсической ситуации»:
- способ, вид и скорость поступления в организм;
- возможность кумуляции и привыкания к ядам;
- совместное хранение с другими токсичными веществами и лекарствами
2.6.3 Основные факторы, характеризующие пострадавшего:
- видовая чувствительность;
- влияние массы тела, питания и физической нагрузки;
- половая принадлежность;
- возрастные особенности;
- индивидуальная вариабельность и наследственность;
- влияние биоритмов и пр.;
- возможность развития аллергии и токсикомании;
- общее состояние здоровья пострадавшего;
2.6.4 Дополнительные факторы, влияющие на пострадавшего:
- температура и влажность окружающего воздуха;
- барометрическое давление;
- шум и вибрация;
- лучистая энергия и прочее.
Естественно, это деление достаточно условно.
Методы анализа, применяемые в токсикологии
Химико-токсикологический анализ включает:
- изолирование ( извлечение ) исследуемых веществ из биологического материала;
- очистку вытяжек от примесей и выделение вещества из вытяжек;
- идентификацию вещества;
- количественное определение выделенных веществ.
Соответственно методы анализа разные.
2.7.1. Методы изолирования ( извлечения ) токсических соединений из биологического материала.
Вещества, которые изолируют из биологического материала перегонкой с водяным паром. Это синильная кислота и соли, некоторые спирты, формальдегид, ацетон, фенол, хлорпроизводные углеводороды, уксусная кислота, этиленгликоль, тетраэтилсвинец.
Вещества, которые изолируют настаиванием биоматериала в подкисленной этиловым спиртом или подкисленной водой. Это алкалоидыалкалоиды и их синтетические аналоги (барбитураты и другие органические вещества).
Вещества, которые изолируются водой. Это щелочи, минеральные кислоты и их соли.
Вещества, которые изолируются органическими растворителями, несмешивающимися с водой. Это в основном пестициды.
Вещества, для изолирования которых используют минерализацию биологического материала. Это соли металлов («металлические яды»).
Вещества, которые определяют без изолирования. Это монооксид углерода в крови.
Изолирование (извлечение) - перевод токсического вещества из биологического материала в жидкую фазу (вытяжку, минерализацат или дистиллят).
2.7.2 Качественные методы идентификации:
- хроматография в тонком слое;
- ГЖХ;
- спектроскопия ( УФС, ИКС )
- электрофорез;
- микрокриссталлоскопия;
- микродиффузия.
2.7.3 Количественное определение:
- фотоколориметрия;
- спектрофотометрия;
- ГЖХ и др.
Методы детоксикации
2.8.1. Методы усиления естественной детоксикации.
- промывание желудка;
- очищение кишечника;
- форсированный диурез;
- лечебная гипервентиляция.
Необходимо знать, что при отравлениях прижигающими жидкостями - рвота (самопроизвольная или искусственно вызванная) - это повторное прохождение кислоты или щелочи по пищеводу, что может усилить степень его ожога плюс вероятность ожога дыхательных путей. Т.е. должно быть зондовое промывание желудка. Если с момента принятия яда прошло много времени, желудок не промывается.
После промывания желудка назначают сорбенты (активированный уголь 50-80г) и слабительное (100-150мл вазелинового масла или зондирование специальными растворами).
Форсированный диурез. Больным вводят 1,5 - 2л изотонического раствора NaCl или 5% -раствора глюкозы и назначают мочегонное; здесь нужно контролировать рН мочи (смотря чем вызвано отравление). Метод используется в основном при отравлении веществами, которые выводятся почками. Если токсические вещества связываются с белками или яды жирорастворимые, этот метод малоэффективен.
Гипервентиляцию используют при отравлении летучими веществами (CS2, хлоруглеводороды, СО); больного подключают к аппарату искусственного дыхания. Однако длительная гипервентиляция может привести к нарушению газового состава крови (гипокапния).
2.8.2. Методы искусственной детоксикации:
- перитонеальный диализ:
- гемодиализ;
- гемосорбция;
- плазмособрция;
- замещение крови и плазмы;
- лимфорея и лимфосорбция.
Диализ - разложение, разделение. Это удаление низкомолекулярных веществ из растворов коллоидных и высокомолекулярных веществ через полупроницаемые мембраны, основанное на свойстве полупроницаемых мембран пропускать низкомолекулярные вещества и ионы, соответствующие по размеру их порам (до 50 нм) и задерживать коллоидные частицы и макромолекулы. Таким образом снижается концентрация отравляющих веществ в крови.
Перитонеалный диализ наиболее прост и доступен. В брюшную полость через катетер заливают специальный раствор (2л), который через некоторое время (20 минут) удаляют (прерывистый метод) или 2 катетера (непрерывный метод): через один жидкость вводят, а через другой - выводят. Диализ основан на том, что брюшина имеет развитую поверхность (примерно 20 тыс.кв.см), представляющую собой полупроницаемую мембрану. Для диализа используют раствор состава: KCl - 0,3г, NaCl - 8,3г, MgCl2 - 0,1 г, CaCl2 - 0,3г, глюкоза - 6г на 1 л воды. Одновременно вводят 500 000 ЕД пенициллина и 1000 ЕД гепарина (чтобы предотвратить перитонит); рН раствора регулируют в зависимости от характера отравляющего вещества (7,5 - 8,4 при отравлении слабокислыми веществами, например, барбитуратом; 7,1 - 7,25 при отравлении слабоосновными веществами) добавлением раствора NaHCO3. Температура раствора должна быть 37 - 37,5оС или 39 – 400С (если температура больного повышена). Иногда добавляют альбумин, который связывает некоторые токсичные вещества и способствует их переходу из крови в брюшину. В качестве осложнения возможна пневмония, т.к. повышается уровень диафрагмы и, соответственно, снижается объём легких. Поэтому нужно приподнимать верхнюю часть тела и вентилировать легкие.
Гемодиализ проводят с помощью аппарата «искусственная почка», который оснащен полупроницаемой мембраной, через которую токсические вещества переходят из крови в диализат. Метод используют, если отравляющие вещества имеют небольшую молекулярную массу и проходят через полупроницаемую мембрану (при тяжелых отравлениях барбитуратами, мышьяком, соединениями тяжелых металлов, метиловым спиртом, CCl4, ЭГ, анилином и др.). Метод особенно эффективен на ранней стадии (первые 24 часа). Подключение аппарата проводиться способом артерия - вена с помощью артериовенозного шунта в нижней трети предплечья.
Гемосорбция - сорбция отравляющих веществ из крови на поверхность твердой фазы. Сорбенты: активированный уголь, ионообменные смолы (иониты). Гемосорбцию проводят с помощью прибора (детоксикатора), имеющего насос для перекачивания крови и колонки с сорбентом. Прибор подключают к кровотоку больного, кровь переходит через сорбенты и яды сорбируются. Осложнения: падение АД до 80 - 60 мм рт. ст. и уменьшение количества тромбоцитов. Метод лучше, чем диализ, проще, выше скорость детоксикации. Рекомендован при отравлении барбитуратами, салицилатами, гликозидами, производными фенотиазина, грибами. и т.п.
Замещение крови. Для полного замещения крови больного донорской кровью необходимо 10 -15 л, т.е. количество в 2 -3 раза превышающее объём циркулирующей крови. Т.к. часть перелитой крови постоянно удаляется из организма при одновременно проводимом кровопускании, поэтому, учитывая трудности в получении такого количества крови и опасность иммунологического конфликта, используют меньшие объёмы замещения (1,5 - 2 л ). Но тогда при распределении ОВ во внеклеточном секторе (14 л), мы сможем удалить не более 10 - 15% яда, а при его распределении во всем водном секторе (42 л) – не более 5 - 7%. Наибольшую эффективность метод даёт при отравлении ядами крови (анилином, нитробензолом, мышьяковистым водородом, нитритами). Осложнения: гипотония, анемия.
Замещение лимфы (детоксикационная лимфорея) - выведение из организма большого количества лимфы с последующим возмещением потери внеклеточной жидкости. Лимфу удаляют с помощью катетера, который вставляют в грудной лимфопроток на шее (лимфодренаж). Потери лимфы около 3л в сутки, а в вену вводят соответствующее количество плазмозамещяющих растворов. Метод малоэффективен, т.к. удаляется не более 7% яда (общий объём жидкости в организме 42л). Метод применяется в сочетании с другими.
2.8.3. Методы антидотной детоксикации:
- химические противоядия (контактного действия и парентерального действия);
- биохимические противоядия;
- фармакологические антогонисты.
Антидотная терапия эффективна только а ранней токсикогенной фазе острых отравлений, длительность которой зависит от токсикологического вещества (наиболее длительная ТФ (8 -12 суток), при отравлении соединениями тяжелых металлов; наименьшая - для цианидов, хлоруглеводородов).
Антидотная терапия специфична, и нужно точно знать, чем вызвано отравление. Эффективность антидотной терапии снижена, если развиваются тяжёлые нарушения системы кровообращения и газообмена. Тогда нужна реанимация.
Антидотная терапия не имеет лечебного эффекта, т.е. не применяется в соматогенной фазе.
Антидоты условно можно разделить на четыре группы.
Химические противоядия контактного действия - это активированный уголь; 1 г угля сорбирует 0,8 г морфина, 0,7г барбитала, 0,3 - 0.35 г других ядов.
Этот метод имеет свое название «гастроинтестинальная сорбция».
Химические противоядия парэнтерального действия - это меркаптосоединения:
- унитиол (2,3 - димеркаптопропансульфонат натрия);
- димеркаптоянтарная кислота;
- цистеин (a-амино-b-меркаптопропионовая кислота);
- пенициламин (диметилцистеин);
- ацетилцистеин;
- хелатообразующие и комплексообразующие соединения.
Биохимические противоядия - это препараты, которые не влияют на физико-химическое состояние токсического вещества. Они обеспечивают выгодное изменение метаболизма токсических веществ или изменение направления биохимических реакций, в которых они участвуют. Это реактиваторы холинэстеразы (оксимы) - при отравлении ФОС; метиленовый синий - при отравлении метгемоглобинообразователями; этанол - при отравлениях метанолом и ЭГ; антиоксиданты - при отравлении CCl4.
Фармакологические противоядия - препараты, оказывающие лечебный эффект в силу фармакологического антогонизма с действием токсических веществ на одни и те же функциональные системы организма. Например, атропин и ФОС, прозерин и пахикарпин, KCl и сердечные гликозиды. Это позволяет купировать многие опасные симптомы отравления данными препаратами, но эффект частичный, кроме того, фармпрепараты - антогонисты должны применяться в больших дозах.
Токсикологическое значение органических растворителей
3.1Отравление алкоголем
Острая алкогольная интоксикация (алкогольная кома) наблюдается в случаях приема спиртных напитков с содержанием этилового спирта больше 12%. Этиловый спирт легко проникает через тканевые мембраны, быстро всасываются в желудке (20%) и тонком кишечнике (80 %).Через 1,5 часа его концентрация в крови достигает максимума. В органах с интенсивным кровоснабжением (мозг, печень, почки) динамическое равновесие его концентрации в крови и тканях устанавливается в течение нескольких минут. Концентрированные спиртные напитки (> 30%) всасываются быстрее. Пищевые массы в желудке замедляют всасывание алкоголя (сорбируют его). При приеме натощак или при гастрите, язве скорость резорбции выше.
В печени 90% поступившего этанола окисляется (скорость 6-7 г /ч) с участием фермента алкогольдегидрогеназы по схеме:
С2Н5ОН®СН3СНО ®СН3СООН ®СО2 + Н2О.
1-2% Алкоголя окисляется до СН3СНО ферментом каталазой, которая находится во всех тканях (мышцы, и др.). Этот процесс является составной частью механизма толерантности к алкоголю.
Примерно 10% алкоголя выделяется в неизменном виде через легкие и с мочой в течение 7-12 часов.
Алкогольная кома составляет примерно 60 % всех коматозных состояний с большим процентом летальности.
Этанол обладает психотропным действием с наркотическим влиянием на ЦНС. Наркотический эффект зависит от:
- скорости резорбции (чем выше скорость нарастания концентрации в крови, тем выше наркотический эффект),
- фазы интоксикации (в фазе резорбции он выше, чем в фазе элиминации при той же концентрации),
- концентрации в крови;
- степени развития толерантности.
Смертельная доза при однократном приеме - от 4 до 12 г/кг (примерно 300 мл 96 %); алкогольная кома развивается при концентрации в крови 3 г/л, смертельная концентрация 5-6 г/л.
Синдромы отравления:
- в токсикогенной фазе коматозное состояние, неврологические расстройства, нарушение дыхания, нарушение функции сердечно-сосудистой системы;
- в соматогенной фазе психоневрологические расстройства, воспалительное поражение органов дыхания, миоренальный синдром.
Выделяют две стадии алкогольной комы: поверхностная кома и глубокая.
Симптомы поверхностной комы: потеря сознания, отсутствие контакта, снижение зрачковых рефлексов, снижение болевой чувствительности.
Наблюдается непостоянство неврологических симптомов.
Симптомы глубокой комы: утрата болевой чувствительности, отсутствие зрачковых и сухожильных рефлексов, мышечная атония, гипотермия, то есть неврологическая симптоматика, особенно второй стадии, неспецифична.
Ведущая причина смерти в остром периоде отравления: нарушение дыхания, сопровождающееся нарушением КЩС крови (метаболический ацидоз несколько компенсируется дыхательным алкалозом; при нарушении дыхания – развивается декомпенсированный ацидоз).
После выхода из коматозного состояния:
- судорожный синдром;
- синдром похмелья;
- потеря зрения (от нескольких минут до нескольких часов);
- пневмония;
- миоренальный синдром (при неудобном положении сдавливаются магистральные сосуды конечностей и нарушается их кровоснабжение; развивается некроз мышц и острая почечная недостаточность).
Лечение алкогольной комы
- восстановление дыхания (интубация трахеи, ИВЛ);
- затем промывание желудка через зонд с полным удалением последней порции;
- внутривенно 600-1000 мл 4% NaHCO3;
- внутривенно -500 мл 20 % раствора глюкозы с инсулином и витаминами.
Отравление метанолом
Метаболизм.
Метанол окисляется по схеме: СН3ОН®СН2О®СНООН®СО2 + Н2О
Окисление метанола и его метаболитов медленнее, чем этилового спирта. В основном выводится почками, примерно 15% - через легкие.
Токсическое действие:
- угнетение ЦНС;
- развитие тяжелого ацидоза;
- поражение сетчатки с развитием дистрофии зрительного нерва.
Летальная доза внутрь 100 мл.
Токсическая концентрация в крови -200 мг/л, смертельная концентрация в крови более 800 мг/л.
Симптомы
Опьянение выражено слабо, рвота, боли в животе, головные боли, боли в мышцах, слепота, спутанность сознания, нередко судороги, кома, гипертонус мышц конечностей. Гиперемия и сухость кожи и слизистых. Артериальное давление то поднимается, то падает, острая сердечно-сосудистая недостаточность, нарушение дыхания.
Лечение:
- промывание желудка;
- форсированный диурез;
- гемодиализ;
- перитонеальный диализ.
Специфическая терапия: этиловый спирт по 50 мл 30% раствора внутрь через 3 часа или внутривенно 5% раствор (1-2 г/кг) в сутки.
При нарушении зрения: атропин, гидрокортизон.
Отравление этиленгликолем
Этиленгликоль входит в состав тормозной жидкости, быстро всасывается в желудке и кишечнике, выделяется в неизменном виде почками (20-30%), около 60% окисляется в печени с образованием гликолевого альдегида, глиоксаля, щавелево-уксусной кислоты.
Выделяют три периода интоксикации
- начальный - до 12 часов – симптомы алкогольного опьянения;
- нейротоксический – симптомы поражения ЦНС и нарушение функции дыхания и сердечно-сосудистой системы;
- нефротоксический – на 2-5-е сутки, поражение печени и почек.
Симптомы при тяжелых отравлениях:
- потеря сознания;
- судороги;
- гипертермия;
- шумное глубокое дыхание;
- сердечно-сосудистая недостаточность (коллапс, отек легких);
- на 2-5-е сутки токсическая гепато- и нефропатия.
Лечение
- промывание желудка;
- форсированныйй диурез;
- гемодиализ;
- перитонеальный диализ.
Специфическая терапия: этиловый спирт по 50 мл (см. метанол) и 10% раствор CaCl2 или глюконата по 10-20 мл.
Отравление дихлорэтаном (ДХЭ)
ДХЭ используют для извлечения алкалоидов из растительного сырья.
Пути поступления: пищеварительный тракт (вместо этилового спирта), дыхание, кожа. Максимальная резорбция в течении 3-4 часов. Распределяется и накапливается в тканях, богатых липоидами: ЦНС, печени, надпочечниках, сальнике. Через 6 часов после поступления 70% ДХЭ уже фиксировано в клетках.
Метаболизм - окислительное дехлорирование в печени при участии оксидаз (цитохром Р-450 и др.)
Cl-CH2-CH2-Cl®ClCH2-CH2OH®ClCH2COOH®HOCH2COOH®щавелевая кислота
I II III IV
Хлорэтанол (II) и монохлоруксусная кислота (III) более токсичны, чем ДХЭ;
Хлорэтанол появляется в крови уже через 1 час, максимальная концентрация через 4 часа, через двое суток – следы; в печени - максимум через 24 часа, высокая концентрация сохраняется до двух суток.
Выделение ДХЭ и метаболитов:
- 10-42%- с выдыхаемым воздухом;
- 51-73%- с мочой;
- остальное через кишечник.
Токсическая концентрация в воздухе – 0,3- 0,6 мг/л в течение 2-3 часов, смертельная концентрация в воздухе – 1,25 – 2,75 мг/л, смертельная концентрация при приеме внутрь – 15 – 20 мл.
Токсическое действие: на ЦНС, на печень, на сердечно-сосудистую систему.
По характеру действия ДХЭ – алкилирующий яд; он вытесняет в клетках отдельные функциональные группы белков, преимущественно, нуклеопротеидов, разрушая внутриклеточные структуры.
ClCH2CH2Cl + RSH®RSCH2CH2Cl + HCl.
Метаболиты – хлорэтанол и монохлоруксусная кислота – повреждают клеточные мембраны, нарушают клеточный обмен в основном в печени, где осуществляется основной этап метаболизма ДХЭ. Происходит быстрое истощение запасов восстановленного глутатиона печени, который является основным веществом, нейтрализующим ДХЭ и метаболиты. Таким образом быстро нарушается детоксицирующая функция печени. Кроме того, при метаболизме ДХЭ возможно образование свободных радикалов и переокисление липидов в мембранах. Повышается проницаемость клеток и идет уменьшение массы циркулируемой крови за счет потери ее жидкой части. Результатом может быть экзотоксический шок.
Клинические синдромы экзотоксического шока
— психоневрологические расстройства;
в первые 3 часа наблюдается: головокружение, неустойчивость походки, заторможенность или, наоборот, эйфория, слуховые и зрительные галлюцинации, возможные судороги, при приеме более 50 мл может быть кома, вследствие наркотического действия.
—нарушение внешнего дыхания (замедление ритма дыхания до полной остановки, западение языка).
—нарушение функции сердечно-сосудистой системы;
Изменение КЩС с развитием метаболического ацидоза у 80% больных, тахикардия (от 100 до 180 ударов в минуту), повышение АД до 180 / 100 – 200/120, в 60% случаев ЭШ падение АД (необратимое), отсутствие пульса на периферических артериях,токсическая энцефалопатия, цианоз слизистых. Летальность более 90%.
—поражение печени и почек: токсическая гепатопатия у 90% больных; признаки на 2-5-е сутки болезненность печени, желтуха, геморралический диатез на фоне гипокоагуляции. Нарушение функций почек у 80% больных (в 1-3 сутки). В 3% тяжкая нефропатия с явлениями ОПН на фоне поражения печени.
—нарушение функций ЖКТ. При пероральном отравлении – тошнота, рвота с желчью. При ингаляционном отравлении сначала неврологические расстройства; при попадании на кожу – местные изменения (гиперемия, отек).
Лечение.
Ускоренная детоксикация:
- промывание желудка в ранние сроки 15-20 л. воды, затем вазелином или касторовым маслом (150-250 мл), повторять 2-3 раза через 1-2 часа;
- при наличии токсической концентрации ДХЭ в крови – гемодиализ в течение 6-10 часов(в первые 6 часов отравления);
- перитонеальный диализ в первые сутки, в течение 18-20 часов со сменой 20-25 порций диализата (рН 7,6 – 8,4), эффективность перитониального диализа очень высока, т.к. ДХЭ быстро депонируется в жировой ткани сальника и передней брюшной стенке.
- гемосорбция в первые 3 часа;2-3 сеанса.
Терапия:
- лечение ЭШ: 10-15% раствор глюкозы с инсулином; 4-8% раствор NaHCO3, до 10-12 л. в сутки, преднизолон;
- печеночная терапия: витамины группы В, глюкоза, липокаин, кокарбоксилаза, эссенсиале, a– липоевая кислота;
- диета;
- диспансерное наблюдение.
Отравление четыреххлористым углеродом
Четыреххлористый углерод применяют для экстрагирования жиров и алкалоидов. Пути попадания в организм: через пищеварительный тракт, дыхание, кожу.
При приеме внутрь в течение первого часа в желудке всасывается примерно 30% CCl4, остальное – в тонком кишечнике.
Наиболее высокая концентрация в крови – в течение 2 – 4 часов, а через 6 часов большая часть переходит в жировую ткань, печень, мозг.
При ингаляционном отравлении токсикокинетика в 2 – 3 раза быстрее.
Метаболизм в печени при участии цитохрома Р- 450:
CCl4® • CCl3 + Cl •
Выведение: 50 – 60% в неизменном виде с дыханием, остальное через почки, кишечник.
Летальность: при пероральном поступлении – 30 % . при ингаляционном – 15 – 20%.
Летальная доза 20 – 40 мл., смертельная концентрация 50 мг./л при вдыхании в течение 1 ч.
Токсическое действие:
- наркотическое на ЦНС,
- печень (свободные радикалы действуют на функциональные группы белков внутриклеточных мембран и ферментов; инициируют переокисление жирных кислот в мембранах; вызывают разрушение РНК):
- почки (поражение почек как результат гепатотоксического действия CCl4).
Симптомы (в первые 3 часа):
- токсическая энцефалопатия (головная боль,слабость, заторможенность или психомоторное возбуждение); в тяжелых случаях – кома,
- нарушение сердечно-сосудистой системы – при тяжелых отравлениях с развитием комы и протекает по типу ЭШ;
- со стороны желудочно-кишечного тракта: тошнота, рвота желчью, на 2-3 сутки развивается токсическая гепатопатия вплоть до печеночной комы; на 2-7 сутки у 85% развивается острая почечная недостаточность (отеки, повышенное АД), далее острая сердечно-сосудистая недостаточность (коллапс).
Метод анализа - ГЖХ.
Основная причина смерти – ОППН и ее осложнения (кровотечение, пневмония).
Лечение:
- детоксикация (см. ДХЭ),
- специфическая терапия (в 1-2 сутки) – антиоксиданты: витамин Е, унитиол, препарата кальция, глюкоза.
Токсикологическое значение монооксида углерода
Монооксид углевода - продукт неполного сгорания органики. Поступает в кровь через легкие и образует карбоксигемоглобин (СОНв)
Методы определенияя карбокисгемоглобина: спектроскопический, спектрофотометрический, фотоколориметрический и ГЖХ.
ПДКр.з. монооксида углерода -20 мг/м3
Летальность при острых отравлениях 17, 5%.
Токсическое действие: гемическая (транспортная) гипоксия, т.к. СОНв не переносит молекулу кислорода.
Виды поражений:
- психоневрологические расстройства (головная боль, головокружение, тошнота, рвота вплоть до комы, нарушение психической активности: возбуждение или оглушение, нейропсихические нарушения, проявляющиеся нарушением ориентации, походки, координации движения, повышение мышечного тонуса конечностей, гипертермия – ранний признак отека мозга);
- нарушение внешнего дыхания (одышка, отечность слизистых, нарушение КЩС);
- нарушение функции сердечно-сосудистой системы (может быть скоропостижная смерть вследствие остановки дыхания и первичного токсикогенного коллапса, в некоторых случаях ЭШ, может быть тахикардия);
- трофические расстройства в результате сдавливания, если человек был без сознания.
Тяжесть состояния пропорциональна содержанию СОНв в крови. Интенсивность курения может поднять уровень СОНв до 18%; при содержании СОНв выше 20% - появляется общемозговая симптоматика; если содержание СОНв около 50% - явная картина отравления; 60-70% СОНв - потеря сознания, судороги, нарушение дыхания и сердечно-сосудистой системы с возможным летальным исходом.
Лечение:
- гипербарическая оксигенация как антидотная терапия;
- симптоматическая терапия (восстановление внешнего дыхания);
- профилактика и лечение отека легких.
Токсикологическое значение лекарственных веществ
5.1 Отравление психотропными препаратами, производными барбитуровой кислоты
5.1.1. Химическое строение, физико-химические свойства, поведение в организме
Барбитураты - производные барбитуровой кислоты (продукта конденсации малоновой кислоты и мочевины.

Барбитураты - белые или желтые кристаллы, мало растворимы в воде, хорошо растворимы в жирах, являются слабыми кислотами. Сама барбитуровая кислота снотворными свойствами не обладает. Около 30 её замещенных применяются как снотворное.
Барбитураты легко всасываются в желудок и тонкий кишечник (процесс ускоряется в присутствии алкоголя).
Барбитураты бывают:
- длительного действия (8 -12 часов); это фенобарбитал (люминал); химическое название: 5-фенил-5-этилбарбитуровая кислота;
- среднего действия (6-8 час) это барбитал (веронал), барбитал-натрий (мединал), амитал-натрий (барбамил);
- короткого действия (4-6часов) –этаминал-натрий (нембутал).
Наивысшая концентрацая в плазме достигается для барбитала (веронал) через 4 - 8 часов, фенобарбитала - через 12 - 18 часов.
Барбитураты распределяются по всем тканям и биологическим жидкостям организма; их концентрация определяется: жирорастворимостью, силой связи с белками, степенью ионизации молекул, интенсивностью кровотока в тканях.
Чем меньше связь барбитуратов с белками плазмы, тем в большей степени они выделяются с мочой в неизменном виде. Барбитал и нембутал связываются с белками плазмы на 50-60%, фенобарбитал на 15%, барбитал – на 5%.
Основной путь метаболизма – гидролиз; часть барбитуратов выводится с мочой в неизменном виде, остальное – в виде метаболитов.
5.1.2 Токсическое действие и симптомы отравления
Барбитураты обладают избирательно токсичным действием на ЦНС, которое приводит к угнетанию всех её функций.
При острых отравлениях барбитуратами и другими снотворными и седативными средствами выделяют четыре основных клинических синдрома:
- коматозное состояние и другие неврологические расстройства. Коматозное состояние имеет несколько стадий: 1-я стадия - явление оглушения и сопорозного сна; 2-я стадия - поверхностная кома с повышением или снижением сухожильных рефлексов и реакции зрачков на свет (наблюдается уже при содержании примерно 0,1 г/л нембутала, 0,3 г/л барбамила и более 0,4 г/л фенобарбитала); 3-я стадия - глубокая кома с отсутствием реакции на болевое раздражение. Количество содержания барбитуратов в крови определяется спектрофотометрически;
- нарушение дыхания; отмечается у 11% больных и вызвано явлением механической асфиксии (западанием языка);
- нарушение функции сердечно - сосудистой системы (тахикардия и гипотония);
- трофические расстройства и нарушение функции почек.
Смертельная доза фенобарбитала 2г, этаминал натрия –1г.
5.1.3 Лечение при отравлении барбитуратами:
- симптоматическая и реанимационная помощь для восстановления и поддержания функции дыхательной и сердечно - сосудистой систем, профилактика и лечение пневмонии и трофических расстройств: аппарат искусственного дыхания; внутривенное вливание плазмы, глюкозы и электролитов; применение сердечно - сосудистых средств (норадреналин); гормонов при гипотонии; антибитиков при пневмонии.
Для лечения гипотоксического повреждения ЦНС - витаминотерапия (В1, В6, В12, С) после реанимации.
- стимуляция диуреза - для ускорения выведения снотворных из организма:
- гемодиализ;
- гемосорбция - более эффективна;
- перитонеальный диализ.
Использование наркотических анальгетиков
5.2.1 Алкалоиды группы пиридинов
Кониин- 2 - пропил пиперидин - содержится в болиголове.
Сильное основание, пахнет мышами, жгучий на вкус, чрезвычайно ядовит: вызывает паралич двигательных нервных окончаний.
Никотин-3 - (N -метилпирролидил - (2)) – пиридин - содержится в листьях и корнях табака. Небольшое количество возбуждает нервную систему, большие количества - ядовиты: паралич дыхательных центров, LD - 40 мг. Используется как инсектицид для борьбы с вредителями сельского хозяйства. Бесцветное масло с запахом табака, на воздухе буреет.
Анабазин -b - пиридил - b - пиперидин - алкалоид ядовитого азиатского растения Anabasis aphylla. Изомер никотина, обладает инсектицидным действием.
5.2.2 Алколоиды группы фенантрено-изохинолина (морфин, кодеин, тебаин)
Морфин - 3,6 - дигидрокси - N - метил - 4,5 - эпоксиморфинен - (7)
Основной алкалоид опиума (его в нем 3 – 20%), Мало растворим в воде, эфирах, хлф, растворим в спиртах. Экстрагируется органическими растворителями (рН 8,6 - 10,2). Применяется в основном морфина гидрохлорид. Наркотический анальгетик, оказывает противошокое действие при травмах.
Вызывает состояние эйфории, привыкание. Слабо всасывается из ЖКТ. После инъекции максимум в крови через 1 час. Угнетает дыхательный и кашлевой центры. Возбуждает рвотный центр. Тормозит секреторную и моторную функции ЖКТ, вызывает задержку мочеиспускания, понижает температуру тела.
Метаболизм проходит двумя путями:
- в основном связывается с глюкуроновой кислотой, за первые 8 часов около 50 % морфина выделяется с мочой в виде глюкуронида, а за 24 часа - 90%;
- N - деметилирования до норморфина и О – метилирование до кодеина.
Токсическое действие - наркотическая кома, ослабление реакции на свет, угнетение дыхания, гипертермия кожи, паралич дыхания. LD - 0,1 - 0,4 г.
При гниении трупов морфин превращается в псевдоморфин (окси-диморфин или дегидроморфин ).
Кодеин - 6 - гидрокси - 3 - метокси - N -метил - 4,5 - эпоксиморфинен (7).
В опиуме его 0,2 - 2%. Растворим в воде, эфирах, ХЛФ, спиртах. Экстрагируется ХЛФ (рН около 8).
Действие подобно морфину, но слабее. Назначают от кашля, при головных болях. Менее токсичен, чем морфин.
Метаболизм:
- связывание с глюкуроновой кислотой и выделение с мочой;
- деметилирование с образованием морфина (О - деметилирование) или норкодеина (N - деметилирование);
- в неизменном виде с мочой через 6 часов из организма выводится примерно 2/3, а через 24 часа - почти полностью.
Токсическое действие аналогично морфину. LD - 0,8 г.
5.3 Токсикологическое значение производных 1,4 – бенздиазепина
Нитразепам - экстрагируется органическими растворителями из щелочных растворов
Применяется как транквилизатор, при бессоннице, неврозах, психопатиях, при лечении шизофрении, эпилепсии и др.
Токсическое действие: нарушение ЦНС ( возбуждение, агрессия ). Вызывает привыкание. Клиника аналогичная барбитуратам. LD - 1-2 г
Метаболизм - восстановление NО2 группы и её ацетилирование. За 48 часов из организма выделяется 23% вещества: 5% с мочой в неизменном виде, 8% с мочой в виде аминопроизводных, и примерно 10% в виде ацетиламинопроизводных с калом.
Метод анализа - реакция диазотирования, тонкослойная хроматография УФ- и ИК-спектроскопия.
Оксазепам - 7 - хлор - 1,2 - дигидро - 3 - гидрокси - 2 - оксо - 5 фенил - 3Н - 1,4 – бензодеазипин. Является одним из метаболитов диазепама. Применяется при неврозах, психопатиях и др.
Токсическое действие: нарушение ЦНС ( возбуждение, агрессия ). Привыкание. Клиника аналогичная барбитуратам. LD - 1-2 г
Максимальная концентрация в крови через 4 часа; через 48 часов - в крови нет. Выводится с мочой в виде глюкуронида; с калом в неизменном виде.
Алколоиды группы хинолина и изохинолина
Хинин - [6 - метоксихинолил - (4/)] - [5- винилхинуклидил - (2)]карбинол.
Открыт в 1920 году в коре хинного дерева. Температура плавления 177оС, безцветный, малорастворим в воде, имеет горький вкус.
Оказывает сильно токсичное действие на протоплазму низших организмов (переносчиков малярии ). Применяют хинина гидрохлорид и хинина сульфат.
Действие: угнетает ЦНС, снижает температуру тела, уменьшает возбудимость сердечной мышцы, угнетает сократительную способность миокарда.
Симптомы отравления: оглушение, нарушение слуха и зрения, бессонница, головная боль, рвота, дрожание рук, гемоглобинурийная лихорадка, потеря сознания, маточные кровотечения.
Наркотин - один из алкалоидов опиума (его в опиуме до 9%), слабое основание растворим в хлф, мало растворим в эфирах и спиртах, нерастворим в воде. Экстрагируется органическими растворителями из водных растворов с рН 5 - 7.
В чистом виде не применяется. Входит в состав опиума и омнопона. Выявление наркотина в биологических жидкостях говорит об отравлении опиумом. Не обладает наркотическим и анальгезирующими свойствами, не приводит к привыканию. По действию подобен папаверину, но более токсичен.
Один из путей метаболизма: восстановления в нетоксичный меконин. После попадания в организм быстро переходит из крови в ткани. Первые 6 часов он выделяется с мочой в неизменном виде, а затем в виде конъюгатов.
Папаверин. В опиуме содержится от 0,1 до 1,5 % папаверина. Используется в медицине папаверина гидрохлорид - оказывает сосудорасширяющее и спазмолитическое действие. В больших дозах оказывает седативный эффект: может быть слабость, сухость в горле, запоры, при внутривенном вливании - тахикардия, гипотония, коллапс.
Метаболизм в основном путем деметилирования. Образовавшиеся фенолы выводятся с мочой в виде глюкуронида.
Нерастворим в воде, мало растворим в эфирах и спиртах.
Алкалоиды группы тропана
Атропин содержится в белладонне, дурмане. Растворим в хлорофоре, эфирах, этиловом спирте. Мало растворим в воде.
Экстрагируется органическими растворителями из слабо-щелочных растворов.
Применяют атропина сульфат - при язве желудка и двенадцатиперстной кишки, холецистите, желчекаменной болезни, спазмах кишечника, бронхиальной астме, для расширения зрачков.
Действие - повышение внутриглазного давления, , тахикардия, фотофобия, гипотензия, сухость кожи.
В больших дозах - психическое и двигательное возбуждение.
Быстро всасывается в кишечнике (за 2 часа), 1/3 циркулирует в крови, остальная часть - связывается с белками плазмы.
Метаболизм: разлагается на тропин и троповую кислоту и ещё 7 метаболитов неустановленного строения. Примерно 50% выделяется с мочой в неизменном виде.
Кокаин. Метиловый эфир бензоилэкгонина.
Растворим в хлорофоре, эфирах, спиртах, трудно растворим в воде. Экстрагируется органическими растворителями из щелочых или слабо кислых растворов.
Применяется в основном кокаина гидрохлорид. Оказывает местноанестезирующее действие. Действует на ЦНС, вызывая эйфорию, а затем угнетает ЦНС ( привыкание - кокаинизм ). Учащает сердечный ритм, сужает сосуды, повышает АД, угнетает секреторную и моторную функции ЖКТ. Легко всасывается.
Основное количество кокаина метаболизируется в печени под действием гидролаз с образованием метилового спирта и бензоилэкгонина, который расщепляется на экгонин и бензойную кислоту.
Токсическое действие: нейротоксическое (галлюцинации, страх), притупление или утрата слуха, зрения, вкуса, расширение зрачков. LD - 0,1-1,2г при подкожных инъекциях.
Алколоиды группы пурина (ксантина)
Ксантин - -2,6 - диоксипурин
1. Кофеин - 1,3,7 - триметилксантин
2. теобромин - 1,3,7 - диметилксантин
3. теофилин - 1,3 - диметилксантин
Все они содержатся в зернах кофе, листьях чая и др. По токсичности 3>1>2.
Кофеин нестоек в щелочной среде, растворим в хлороформе, воде, этиловом спирте. Экстрагируется органическими растворителями в слабо кислой среде.
Действие: возбуждает ЦНС, усиливает сердечно - сосудистую деятельность. Используют кофеин и его соли (кофеин бензонат натрия). Входит в состав цитрамона и др. Вызывает истощение нервных клеток ухудшает работу сердца.
Метаболизм: быстро всасывается из желудка, в организме разлагается: за 1 час примерно 15% деметилируется и окисляется. Образуется 1 - метилсантин, 7 - метилксантин, 1 - метил мочевая кислота и др. LD от 1 до-20 г.
Методы анализа:
- с мурексидом;
- с реактивом Несслера образует красно - бурый осадок (теобромин осадка не образует).
Теобромин. Действие аналогично кофеину. Стимулирует сердечную деятельность, расширяет сосуды сердца и мускулатуру бронхов, усиливает диурез. Слабее возбуждает нервную систему. Используют главным образом при спазмах сосудов мозга, коронарной недостаточности.
Токсикологическое действие пестицидов
6.1Использование пестицидов в народном хозяйстве
Фосфорорганические соединения (ФОС) применяются в качестве инсектицидов, фунгицидов, гербицидов, дефолиантов, десикантов, родентицидов и в качестве БОВ из группы «нервных ядов».
6.2 Строение, физико-химические свойства и токсическое действие ФОС
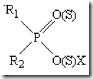
где R1 и R2 – алкилы, алкоксилы, алкиламины
Х- остаток кислоты
По химическому строению ФОС относятся к следующим группам:
- эфиры тиофосфорной кислоты (метафос, тиофос);
- эфиры дитиофосфорной кислоты (карбофос);
- амиды пирофосфорной кислоты (октаметиамид и др.);
- эфиры фосфоновой кислоты (хлорофос).
Большинство ФОС – летучие вещества, тяжелее воды (d 1,1 – 1,7), хорошо растворимы в органических растворителях и плохо растворимы в воде (исключение: хлорофос).
Легко проникают через кожу, биологические мембраны. Под влиянием физических и химических факторов внешней среды ФОС претерпевают изомеризацию, трансалкилирование, в результате образуются более активные и токсические соединения (при хранении).
Поступают в организм всеми путями.
Всасывание начинается уже в полости рта, затем в желудке и тонком кишечнике. Препараты быстро проникают в кровоток и далее равномерно распределяются во всех органах и тканях. Несколько более высокие концентрации в почках, печени, легких, кишечнике.
Метаболизм:
- окислительная десульфурация (отщепление серы и замена ее на кислород); в результате образуются более токсичные соединения (в 10000 раз);
- окислительное деалкилирование, деарилирование;
- процессы восстановления в печени и почках – тот же результат (при дегидрохлорировании хлорофоса образуется дихлордивинилфосфон – более токсичное соединение).
В связи с этим более опасен пероральный путь поступления, когда препарат быстро поступает в печень.
Главный способ обезвреживания – ферментативный гидролиз. При этом липоидорастворимые соединения становятся водорастворимыми и удаляются почками.
Выделение: 20-25% через дыхание в неизменном виде; 30% с мочой; 50% метаболизируется в печени и выделяется с мочой.
По степени токсичности ФОС могут быть разделены на 4 группы:
- СДЯВ (LD50 <50 мг/кг): тиофос, метафос,октаметил;
- высокотоксичные (LD5050 – 200 мг/кг): метилмеркаптофос, фосфамид, дихлордивинилфосфон и др;
- вещества средней токсичности (LD50 200 – 1000 мг/кг): хлорофос, карбофос, метилнитрофос;
- вещества малой токсичности (LD50 >1000 мг/кг): гардона, винилфосфат, бромофос и др.
Смертельная доза для человека при приеме внутрь: метафос – 0,2 – 2 г, карбофос, хлорофос трихлорметафос – 5 – 10 г.
При ингаляционном пути смертельная концентрация 20 – 100 мг/м3.
Основной механизм токсического действия – нарушение каталитической функции холинэстеразы. Возникает расстройство обмена ацетилхолина.
Токсическое действие ФОС на нервную систему проявляется симптомами:
- повышенное потоотделении;
- бронхорея, спазм гладкой мускулатуры бронхов, кишечника, мышцы радужной оболочки глаза;
- развитие периферических параличей;
- судороги, расстройство сознания вплоть до комы.
Другие механизмы (нехолинергические) действия ФОС:
способность фосфорилировать некоторые белки, воздействовать на протеолитичские ферменты, изменять картину периферической крови, воздействовать на печень и пр. Эти механизмы играют основную роль при хронических поступлениях небольших доз, неспособных вызвать энергические реакции.
6.3 Клиника острых отравлений ФОС
Во всех случаях имеют место нарушения ЦНС, которые проявляются нарушениями психической активности и изменениями биоэлектрической активности мозга.
Нарушения периферической НС: подергивание мышц (лица, языка, конечностей), в тяжелых случаях – устойчивые волнообразные движения мышц.
Нарушение дыхания в 80 – 85% случаях вследствие повышенного истечения секрета (иногда до 1.5 литра) бронхиальных желез (бронхорея) с содержанием 8 – 10% белка, что дает вспенивание.
Нарушение со стороны ССС: гипертонический синдром, нарушение ритма и проводимости сердца, токсический шок ( летальность 60%).
Со стороны ЖКТ – спазм гладкой мускулатуры желудка и кишечника (тошнота, рвота, схваткообразные боли в животе, диарея).
Поражение печени обычно отсутствует(только при шоке как свойственное этому состоянию), но нарушена выделительная функция печени.
Почки – тоже (только при шоке).
Различают три стадии отравления:
- Возбуждение.
Через 15 – 20 мин. головокружение, головная боль, тошнота, снижение остроты зрения, боли в животе, повышенное АД.
- Гиперкинез и судороги.
Психомоторное состояние сменяется заторможенностью, иногда кома. Отсутствие реакции зрачков на свет, потливость, бронхорея, фибрилляция всех мышц, судороги, АД повышается до 250/160, затем падает СС деятельности. Диарея, жидкий стул.
- Параличи.
Развивается ЭШ.
Следует отметить, что со 2-х по 8-е сутки возможен рецидив интоксикации, что связано со вторичным падением активности холинэстеразы вследствие всасывания ФОС из кишечника.
Лечение отравлений
Лечение должно быть комплексным, включать антидотную терапию.
6.4.1 Методы выведения ядов и реанимационные мероприятия:
- при попадании на кожу – отмыть щелочным раствором;
- при ингаляции – на свежий воздух;
- при попадании в ЖКТ - промывание желудка через зонд (10 – 15 л холодной воды до чистых промывочных вод, затем вазелиновое масло 500 мл или MgSO4 ).
Во второй и третьей стадии отравления все это ежедневно до исчезновения симптомов.
Особенно эффективны – форсированный диурез, гемосорбция, гемодиализ. Перитонеальный диализ эффективен пока ФОС не депонировались в жировых тканях.
Длительность пребывания в крови: карбофоса – до 1 суток, метафоса – до 2 суток.
6.4.2 Антидотная терапия.
- холинолитики (типа атропина), дозы в зависимости от стадии отравления;
- реактиваторы холинэстеразы.
6.4.3 Реанимационная терапия.
Для ликвидации дыхательных и гемодинамических расстройств, судорог и психомоторного возбуждения.
Отравление соединениями тяжелых металлов и мышьяка
7.1 Общие токсикологические сведения
В группу тяжелых металлов входит более 40 элементов с высоким атомным весом и удельным весом более 6,0 (медь, кадмий, золото, железо, свинец, мышьяк и др.).
Органические и неорганические соединения тяжелых металлов и мышьяка используются во многих отраслях промышленности в качестве сырья или побочных продуктов, применяются в сельском хозяйстве как гербициды и инсектициды (гранозан идр.).
Соединения тяжелых металлов и мышьяка могут поступать в организм пероральным, ингаляционным путем, а также через кожу и слизистые оболочки, при парентеральном введении.
При пероральном отравлении эти соединения всасываются в ионизированном виде, чему способствует наличие хлоридов в желудочном соке и щелочная реакция кишечного сока. Основной участок всасывания – двенадцатиперстная кишка и начальный отдел тонкой кишки.
В крови тяжелые металлы циркулируют в виде ионов в комплексе с аминокислотами, жирными кислотами. Ведущую роль в транспорте тяжелых металлов играют белки, образующие с ними прочную связь.
Тяжелые металлы и мышьяк распределяются и депонируются в течение нескольких месяцев практически во всех органах. Эти вещества накапливаются в высоких концентрациях и длительно остаются в почках и печени, что объясняется высоким содержанием в почечной и печеночной ткани особого белка – металлобионина, богатого тиоловыми группами.
Выделение тяжелых металлов и мышьяка происходит через почки, печень (с желчью), слизистую оболочку желудка и кишечника (с калом), потовыми и слюнными железами, что сопровождается, как правило, поражением выделительных аппаратов этих органов.
Существует тесная связь между токсичностью металла и его физико-химическими свойствами. Токсичность возрастает с увеличением атомного веса металла, зависит от способности к диссоциации их комплексов с белками, от растворимости соединений в воде и липидах. Более медленная ионизация окислов делает их менее токсичными, чем соли тех же металлов.
Смертельная доза растворимых соединений ртути – 0,5г, каломели – 1-2 г, медного купороса – 10 г, ацетата свинца – 50 г, свинцовых белил – 20 г, бихромата калия – 3-8 г, мышьяка – 0,1-0,2 г. ПДК мышьякового водорода в воздухе – 0,3 мг/м3.
7.2 Механизм токсического действия
Механизм токсического действия соединений тяжелых металлов и мышьяка складывается из местного и резорбтивного действия. Местное лдействие проявляется в деструкции ткани и зависит от способности этих соединений к диссоциации.
В основе резорбтивного действия лежит блокирование функционально активных групп белков-ферментов и структурных белков. Наибольшее значение имеет блокирование сульфгидрильных (тиоловых) групп (SH), обеспечивающих биологическую активность более 50% белков-ферментов; блокируются также аминные, карбоксильные и другие группы. В результате потери протеидами многих физико-химических и биологических свойств нарушается белковый, углеводный и жировой обмен. Разрушается структура клеточных оболочек, что приводит к выходу из клетки калия и проникновению в нее натрия и воды
7.3 Симптомы отравления
Желудочно-кишечные поражения наблюдаются у 97.3% больных и обусловлены как прижигающим действием соединений тяжелых металлов и мышьяка, так и выделением их слизистыми оболочками рта и толстой кишки (выделительный стоматит и колит).
Субъективно желудочно-кишечные поражения проявляются металлическим вкусом во рту, тошнотой, болями при глотании, по ходу пищевода, болями в животе, локализующимися в эпигастральной области или носящими разлитой характер.
Объективно наблюдается рвота, гиперемия зева и задней стенки глотки, боль при пальпации шейного отдела пищевода, эпигастральной области, по ходу кишечника, чаще – в нисходящем отделе толстой кишки или разлитая болезненность при пальпации живота. В тяжелых случаях появляется повторный жидкий стул, у 22% больных в первые часы возникает пищеводо-желудочное и кишечное кровотечение.
Ожог слизистых оболочек желудочно-кишечного тракта наиболее часто отмечается при отравлениях соединениями ртути и меди и сопровождается тошнотой и рвотой. Резко выраженные симптомы гастроэнтерита, носящие холероподобный характер, появляются вследствие выраженного токсического действия мышьяка. Экзотоксический шок наблюдается у 25,7% больных и чаще встречается при отравлениях соединениями меди, хрома и мышьяка, сопровождающихся обширным ожогом пищеварительного тракта.
Токсическая энцефалопатия (у5,7% больных) наиболее характерна для отравлений соединениями мышьяка и свинца и проявляется эйфорией, психомоторным возбуждением или сопором, спутанностью сознания (оглушение) и комой.
Токсическая нефропатия развивается у 67,6% больных.
Токсическая дистрофия печени различной степени наблюдается в 51,4% случаев и обычно развивается на 1-3-и сутки, всегда в сочетании с нефропатией.
Токсическое поражение крови сопровождается гемолизом и анемией. Гемолиз наиболее характерен для отравлений мышьяковистым водородом и соединениями меди, отличается большой длительностью (до 6 сут).
Ингаляционные отравления парами ртути и органическими соединениями тяжелых металлов и мышьяка вызывают следующие психоневрологические симптомы: возбудимость, бессонницу, раздражительность, диплопию, затруднение глотания, нарушение тазовых функций (при отравлении гранозаном), депрессию или делирий, дезориентацию, ваготонию (при отравлении тетраэтилсвинцом), ртутный тремор и ртутный эритизм (при ингаляционных отравлениях парами ртути).
7.4 Методы детоксикации организма
1. Промывание желудка 2-3 раза в сутки с введением 50-100мл 5% раствора унитиола через зонд в начале и в конце промывания применяется для связывания невсосавшегося яда, для очищения желудочно-кишечного тракта – слабительные (касторовое или вазелиновое масло).
2. Форсированный диурез и ощелачивание плазмы при легких отравлениях являются эффективным способом детоксикации. При отравлениях средней и тяжелой степени этот метод дополняет методы искусственной детоксикации. Форсированный диурез проводится на фоне внутривенного введения 200-300 мл 5% раствора унитиола.
3. Активные методы искусственной детоксикации показаны при типичной клинической картине отравления, подтвержденной анамнестическими данными о приеме токсической дозы препаратов.
Высокая эффективность гемодиализа проявляется в ранний период токсикогенной фазы отравления – до 1-3 сут с момента приема яда (ранний гемодиализ).
Обязательным условием успешного гемодиализа является внутривенное капельное введение 5% раствора унитиола в течение всей операции.
Перитонеальный диализ менее эффективен, чем гемодиализ.
Отравление веществами прижигающего действия
Это в основном острые бытовые интоксикации.
Вещества, которые их вызывают:
- органические кислоты (уксусная, щавелевая);
- неорганические кислоты (соляная, азотная, серная);
- щелочи (NH4OH, NaOH, KOH);
- окислители (Н2О2, KМnO4).
8.1 Токсическое действие уксусной кислоты
Отравление возможно через дыхательные пути, кожу, ЖКТ. Обладает растворяющим действием на липоиды, поэтому легко попадает в клетки целой молекулой, внутри клетки диссоциирует, и далее идет перекисное окисление мембран и разрушение клеток. Токсичность прямо пропорциональна концентрации, LD уксусной эссенции – 50 мл.
Особенность патогенеза этих отравлений – развитие химического ожога в полости рта, глотки, пищеводе и желудке.
Некроз может захватывать не только слизистую, но и всю толщу подслизистого и мышечного слоев.
Разрушение клеточных мембран слизистой ЖКТ и клеточных мембран сосудистой стенки приводит к уменьшению массы циркулирующей крови.
Резкая гиперемия обожженной слизистой желудка и кишечника способствует проникновению уксусной эссенции в кровеносное русло. Следствие – гемолиз эритроцитов: низкомолекулярная фракция покидает эритроцит, а крупные молекулы (в основном белковые) разупорядочиваются и остаются в клетке. В клетку начинает поступать вода, оболочка растягивается до тех пор, пока не разорвется. При этом происходит выброс высокомолекулярных веществ (белков), которые образуют тромбы – начинается гиперкоагуляция.
Тромбы в мелких сосудах почек приводят к их разрыву, что вызывает поражение почек – острый гемоглобинурийный нефроз.
Все это, а также ЭШ приводит к поражению печени (очаговые некрозы, инфаркты). Могут быть желудочно–кишечные кровотечения, но они быстро проходят из-за гиперкоагуляции. ЭШ наблюдается в 37% случаев, с летальным исходом – 64,5%, токсическая нефропатия в 86,5% случаев, токсическая гепатопатия у 85% больных, нарушение внешнего дыхания, гнойные трахеобронхиты – у 51% больных.
В течении ожоговой болезни выделяют следующие стадии:
- стадия ЭШ - 1-1,5 суток;
- гипертермия, интоксикационные психозы 2 – 3 суток;
- инфекционные осложнения (от гастрита до перитонита) от 4 суток до 2 недель;
- ожоговая астения (потеря веса на 15-20 кг из-за нарушения белкового и электролитического баланса) – 3 недели;
- выздоровление.
8.2 Лечение при отравлениях уксусной кислотой
1. Удаление вещества в первые 6 часов. Промывание желудка через зонд холодной водой, одновременно вводят подкожно промедол, папаверин, атропин (для снятия спазма и болевого фактора). При ожоговом отеке слизистой пищевода используют буж, в качестве нейтрализующего средства может быть использована жженная магнезия или альмагель ( но не пищевая сода!).
2. Лечение болевого синдрома – наркотики, новокаин, глюкоза, альмагель с анестезином.
3. Лечение ЭШ – плазмозаменители: полиглюкин, глюкоза с инсулином; ощелачивание вводимой плазмы.
4. Лечение гемолиза
Глюкоза с 4% раствором гидрокарбоната натрия.
Форсированный диурез с мочевиной или маннитолом (только после устранения выраженных гемодинамических расстройств).
Инфузионная терапия.
5. Лечение коагулопатии – гепарин
6. При наличии ожоговых рубцов в пищеводе – бужирование
7. При желудочном кровотечении – гипотермия пищевода и желудка: подача холодной воды (40С) через зонд со скоростью – 0,6 л./мин., в течение 2 часов.
8. При ожоге верхних дыхательных путей – трахеостомия.


