ЗАБОЛЕВАНИЯ ПЕРЕДНЕЙ ДОЛИ ГИПОФИЗА
ГИПОФИЗ
АНАТОМИЯ
Гипофиз располагается в основании черепа в седловидной костной полости, называемой турецким седлом, которая является частью основной кости. Передний отдел седла состоит из лежащего по средней линии бугорка седла и передних отклоненных отростков, являющихся задними проекциями крыльев основной кости. Сзади седло ограничено спинкой седла,, боковые углы которого образуют задние отклоненные отростки. Крыша седла образована утолщенным выпячиванием твердой мозговой оболочки —диафрагмой седла, прикрепляющейся к отклоненным отросткам. Наружный слой твердой мозговой оболочки входит внутрь седла, образуя надкостницу гипофизарной ямки. Через отверстие в этой мембране, которая может быть несплошной или решетчатой, проходит ножка гипофиза с сопутствующими кровеносными сосудами (рис. 7—1).
Форма гипофиза варьирует от яйцевидной, когда поперечный диаметр превышает продольный, до полностью сферической. Конфигурация гипофиза определяется формой турецкого седла, что в придает размерам железы некоторую вариабельность. Отмечена также зависимость строения турецкого седла от возраста и пола. В связи с этим нередко принимаемые за норму размеры его 10х13х6 мм следует считать как средние. По рентгенологическим данным, средний объем гипофиза составляет около 600 мм3, хотя эта величина может существенно колебаться [1]. Масса гипофиза варьирует от 0,5 до 0,7 г, причем у женщин она несколько больше,. чем у мужчин. Во время беременности масса передней доли гипофиза, обычно составляющая 75% от массы всей железы, может увеличиваться вдвое.
КРОВОСНАБЖЕНИЕ И ИННЕРВАЦИЯ
Современные исследования с использованием сканирующей электронной микроскопии коррозионных препаратов сосудов наряду с прямыми наблюдениями за направлением кровотока по сосудам воротной системы и определением концентрации гипофизарных гормонов в них привели к пересмотру прежних представлений о кровоснабжении гипофиза. Гипофиз получает артериальную кровь из внутренних сонных артерий через анастомозирующую сеть ветвей виллизиева круга (артериальный круг большого мозга) и верхние средние и нижние артерии гипофиза (рис. 7—2). Эта сеть сосудов формирует уникальное воротное кровообращение, связывающее срединное возвышение и гипофиз. Ветви первых трех сосудов, анастомозируя друг с другом, образуют капиллярные петли (наружное сплетение) на внешней части срединного возвышения (воронка) и верхней части ножки гипофиза. Эти петли вместе с капиллярами из внутренних слоев срединного возвышения (внутреннее сплетение) переходят в несколько длинных воротных сосудов, которые пересекают ножку гипофиза, главным образом по ее передней поверхности и оканчиваются плотной сетью синусоидальных капилляров в передней доле гипофиза. Средние и нижние артерии гипофиза, обеспечивающие кровоснабжение ножки гипофиза и задней его доли, не проникают по пути в вещество передней доли. Таким образом, передняя доля гипофиза, очевидно, не имеет прямого артериального кровоснабжения, а вся артериальная кровь вначале проходит через сплетение воротных сосудов [2].

Рис, 7—1. Схематическое изображение расположения гипофиза человека по отношению к окружающим структурам. Подробное описание в тексте.
Венозный отток из гипофиза может происходить по нескольким путям. Редкие латеральные вены, по-видимому, не играют существенной роли в дренировании передней доли гипофиза. Другие вены сливаются с венами заднего гипофиза и направляются в пещеристый синус. Они, однако, имеют недостаточные размеры, чтобы обеспечить отток всей крови, поступающей в гипофиз. Венозная кровь переднего гипофиза поступает в капиллярное русло заднего гипофиза, которое соединяется как с длинными, так и с короткими воротными сосудами на задней части ножки гипофиза. В этих сосудах наблюдается ретроградный кровоток из заднего гипофиза в срединное возвышение, а концентрация гормонов передней доли гипофиза намного превышает их уровень в системной циркуляции. Таким образом, большая доля венозного оттока из аденогипофиза направляется, по-видимому, обратно в мозг по сосудам, идущим вдоль ножки гипофиза.

Рис. 7—2. Васкуляризация гипофиза обезьяны-резус (вид сзади), реконструированная по фотографиям коррозионных препаратов после внутривенного введения метил-метакрилата.
В — воронка: СВ — стебель воронки: 0В — отросток воронки- ГТ — гипоталамус-ВАГ — верхние артерии гипофиза; САГ — средняя артерия гипофиза- НАГ нижняя артерия гипофиза: ВСА — внутренняя сонная артерия, ДВВ — длинная воротная вена: КС — кавернозный синус. Можно видеть отсутствие прямого артеоиального кровоснабжения передней доли гипофиза и скудный венозный отток (только через ножку гипофиза (стебель воронки)
Кровоток, направленный из гипоталамуса в гипофиз, является основой воротно-сосудистой хемотрансмиттерной гипотезы гипоталамической регуляции функций передней доли гипофиза (см. главу 6). Ретроградный кровоток обеспечивает вероятный путь замыкания обратной гормональной связи переднего гипофиза с гипоталамусом. Кровоток в переднем гипофизе составляет 0,8 мл/г в 1 мин, что превышает кровоток во всех тканях млекопитающих.
Иннервация переднего гипофиза крайне скудна и представлена почти исключительно постганглионарными симпатическими волокнами, сопровождающими разветвления артериол и оканчивающимися на кровеносных сосудах. Однако существует мало доказательств изменения скорости кровотока в гипофизе при изменениях активности симпатической нервной системы. Описаны также нервные связи между задней и передней долями гипофиза, хотя их функция неизвестна.
ЭМБРИОЛОГИЯ ГИПОФИЗА
Анализ эмбриогенеза гипофиза во многом способствует пониманию анатомического распределения в нем клеток разного тина, развития различных врожденных аномалий, а также образования и направления роста гипофизарных опухолей. Железистая часть гипофиза— аденогипофиз — образуется из кармана Ратке, представляющего собой впячивание эктодермы верхнего отдела глотки, который в конце концов соединяется с выбуханием области III желудочка промежуточного мозга развивающегося эмбриона. Эта часть промежуточного мозга дифференцируется в нейрогипофиз или заднюю долю гипофиза. Тот участок кармана Ратке, который не контактирует с промежуточным мозгом, увеличивается, образуя переднюю долю гипофиза. На ранних стадиях развития два латеральных выроста ткани из передних долей сливаются по средней линии и распространяются вдоль ножки гипофиза. У животных некоторых видов эта структура, называемая туберальной частью, образует полный окружающий ножку чехол, но у человека она ограничена группой клеток, располагающихся вдоль передней области ножки гипофиза. Та часть кармана Ратке, которая непосредственно контактирует с нейрогипофизом, развивается менее интенсивно, чем противоположная стенка кармана, и образует промежуточную долю. У животных некоторых видов, например у крыс, эта доля и в зрелом возрасте сохраняется в виде отдельного анатомического образования, которое легко распознать. У человека же клетки промежуточной доли смешиваются с клетками передней доли и образуют объединенную структуру, называемую дистальной частью.
Клетки промежуточной доли, развиваясь, приобретают способность секретировать кортикотропин (АКТГ), меланоцитстимулирующий гормон (МСГ), липотропин и эндорфины, тогда как клетки передней доли начинают секретировать гормон роста (СТГ), пролактин, АКТГ, тиротропный (ТТГ), лютеинизирующий (ЛГ) и фолликулостимулирующий (ФСГ) гормоны. Недавно полученные при микрохирургическом удалении опухолей гипофиза данные свидетельствуют о том, что эмбриогенез клеток, вовлеченных в патологический процесс, в определенной степени позволяет предвидеть локализацию гормонально активных опухолей.
У человека полость кармана Ратке облитерирует, заполняясь развивающимся гипофизом. На границе нейрогипофиза могут сохраняться остатки этой полости в виде щели или небольших заполненных коллоидом кист, которые у детей выражены четче, чем у взрослых. Уже на очень ранней стадии развития врастание мезенхимы, образующей основную кость, нарушает контакт кармана Ратке с передней частью глотки. Однако даже у взрослых в основной кости или вблизи нее может сохраняться несколько клеток нижней части кармана, которые образуют так называемый глоточный гипофиз. Эти клетки содержат секреторные гранулы, в которых присутствуют по крайней мере СТГ и пролактин, причем не исключено, что в условиях удаления или разрушения дистальной части данная структура может обнаруживать заметную эндокринную функцию.
Закладка гипофиза у плода человека впервые выявляется на 4—5-й неделе беременности, причем его клеточная дифференцировка происходит очень быстро; базофильные клетки появляются на 7-й, а ацидофильные—на 9—10-й неделе. Дифференцируется и гипоталамус, где на 13-й неделе удается наблюдать флуоресценцию моноаминов в срединном возвышении, а вскоре развивается первичное сплетение воротных сосудов. К 20-й неделе гипоталамо-гипофизарная ось выглядит уже вполне зрелой.
Секреторные гранулы в гипофизе плода удавалось наблюдать уже в конце I триместра беременности, а уже на 7-й неделе иммунохимически определяются гормоны гипофиза. Имеются убедительные данные (заключающиеся главным образом в снижении массы надпочечников у анэнцефалов и деформации гениталий в связи с избыточной секрецией АКТГ и надпочечниковых андрогенов при адреногенитальном синдроме) о значении секреции гормонов передней доли гипофиза и ее регуляции со стороны ЦНС на ранних стадиях внутриутробного развития. Однако истинное функциональное созревание — это постепенно развивающийся феномен, причем многие аспекты регуляции по принципу обратной связи формируются только на протяжении постнатальной жизни.
ТИПЫ КЛЕТОК ГИПОФИЗА
Передний гипофиз состоит из клеток разных типов, в каждом из которых происходит преимущественный синтез, накопление и секреция особого гормона (гормонов). За последнее десятилетие широкое применение новых гистохимических реакций, электронной микроскопии и, что более важно, иммуноцитохимических методов исследования в корне изменило методы идентификации клеток передней доли гипофиза. Классические способы окраски, применявшиеся в течение многих лет, позволили выделить три типа клеток: ацидофильные, базофильные и хромофобные. Применение гистохимических красителей обнаружило глпкопротеиновую природу продуктов базофильных клеток, а комбинация методов позволила установить, что как базофилы, так и ацидофилы бывают клетками различных типов [4]. Было выделено не только два типа ацидофильных клеток, секретирующих СТГ и пролактин, но и несколько типов базофильных клеток. Считается, что бета1- и бета2-клетки секретируют ТТГ и АКТГ, a дельта1- и дельта2-клетки — ЛГ и ФСГ. Описаны также дельта3-клетки, но их функция неизвестна, и они могли бы являться стволовыми. Baker [5] тщательно сравнил методики, применяемые для морфологической характеристики клеток передней доли гипофиза. Однако с расширением использования комплексных гистохимических методов окрашивания применение букв греческого алфавита для обозначения разных типов клеток все более запутывало картину и в настоящее время не практикуется.
К другим недостаткам обычной световой микроскопии относится то, что с ее помощью часто бывает невозможно провести различия между неоднотипными хромофобными клетками, на долю которых приходится более половины клеток переднего гипофиза. Так, при световой микроскопии очень трудно отличить кортпкотропин-секретирующие клетки, гранулы которых слишком малы и рассеяны, чтобы их можно было увидеть, от клеток других типов, находящихся в состоянии активной секреции, когда они становятся дегранулированными. С помощью же электронной микроскопии удалось показать, что: 1 — секреторные гранулы и структура некоторых клеточных органелл, особенно эргастоплазмы, в клетках разного типа сильно варьируют; 2 — размеры секреторных гранул в клетках каждого типа могут существенно меняться в зависимости от функционального состояния клетки. Другим способом идентификации разных типов клеток явилась иммуноцитохимия с помощью антител, меченных пероксидазой, причем использование этого способа ограничивается только специфичностью применяемых антисывороток. Так, с помощью антисыворотки к лютеинизирующему гормону человека можно и не найти различий между гонадотрофами и тиротрофами, поскольку все три гликопротеиновых гормона обладают общей a-субъединицей (см. следующий раздел); в то же время антисыворотка к b-субъединице ЛГ должна быть специфичной именно для гонадотрофов, так как b-субъединпца ТТГ химически отличается от нее. К сожалению, функциональная морфология и иммуноцитохимия клеток не всегда совпадают, что порождает некоторую неопределенность в отношении надежности предложенных ранее классификаций, основанных на морфологических признаках. Далее приводится характеристика каждого из известных типов клеток в передней доле гипофиза.
Соматотрофы: клетки, секретирующие гормон роста
На обычных препаратах, окрашенных гематоксилин-эозином соматотрофы выглядят ацидофильными клетками, а при окраске крезазановым методом Ромейса они приобретают красный цвет. Секреция СТГ этими клетками впервые была заподозрена на том основании, что они преобладают в аденомах гипофиза у больных с акромегалией. Присутствие в них СТГ было подтверждено иммунофлуоресцентными и иммуноцитохимическими методами, а при электронной микроскопии в них обнаружили гранулы диаметром примерно 300—400 нм. Соматотрофы располагаются в основном в латеральных частях передней доли гипофиза.
Рис. 7—3. Иммуногистохимическое окрашивание лактотрофов здорового человека с применением антисыворотки к пролактину человека. Пролактиновые гранулы небольшого размера (средний диаметр 185 нм), которые кажутся черными, отличаются от неокрашенных гранул в правом верхнем и левом нижнем участках поля зрения. На врезке можно видеть, что иммунохимическая (пероксидаза-антипероксидаза) окраска выявляет лишь мелкие гранулы; остальные окрашиваются только тетраокисыо осмия (любезно предоставлено Т. Duello, Университет штата Колорадо).
Лактотрофы: пролактинсекретирующие клетки
Лактотрофы формируют второй тип ацидофильных клеток. Их можно отличить от соматотрофов по неравномерной и грубой зернистости, видимой под световым микроскопом, иному окрашиванию при использовании крезазановой методики и сродству к эритрозину красному при тетрахромовом методе окраски. Иммунологические методы с применением антисыворотки к пролактину человека подтвердили присутствие пролактина в секреторных гранулах, которые при электронной микроскопии имеют меньшие размеры, чем гранулы соматотрофов (рис. 7—3). Лактотрофы располагаются в латеральной части передней доли гипофиза, обычно периферичнее соматотрофов. У беременных и плода процент лактотрофов увеличивается, что отражает эффекты повышенного уровня эстрогенов. Увеличение размеров гипофиза при беременности практически целиком обусловлено пролиферацией лактотрофов.
Тиротрофы: ТТГ-секретирующие клетки
Эти клетки, интенсивно воспринимающие базофильную окраску и имеющие форму многогранника, локализуются преимущественно вокруг переднего края гипофиза вблизи средней линии, хотя могут обнаруживаться и в более глубоких слоях железы. Секреторные гранулы тиротрофов имеют меньшие размеры, чем гранулы сомато- и лактотрофов (диаметр их составляет 50—100 нм), и большую неоднородность в отношении плотности [7]. В условиях нормы на долю тиротрофов приходится около 6% клеток переднего гипофиза. Однако при первичном гипотиреозе («тиропривное» состояние) эти клетки подвергаются выраженной гипертрофии, и в них возникают характерные для повышенной секреторной активности ультраструктурные изменения, в том числе расширение эндоплазматической сети и гипертрофия пластинчатого комплекса. Число секреторных гранул резко уменьшается, что указывает на снижение внутриклеточных запасов гормона. Такие гистологические особенности клеток легко различимы и обусловили появление термина «клетки тиреоидэктомин». В условиях длительной недостаточности тиреоидных гормонов может наблюдаться и неопластическая трансформация [8, 9].
Гонадотрофы: ЛГ- и ФСГ-секретирующие клетки
Вначале считалось, что ЛГ и ФСГ продуцируются разными базофильными клетками. Однако в настоящее время, исходя из результатов иммуноцитохимических исследований с антисыворотками, специфичными по отношению к b-субъединицам разных гонадотропинов, большинство авторов полагают, что эти гормоны продуцируются одними и теми же клетками. Гонадотрофы расположены в глубине латеральной части передней доли гипофиза рядом с ацидофильными клетками. После хирургической кастрации наблюдается гиперплазия гонадотрофов и изредка формирование опухолей из них, тогда как при беременности в связи с продукцией хорионического гонадотропина число этих клеток уменьшается.
Кортикотрофы: АКТГ-секретирующие клетки
По вопросу о том, секретируются ли АКТГ и МСГ одними и теми же или разными клетками, существуют большие разногласия. Эти клетки или клеточные группы вначале относили к хромофобным, но позднее было показано, что по характеру своего окрашивания они являются базофильными. С помощью антисыворотки к антигенным детерминантам АКТГ, отсутствующим в молекуле МСГ, было показано, что кортикотрофы эмбриологически происходят из промежуточной доли гипофиза, но чаще всего перемещаются в срединную мукоидную область передней доли. Другая группа кортикотрофов в процессе развития, по-видимому, мигрирует в те участки задней доли, которые контактируют с передней долей и туберальной частью. При ультраструктурных исследованиях обнаружили сильно варьирующие по размерам гранулы. Клетки, локализующиеся в передней доле, имеют скудную зернистость, они сравнительно плохо окрашиваются, тогда как кортикотрофы, лежащие в промежуточной и задней долях, содержат очень крупные и электронно-плотные гранулы. В настоящее время можно считать, по-видимому, что не только МСГ и АКТГ, но и b-эндорфин присутствуют в одних и тех же клетках; это может объяснить частую согласованность изменений уровней указанных гормонов в крови в условиях изменения функции коры надпочечников. Недавно полученные доказательства существования общего предшественника этих гормонов делают понятным их присутствие в одной и той же клетке [11].
В условиях повышенного содержания глюкокортикоидов, будь то эндо- или экзогенных, кортикотрофы дегранулируют и в них происходит гиалинизация микротрубочек, известная под названием гиалнновой дегенерации Крука. Участки отложения гиалина теряют способность связывать антитела к АКТГ. При недостаточности функции надпочечников число скудно гранулированных базофильных клеток в передней доле гипофиза увеличивается, тогда как число интенсивно окрашивающихся базофильных клеток промежуточной и задней доли уменьшается, что указывает на физиологическое значение первых (а не вторых) для секреции АКТГ.
Прочие типы клеток
В зависимости от методики окрашивания число хромотрофных клеток в передней доле гипофиза, видимое под световым микроскопом, варьирует от 15 до 40%. Многие из этих клеток в зависимости от красителя напоминают либо базофилы, либо ацидофилы и получили название амфофилов. Хотя при электронной микроскопии в них может обнаруживаться небольшое число секреторных гранул, пока не удалось установить какую бы то ни было их роль в секреции гормонов. Возможно, что они представляют собой активно секретирующие или даже покоящиеся дегранулированные клетки, но не исключено, что они являются недифференцированными примитивными секреторными клетками. Клетки этого типа присутствуют в гиперсекретирующих опухолях гипофиза.
Подобно этому при иммуноцитохимическом окрашивании антителами ко всем известным гипофизарным гормонам клетки аденогипофиза в значительном проценте случаев остаются неокрашенными. Некоторые из этих клеток могли бы секретировать какие-то другие, пока не охарактеризованные гипофизарные гормоны, такие, как фактор роста яичников, экзофтальмический фактор или диабетогенный полипептид.
Наконец, небольшое число клеток имеет звездчатую форму, располагается в виде структур, напоминающих примитивные фолликулы, а их отростки часто оканчиваются в периваскулярных пространствах. Секреторные гранулы в них встречаются редко, и их функция также не установлена.
ГОРМОНЫ ПЕРЕДНЕЙ ДОЛИ ГИПОФИЗА
Существует 6 гормонов передней доли гипофиза с установленной структурой, известной функцией и точными методами определения каждого из них в тканях и биологических жидкостях. Эти гормоны имеют полипептидную природу и могут быть подразделены на три основные категории, каждая из которых обладает своеобразными особенностями: семейство кортикотропина (АКТГ, МСГ, липотропин и близкие пептиды), гликопротеиновые гормоны (ЛГ, ФСГ, ТТГ и сходный с ними хорионический гонадотропин) и соматомаммотропные гормоны (СТГ, пролактин и сходный с ними плацентарный лактоген). Сравнение химических характеристик этих гормонов приведено в табл. 7—1.
Пептиды, родственные кортикотропину
Химия
Адренокортикотропный гормон (кортикотропин, АКТГ) представляет собой одноцепочечный пептид, состоящий из 39 аминокислот. У животных всех изученных до сих пор видов 24Г -концевые аминокислоты (конец молекулы, содержащий свободную аминогруппу, которая традиционно считается занимающей положение 1) одинаковы, но на С-конце (конец молекулы, содержащий свободную карбоксильную группу) имеются видовые различия, хотя, как правило, и небольшие. Биологическая активность определяется N-концевой частью, состоящей из 18 аминокислот, присутствие которых необходимо для полной биологической активности. Однако быстрое разрушение AKTГ1-18 in vivo требует более длинной аминокислотной последовательности, а именно AKTГ1-24, чтобы обеспечить биологическую активность гормона у человека.
Часть молекулы АКТГ входит в состав близких пептидов. Два из них являются фрагментами АКТГ: a-меланоцитстимулирующий гормон (a-МСГ), идентичный AKTГ1-13 с ацетилированным N-концом, и кортикотропинподобный пептид промежуточной доли (КПППД), идентичный АКТГ18-39. Кроме того, в состав b-липотропина (бета-ЛПГ) входит гептапептидная последовательность (бета-ЛПГ47-53), идентичная АКТГ4-10. Эта последовательность присутствует также в нескольких пептидах, являющихся фрагментами b-ЛПГ: g-ЛПГ (бета-ЛПГ1-38) и b-МСГ (бета-ЛПГ41-58). Строение этих пептидов представлено на рис. 6—8.
У животных тех видов, у которых промежуточная доля достигает более полного развития (например, у крысы, овцы) в основном обнаруживаются а-МСГ и КПППД. В гипофизе человека они выявляются только в период внутриутробной жизни, когда отчетливо представлена промежуточная доля. Гипофиз синтезирует b-ЛПГ, который содержит структуры g-ЛПГ, b-МСГ и b-эндорфина. В гипофизе человека найдены b-ЛПГ, g-ЛПГ и b-эндорфин, но b-МСГ до сих пор не обнаружен. Ранее высказываемые предположения о присутствии химически обособленного b-МСГ (содержащего 22-аминокислотную последовательность) оказались неверными и были связаны с посмертным протеолизом в ходе экстракции, применяемой для очистки этого вещества. Кроме того, было показано, что иммунологическая реактивность, приписываемая b-МСГ в плазме человека и определяемая обычно с помощью антител к неочищенному АКТГ, которые могут перекрестно реагировать с b-ЛПГ, имеет молекулярный размер, совпадающий с таковым b-ЛПГ и/или g-ЛПГ [12]. Истинный b-МСГ присутствует, по-видимому, только у тех видов животных, у которых существует отдельная промежуточная доля гипофиза.
Биосинтез
Исследования биосинтеза АКТГ в интактном гипофизе крупного рогатого скота и в клетках опухоли гипофиза мыши показали, что этот гормон образуется как часть крупной молекулы предшественника с молекулярной массой около 29000 [13] (рис. 7—4). Это вещество содержит углеводный компонент [14], и небольшие колебания его молекулярной массы, наблюдаемые некоторыми исследователями, обусловлены, вероятно, различиями в содержании углевода, а не аминокислот. Присутствие углевода в молекуле предшественника АКТГ помогает понять базофильное окрашивание АКТГ-секретирующих клеток. Предшественник постепенно расщепляется, образуя молекулы в 21 000 и 4500 дальтон, причем последняя представляет собой 39-аминокпслотный мономер. Недавно проведенные на бесклеточных белоксинтезирующих системах исследования показали, что соединение с молекулярной массой 29 000 дальтон служит предшественником и 91-аминокислотного b-ЛПГ. Таким образом, данные об идентификации АКТГ и МСГ н даже b-ЛПГ в одной и той же клетке с помощью нммуноцитохимических методик с антителами к неперекрывающимся частям молекулы могут объясняться присутствием общего предшественника. Пока не выявлены специфические ферменты (эндопептидазы), ответственные за расщепление предшественника, вопрос о том, действительно ли все молекулы меньших размеров (т. е. рассматриваемые далее АКТГ, b-ЛПГ, а также эндорфины и энкефалины) присутствуют в отдельной клетке в качестве обособленных форм, может быть решен лишь гипотетически. Очевидно также, что общпй гептапептид (АКТГ4-ю) должен располагаться по крайней мере в двух разных участках молекулы предшественника, поскольку последовательности АКТГ и b-ЛПГ не перекрываются.

Рис. 7—4. Путь биосинтеза гормонов, родственных АКТГ и b-ЛПГ. Единая иРНК направляет трансляцию полипептида-предшественника, содержащего аминокислотную последовательность N-концевого фрагмента (предположительно являющегося гормоном, но функция которого пока не установлена), АКТГ, a-, b- и g-меланоцитстимулирующего гормона (g-МСГ), кортикотропинподобного пептида промежуточной доли КПППД (АКТГ18-38), b-ЛПГ, метэнкефалина и b-эндорфина. По мере синтеза этого белка-предшественника он гликозилируется (показано черными кружками). Последовательность «сигнального пептида», необходимая для трансляции и проникновения белка-предшественника в эндоплазматический ретикулум, отщепляется. Таким образом, наиболее рано определяемая в клетке форма молекулы имеет молекулярную массу около 29000 и содержит углевод в указанных положениях. Эта молекула затем подвергается дополнительным процессам гликозилирования, которое может происходить либо на N-концевом фрагменте (левая часть рисунка), либо на ее участке, содержащем последовательность АКТГ (правая часть рисунка), образуя формы с молекулярной массой 34000 и 32000. Белые кружки обозначают последующую модификацию углеводной боковой цепи. Первый протеолитический этап включает отщепление b-ЛПГ от С-концевого участка предшественника; b-ЛПГ может затем превращаться в b-эндорфин. Хотя b-эндорфин содержит аминокислотную последовательность и мет-энкефалина, продукция этого пептида в гипофизе не показана. Протеолиз фрагментов, остающихся после отщепления b-ЛПГ, приводит к отщеплению N-концевого участка, молекулярная масса которого зависит от содержания в нем сахара, и к образованию АКТГ, который также присутствует в гликозилированной (13000 дальтон) и негликозилированной (4500 дальтон) формах [Herbert Е. и соавт. — In. Martini L., Ganong F. (eds), Frontiers in Neuroendocrinology.—New York, Raven Press (в печати)].
АДРЕНОКОРТИКОТРОПНЫЙ ГОРМОН
Действие
Главное свое действие АКТГ оказывает на кору надпочечников, где он стимулирует секрецию глюкокортикоидов, минералокортикоидов и андрогенных стероидов. АКТГ связывается со специфическими, обладающими высоким сродством, рецепторами на мембранах клеток коры надпочечников и стимулирует стероидогенез, ускоряя превращение холестерина в прегненолон с помощью аденилатциклазного механизма. АКТГ стимулирует и синтез белка, что приводит к гипертрофии и гиперплазии клеток коры надпочечников.
Вненадпочечниковые эффекты
Помимо своего влияния на надпочечники, АКТГ оказывает липолитическое действие на жировую ткань, а также гипогликемическое действие, относимое за счет прямого инсулинвысвобождающего эффекта АКТГ на b-клетки поджелудочной железы. Большие дозы АКТГ стимулируют секрецию СТГ, ускоряют транспорт глюкозы и аминокислот в мышечные клетки и у гипофизэктомированных животных препятствуют разрушению кортизола в печени, в силу чего период полужизни этого гормона в плазме увеличивается. Если не принимать во внимание больных с АКТГ-секретирующими опухолями гипофиза, очень мало вероятно, чтобы уровень АКТГ в плазме когда-либо мог оказаться достаточным для воспроизведения этих эффектов.
Давно известно влияние АКТГ на пигментацию. Поскольку АКТГ в качестве агента, вызывающего дисперсию меланина, менее эффективен, нежели a-МСГ или b-МСГ, считалось, что он принимает относительно небольшое участие в патогенезе гиперпигментации, наблюдаемой в состояниях, характеризующихся значительной его гиперсекрецией, например при аддисоновой болезни и АКТГ-секретирующпх опухолях гипофиза (синдром Нельсона) (табл. 7—2). Однако в свете недавно полученных данных об отсутствии у человека как a-МСГ, так и b-МСГ роль АКТГ вполне может быть большей, чем предполагалось ранее. Действительно, даже b-ЛПГ может существенно усиливать пигментацию в условиях заметного повышения его уровня в крови, например при почечной недостаточности (см. далее) [15].
Таблица 7—2. Влияние АКТГ и близких пептидов на пигментацию
|
Гормон |
Эффективность |
|
a-МСГ |
100 |
|
бета-МСГ |
50 |
|
АКТГ |
1 |
|
a-ЛПГ |
0,5 |
|
бета-ЛПГг |
0,2 |
Определение
Биологические методы. Вначале для .определения АКТГ применяли методы, предполагающие регистрацию изменений уровня кортикостерона в надпочечниках, плазме венозной крови, оттекающей от надпочечников, или плазме периферической крови у гипофизэктомированных крыс или животных с нейрофармакологической блокадой гипофиза. Чувствительность определений удалось повысить путем разработки методов in vitro, в которых вначале применялась инкубация V4 части надпочечников крыс, а позднее — изолированных адренокортикальных клеток в свежей культуре. Хотя последняя система в силу трудности получения все еще применяется главным образом в научно-исследовательских целях, но она достаточно чувствительна для определения тех уровней АКТГ, которые присутствуют в плазме здорового человека [16].
Поскольку в обычных условиях уровень кортизола в плазме прямо связан с уровнем АКТГ, определение кортизола служит очень удобным способом биологического тестирования АКТГ при нормальной функции коры надпочечников. С практической точки зрения, определение уровня кортизола в плазме, будь то флуорометрическим, белковосвязывающим или радиоиммунологическим методом, оказывается менее дорогим и, как правило, более легко доступным способом оценки АКТГ-функции гипофиза.
Радиоимммунологпческпе методы. Метод радиоиммунологического определения АКТГ в плазме разрабатывался дольше, чем соответствующие методы для других гормонов передней доли гипофиза. Это было связано с некоторыми техническими трудностями, обусловленными низкой концентрацией АКТГ в плазме, относительно слабой антигенностью этого гормона и его подверженностью разрушению присутствующими в плазме пептидазами [17]. Кроме того, существование семейства пептидов, обладающих частичной структурной гомологией (т. е. гептапептидом), без тщательной характеристики антисыворотки и доказательства ее реакции с уникальными структурными детерминантами АКТГ оставляло открытым вопрос о специфичности метода его определения. Несмотря на все эти трудности, радиоиммунологическое определение АКТГ становится все более надежным и приносит все большую пользу в диагностике и контроле за лечением отдельных нарушений секреции этого гормона.
Прочие методы. Разработан радиолигандный, или радиорецепторный, метод определения АКТГ, в котором используются частично очищенные мембраны клеток коры надпочечников и чувствительность которого почти равна чувствительности радиоиммунологического метода [18]. Технические трудности этого метода препятствуют его применению для рутинных определений уровней АКТГ в плазме. Описан также изящный цитохимический метод определения АКТГ [19], основанный на регистрации денситометрических сдвигов, ферментативно сопряженных с вызываемым АКТГ снижением содержания аскорбата в срезах надпочечников морских свинок. Этот метод намного чувствительнее других, и с его помощью удается определять гормон в концентрации 5 фг/мл (5•10~15 г/мл), причем он обладает и прекрасной специфичностью. Однако сложность этого метода ограничивает его применение рамками научно-исследовательских задач.
Уровень гормона в гипофизе и плазме
В гипофизе человека присутствуют лишь небольшие количества АКТГ: примерно 50 ЕД, или 0,6 мг. Содержание АКТГ в плазме здорового взрослого человека колеблется от менее 10 пг/мл (нижняя граница чувствительности радиоиммунологического метода, по данным большинства лабораторий) до 50—80 пг/мл. АКТГ секретируется эпизодически и, кроме того, в соответствии с четким суточным ритмом. Наименьший уровень АКТГ в плазме регистрируется вечером (20—23 ч), а наибольший—ранним утром (5—8 ч). Динамика содержания кортизола в плазме совпадает с колебаниями уровня АКТГ, отставая от них на небольшой промежуток времени. В условиях стресса содержание АКТГ может в 10 раз превышать нормальные величины. Не вся иммунореактивность АКТГ, определяемая в плазме даже с помощью специфических антител, обусловлена мономером АКТГ. В частности, у больных со злокачественными новообразованиями выявляются формы этого гормона, имеющие большие молекулярные размеры («большой» АКТГ [20]); считают, что они являются молекулами-предшественниками.
Метаболизм
Хотя АКТГ избирательно связывается корой надпочечников, но исчезновение основной массы гормона из циркуляции определяется другими механизмами, в том числе внутрисосудистым ферментативным разрушением. Скорость исчезновения из плазмы (период полужизни) варьирует в зависимости от того, определяют АКТГ биологическим или радиоиммунологическим методом, причем биологически активный гормон исчезает из плазмы быстрее (период полужизни 3—9 мин), чем иммунореактивный (период полужизни 7—12 мин) [21]. Учитывая скорость исчезновения, приравнивая распределение в тканях распределению во внеклеточном пространстве и принимая уровень в плазме за 25 пг/мл, можно рассчитать, что скорость секреции АКТГ составляет 25 мкг/сут, т. е. примерно 5% от его содержания в гипофизе.

Рис. 7—5. Согласованная секреция АКТГ и кортизола в ранние утренние часы. Можно видеть, что изменения уровня кортизола в плазме следуют за изменениями уровня АКТГ с относительно коротким латентным периодом (Gallagher Т. R. и соавт. J. Clin. Endocrinol. Metad., 1973 36, 1058).
Регуляция секреции
В регуляции секреции АКТГ существуют три основных компонента: собственная суточная ритмичность (рис. 7—5), замкнутый контур обратной связи, которая реагирует на изменение уровня кортизола в циркуляции, и «открытый контур» регуляции, связанный со множеством опосредуемых нервной системой стимулов, обычно называемых стрессорными.
АКТГ секретируется пульсирующими вспышками, что отражает характер регуляции его секреции со стороны нервной системы. Суточную ритмичность можно наблюдать в отношении секреции как АКТГ, так и кортизола, уровни которых достигают максимума примерно ко времени нормального пробуждения, а затем постепенно снижаются до минимума, регистрируемого ближе к полуночи. Извращение нормального цикла сон — бодрствование влечет за собой соответствующее изменение суточной динамики секреции АКТГ. В связи с этим чувствительность системы гипоталамус— гипофиз—надпочечники к стимуляции наиболее высока поздно вечером и наиболее низка утром.
Закрытый контур обратной связи в регуляции секреции АКТГ опосредуется главным образом кортизолом, который оказывает тормозящее влияние как на ЦНС, так и на гипофиз. Стимуляция оси гипоталамус—гипофиз—надпочечник, которая возникает при снижении уровня кортизола в циркуляции, зависит как от абсолютного содержания гормона, так и от скорости его изменения. Электрофизиологические исследования, а также результаты изучения связывания кортизола свидетельствуют о вероятном существовании как гипоталамических, так и внегипоталамических мест замыкания обратной связи, в которых кортизол подавляет высвобождение кортикотропин-рилизинг фактора (КРФ). Кроме того, кортизол оказывает тормозящее действие на гипофиз, подавляя реакцию кортикотрофов на КРФ. Имеющиеся в настоящее время данные не позволяют сделать окончательного заключения в отношении сравнительной роли центрально-нервной и гипофизарной точки приложения действия кортизола по механизму обратной связи в физиологической регуляции секреции АКТГ.
Открытый контур этой регуляции включает разнообразные стимулы, которые укладываются в понятие физического или эмоционального стресса, например, боль, лихорадку, тревогу, депрессию и гипогликемию. Входы всех этих стимулов, несомненно, различны, но все они приводят к высвобождению КРФ. Хотя ни один из подобных стимулов неспецифичен в отношении АКТГ (некоторые из них, например, приводят к секреции гормона роста и/или пролактина), но реакция АКТГ опосредуются отдельными нервными путями и часто возникают в отсутствие реакций других гипофизарных гормонов. Уровень кортизола в крови в очень слабой степени влияет на эти реакции, хотя при длительном введении больших доз глюкокортикоидов они могут оказаться подавленными, В периоды стресса часто исчезают и суточные колебания секреции АКТГ. Нейроэндокринная регуляция секреции АКТГ более подробно обсуждалась в главе 6.
b-ЛПГ, МСГ И РОДСТВЕННЫЕ ПЕПТИДЫ
Накопление данных о том, что иммунореактивный b-МСГ в гипофизе и плазме человека на самом деле является не пептидом, состоящим из 22 аминокислот, как полагали ранее, а более крупной молекулой (бета-ЛПГ, гаммa-ЛПГ или .комбинацией того и другого), требует пересмотра представлений об уровне b-МСГ в плазме. Кроме того, применение антисывороток, реагирующих только с гаммa-ЛПГ, но не с b-ЛПГ, внесло путаницу в представления о динамике секреции и этих пептидов. Современные данные [22, 23] свидетельствуют о том, что ЛПГ присутствуют в сыворотке здорового человека в концентрации от 10 до 40 пг/мл, что динамика их секреции может тестироваться с помощью тех же стимулов, которые применяются для оценки секреции АКТГ (инсулиновая гипогликемия, метопирон, вазопрессин), и что в ответ на .каждый из этих стимулов АКТГ и липотропины секретируются, вероятно, в эквимолярных соотношениях. Эти наблюдения могут объясняться существованием одной молекулы предшественника, содержащей в своем составе как АКТГ, так и ЛПГ, которая подвергается ферментативному расщеплению либо непосредственно перед секрецией, либо по ходу самого секреторного процесса.
При двух патологических состояниях наблюдалась диссоциация уровней АКТГ и ЛПГ. У больных, находящихся на поддерживающем гемодиализе, было обнаружено повышение уровней ЛПГ—МСГ, что коррелировало как со степенью пигментации, так и с продолжительностью диализа [15]. Эта диссоциация вполне могла бы объясняться стабильностью ЛПГ (в отличие от АКТГ) в плазме, т. е. отсутствием его внутрисосудистого ферментативного разрушения, и значительным замедлением его клиренса при хронической почечной недостаточности. Отсюда следует также, что ЛПГ оказывает, вероятно, относительно слабый тормозной (по механизму обратной связи) эффект как на собственную секрецию, так и на секрецию АКТГ. У больных с аддисоновой болезнью или синдромом Нельсона острое введение гидрокортизона снижает уровень ЛПГ в гораздо меньшей степени, чем уровень АКТГ, что опять-таки отражает различие в скоростях метаболического клиренса этих соединений [24].
ЭНДОРФИНЫ И ЭНКЕФАЛИНЫ
Открытие в синаптосомах мозга человека рецепторов, стереоспецифически связывающих опиаты, обусловило поиски «эндогенных опиатов» и привело к выделению [26] двух пентастептидов — лейэнкефалина и мет-энкефалина, причем структура первого из них оказалась идентичной b-ЛПГ61-65. Затем несколько большие по размерам пептиды, обладающие опиатной активностью, были обнаружены в гипофизе [27], в котором удалось идентифицировать три таких пептида [28, 29] — a-, b- и g-эндорфины; каждый из них частично или полностью содержит С-концевую последовательность b-ЛПГ, начиная с 61-го остатка (см. рис. 6—8). Исходя из данных о расщеплении b-ЛПГ гипофизарными ферментами, этот гормон считают предшественником эндорфинов; в то же время отсутствие аналогичных ферментов в головном мозге, а также различия в анатомическом распределении эндорфинов и энкефалинов в пределах отдельных областей мозга и гипофиза не позволяют считать эндорфины предшественниками энкефалинов. В гипофизе b-эндорфин локализуется главным образом в клетках промежуточной доли и в .меньшей степени в аденогипофизе, причем с помощью иммуногистохимических методик удалось показать его присутствие в тех же клетках, которые содержат АКТГ.
Разработаны методы радиоиммунологического определения b-эндорфина, в результате использования которых было показано, что в некоторых условиях, например после введения метопирона [30], а также у больных аддисоновой болезнью и с синдромом Нельсона [31], этот пептид секретируется в кровь параллельно
АКТГ
Физиологическая роль гипофизарных эндорфинов остается неясной. При системном введении в дозах, намного повышающих их эндогенный уровень, эти пептиды не оказывают аналгезирующего действия, а изменения болевой чувствительности (гипалгезия) не характерны для клинических состояний, сопровождающихся гиперсекрецией b-эндорфина. Не исключено, однако, что его влияние на функцию ЦНС обусловлено непосредственным попаданием в мозг по системе воротных сосудов гипофиза.
ПЛАЦЕНТАРНЫЙ АКТГ
В течение многих лет считалось, что плацента секретирует гормон, обладающий-АКТГ-подобной активностью. Такое допущение позволяло объяснить повышение содержания кортизола в плазме при беременности и особенно при приближении родов. Недавняя публикация [25] указывает на действительное присутствие хорионического кортикотропина в экстрактах плаценты, причем удалось показать, что он образуется в первичной культуре ткани плаценты. Такой внегипофизарный источник АКТГ, нечувствительный к нормальному механизму обратной связи, мог бы объяснять наблюдаемое при беременности повышение уровня кортизола (что в настоящее время относят за счет увеличения концентрации кортизолсвязывающего глобулина), резистентное к подавляющему эффекту дексаметазона.
Гликопротеиновые гормоны
Химия
К гликопротеиновым гормонам гипофиза относятся тиротропный (тиротропин, ТТГ), лютеинизирующий (ЛГ) и фолликулостимулирующий (ФСГ) гормоны. В силу структурного и биологического сходства с ЛГ в эту группу включают и плацентарный хорионический гонадотропин (ХГ).
Гликопротеиновые гормоны состоят из двух субъединиц —а в бета, каждая из которых содержит пептидное ядро и разветвленные углеводные боковые цепи, определяющие 15—30% молекулярной массы гормона. Сахара включают фукозу, галактозу, галактозa-мин, маннозу и сиаловую кислоту, присутствие которой необходимо для сохранения биологической активности гормона. Сиаловая кислота уменьшает скорость метаболизма гликопротеиновых гормонов, но, вероятно, не участвует в процессе их распознавания рецепторами клеток-мишеней.
В пределах одного вида, в том числе у человека, все Гликопротеиновые гормоны содержат одну и ту же или очень сходную a-субъединицу, тогда как b-субъединицы этих гормонов различаются, придавая им биологическую специфичность. Однако в пределах вида существует значительная гомология и b-субъединиц; например, 50% аминокислот в составе бычьей b-субъединицы ТТГ и b-субъединицы ЛГ либо идентичны, либо отличаются лишь на столько, на сколько это может определяться изменением всего одной пары оснований в генетическом коде [ 32]; ХГ человека содержит ЛГ-бета и дополнительно 30 аминокислотных остатков на С-конце [33, 35]. Как a-, так и b-субъединицы обладают и выраженной межвидовой гомологией: a-субъединицы ТТГ человека и быка идентичны на 70%, а b-субъединицы соответствующего гормона—на 90% [36]. Не удивительно поэтому, что Гликопротеиновые гормоны не обладают видовой специфичностью и что гормоны крупного или мелкого рогатого скота проявляют биологическую активность у человека. Порознь субъединицы лишены биологической активности интактного гормона, хотя не исключено, что им присуща своя собственная активность. Биологическое действие гормона определяет именно b-субъединица, так как ее объединение почти с любой гомологичной пли гетерологичной a-субъединицей приводит к образованию гибридной молекулы, обладающей биологической активностью гормона.
Препараты ЛГ из отдельных гипофизов несколько различаются, что связано, по-видимому, с различиями углеводных компонентов (микрогетерогенность}. Некоторые исследователи предполагают, что характер секретируемого гликопротеина (с различным углеводным компонентом, обусловливающим разную биологическую активность) может меняться в зависимости от эндокринной среды. Хотя и предполагалась возможность секреции измененных форм того или иного гликопротеинового гормона, но доказательства этого при любом специфическом нарушении секреции этих гормонов не получены (см. далее).
Биосинтез
Считается, что линейные пептидные последовательности субъединиц гликопротеинов синтезируются отдельно, а углеводный компонент присоединяется после завершения синтеза пептидной цепи. Поскольку концентрация свободной a-субъединицы в гипофизе намного превышает уровень b-субъединицы, полагают, что синтез гликопротеиновых гормонов регулируется главным образом на этапе синтеза b-субъединицы.
ТИРОТРОПНЫЙ ГОРМОН
Действие
Влияния ТТГ на щитовидную железу в значительной мере аналогичны таковым кортикотропина на кору надпочечников. После связывания тиротропина с рецепторами клеточной мембраны, обладающими высоким сродством, стимулируется аденилатциклаза, что приводит к повышению содержания цАМФ, ускорению транспорта йода и его связывания белком, увеличению синтеза тироглобулина и тиреоидных гормонов и усилению протеолиза тироглобулина с высвобождением тиреоидных гормонов. Кроме того, стимулируется синтез РНК и белка, что приводит к увеличению размеров и кровоснабжения щитовидной железы. Подробнее эффекты ТТГ обсуждаются в других публикациях.
Определение
Биологические методы. Широко применяемый биологический метод Маккензи основан на регистрации высвобождения радиоактивно меченных тиреоидных гормонов щитовидной железой мыши в кровь. Хотя это весьма полезный метод и именно он позволил впервые обнаружить длительно действующий тиреоидный стимулятор (LATS или тиреоидстимулирующие иммуноглобулины), все же он относительно мало чувствителен и не дает возможности количественно оценить уровень ТТГ в плазме здорового человека. Радиолигандный метод и особенно цитохимический метод определения ТТГ обладают большей чувствительностью, позволяющей измерять количество гормона в плазме, причем данные, получаемые с помощью этих методов, согласуются с результатами использования радиоиммунологического определения. Однако в силу технических трудностей цитохимическое определение в настоящее время все еще остается процедурой, применяемой только в научно-исследовательских целях.
Радиоиммунологические методы. Разработка специфических радиоиммунологических методов определения ТТГ позволила определять содержание гормона в плазме. Наиболее надежные антитела к ТТГ направлены к антигенным детерминантам его b-субъединицы и поэтому практически не дают перекрестной реакции с другими гликопротеиновыми гормонами. В настоящее время радиоиммунологический метод служит средством выбора для рутинных клинических анализов. Разработаны и радиоиммунологические методы определения свободной a-субъединицы, а также ТТГ-бета, которые обнаруживают весьма незначительную перекрестную реактивность по отношению к интактному гормону, что позволяет получать данные о содержании свободных субъединиц в гипофизе и плазме.
Уровень гормона в гипофизе и плазме
Гипофиз. Содержание ТТГ в гипофизе, судя по результатам биологических определений, составляет приблизительно 0,4 ME [ 37]. Хотя основная масса ТТГ накапливается в виде интактного гормона, в гипофизе присутствуют также свободные a-субъединица и ТТГ-бета, причем концентрация первой превышает уровень второй. Обнаружение свободных субъединиц в крови больных гипотиреозом, а также их появление в ответ на введение ТРГ свидетельствует о присутствии в тиротрофах по крайней мере некоторого количества свободной a-субъединицы; остальное ее количество локализуется в гонадотрофах [37, 38].
Плазма. По мере повышения сродства и специфичности антисывороток к гормону приходилось неоднократно пересматривать данные о содержании иммунореактивного ТТГ в плазме здорового человека, свидетельствующие о снижении его уровня. В результате границы нормальных колебаний уровня ТТГ, устанавливаемые в разных лабораториях, неодинаковы. По данным большинства лабораторий, верхняя граница нормы составляет 6 мкЕД/мл, хотя в одних из них нормой считают и 10 мкЕД/мл, а в других — не выше 3 мкЕД/мл. Средний уровень ТТГ в плазме, по данным цитохимического метода, менее 1 мкЕД/мл [39]. По данным большинства определений, у некоторых здоровых людей уровень ТТГ не достигает нижней границы чувствительности метода, что препятствует разграничению нормальных и субнормальных показателей в исходных условиях. При первичном гипотиреозе уровень ТТГ может превышать 100 мкЕД/мл. При гипертиреозе или гипопитуитаризме с помощью радиоиммунологических методов, как правило, не удается обнаружить отличий от нормы, хотя это и можно сделать с помощью цитохимических методов. Свободная a-субъединица определяется в плазме примерно у 80% здоровых мужчин и у женщин в постменопаузе, причем ее концентрация составляет 0,5—2,0 нг/мл [38] и резко повышается в ответ на введение ТРГ [40]. В плазме здоровых людей ТТГ-бета не выявляется ни в исходных условиях, ни после введения ТРГ.
При первичном гипотиреозе уровень a-субъединицы повышается в несколько раз (»5 нг/мл); удается определить и ТТГ-бета (»1,5 нг/мл), причем содержание обеих субъединиц повышается в ответ на стимуляцию ТРГ.
Предполагается, что ТТГ, определяемый в крови иммунологическими методами, представляет собой биологически активный гормон. В тех случаях, когда сравнивали иммунологическую и биологическую активность (например, с помощью цитохимических биологических методов), наблюдалось их совпадение [39]. У некоторых детей с гипотиреозом, обусловленным, по-видимому, первичным поражением гипоталамуса [41], находили незначительное повышение уровня иммунореактивного ТТГ в плазме. Введение ТРГ резко увеличивало содержание ТТГ в плазме с одновременным повышением и концентрации Т4; эти данные указывают на то, что в исходных условиях при отсутствии эндогенного ТРГ может секретироваться ТТГ со сниженной биологической активностью. Такое предположение требует подтверждения путем сравнения результатов определения ТТГ радиоиммунологическим и биологическим методами у детей этой группы.
Метаболизм
Пространство распределения ТТГ лишь ненамного превышает объем плазмы. Период полужизни ТТГ в плазме составляет 75— 80 мин, а скорость секреции гормона — около 100—200 мЕД/сут [42]. При гипотиреозе резкое повышение уровня ТТГ в плазме перекрывает небольшое снижение скорости его метаболического клиренса, что предполагает 10—15-кратное повышение скорости секреции гормона по сравнению с таковой у здоровых лиц. В отличие от гонадотропинов, экскретируемых с мочой, в ней присутствуют лишь небольшие количества ТТГ. Причина этого различия неясна. Попытки показать внутрисосудистую диссоциацию ТТГ на субъединицы не увенчались успехом.
Регуляция секреции
Секреция ТТГ контролируется двумя основными факторами: 1 — эффектами тиреоидных гормонов по механизму обратной связи и 2 — стимулами, опосредуемыми ЦНС и секрецией тиротропин-рилизинг гормона (ТРГ) и соматостатина. Между секрецией тиреоидных гормонов и тиротропина существует очень тонкая обратная связь, которая функционирует не только при резких изменениях уровней тироксина (Т4) и трийодтиронина (Т3), наблюдаемых при гипо- или гипертиреозе, но и при небольших колебаниях содержания этих гормонов в нормальных границах. Эффекты обратной связи затрагивают как исходную, так и стимулируемую ТРГ секрецию ТТГ и опосредуются ингибиторным механизмом, включающим синтез белка в тиротрофах. Введение небольших количеств тироксина, которые даже не приводят к превышению верхней границы нормальных колебаний уровня Т4 в плазме, могут снижать реакцию ТТГ на ТРГ, а небольшое снижение уровня тиреоидных гормонов путем кратковременного приема йодида внутрь достаточно для повышения как исходной, так и стимулируемой ТРГ секреции ТТГ. В качестве носителей обратной связи, замыкающейся на тиротрофах, активны как Т4, так и Т3. Так, у больных с различными хроническими заболеваниями, у которых содержание Т4 в плазме нормально, а уровень Т3 снижен из-за торможения активности дейодиназы на периферии, концентрация ТТГ нормальна. С другой стороны, введение Т3 на фоне нормального содержания Т4 в плазме легко подавляет секрецию ТТГ.
Нормальное функционирование гипофизарно-гироидной оси зависит от состояния ЦНС. Нарушение нормальных гипоталамо-гипофизарных связей путем повреждения гипоталамуса или перерезки ножки гипофиза лишает тиротрофы способности секретировать ТТГ в ответ на снижение уровня тиреоидных гормонов. Помимо этой тонической роли гипоталамуса, существует и опосредованный центральными механизмами эффект температуры. При снижении температуры окружающей среды или тела возникает опосредованная нервными влияниями секреция ТТГ, которая приводит к увеличению секреции тиреоидных гормонов и повышению калоригенеза. Стимулирующее влияние холода на секрецию ТТГ легко наблюдать у крыс, но у человека оно проявляется только в период родов при снижении окружающей температуры в момент выхода плода из матки, а также у детей, подвергающихся гипотермии в связи с операциями на сердце. С возрастом и созреванием симпатической нервной системы роль гипофизарно-тиреоидной оси в острой метаболической адаптации к холоду, по-видимому, уменьшается.
Участие ТРГ в вызываемой охлаждением секреции ТТГ было показано в исследованиях с пассивной иммунизацией, в которых введение антисыворотки к ТРГ блокировало повышение уровня ТТГ в плазме охлаждаемых крыс [43]. Опыты на крысах с гипотиреозом показали, что острое «выключение» ТРГ лишь частично тормозит секрецию ТТГ в ответ на острое снижение уровня тиреоидных гормонов [44]. В связи с этим роль ТРГ в регуляции гипофизарно-тиреоидной оси можно рассматривать как модулирующую в отношении порога и интенсивности секреторной реакции ТТГ на снижение уровня тиреоидных гормонов. В отличие от этого гипоталамическая секреция соматостатина под действием тиреоидных гормонов увеличивается, а при гипотиреозе уменьшается [45], что усиливает непосредственное действие тиреоидных гормонов на гипофиз.
На секрецию ТТГ влияют также глюкокортикоиды, эстрогены и гормон роста. Кортизол оказывает тормозящее действие на исходную и стимулируемую ТРГ секрецию ТТГ, причем после отмены глюкокортикоидов возникает феномен «отдачи», и секреция ТТГ усиливается. Имеются косвенные данные о возможности угнетающего действия глюкокортикоидов и на секрецию ТРГ.
Эстрогены не изменяют исходного уровня ТТГ, но повышают его реакцию на ТРГ. Это проявляется усиленной реакцией, наблюдаемой: 1 — у женщин по сравнению с мужчинами; 2 — в течение поздней фолликулярной фазы менструального цикла в период высокого уровня эстрадиола и 3 — при предварительном введении эстрогенов мужчинам. Не ясно, определяет ли этот эффект эстрогенов большую частоту тиреоидной патологии у женщин.
Соматостатин тормозит секрецию ТТГ, действуя на тиротрофы. Физиологическая роль этого пептида доказывается повышением уровня ТТГ после введения животным антисыворотки к соматостатину [ 46]. Соматостатин угнетает повышение уровня ТТГ ночью у здоровых людей и снижает его повышенный уровень у больных первичным гипотиреозом. Лечение детей с соматотронной недостаточностью предположительно гипоталамического происхождения гормоном роста иногда осложняется развитием гипотиреоза, связанного со снижением секреции ТТГ в ответ на введение ТРГ. Предполагается, что в основе тормозящего эффекта гормона роста лежит стимуляция секреции соматостатина, который и угнетает реакцию ТТГ на ТРГ.
ГОНАДОТРОПИНЫ: ЛЮТЕИНИЗИРУЮЩИЙ И ФОЛЛИКУЛОСТИМУЛИРУЮЩИЙ ГОРМОНЫ
Действие
Двумя гипофизарными гормонами, регулирующими функцию половых желез, являются фолликулостимулирующий гормон (ФСГ), который стимулирует рост фолликулов яичника, а также рост яичек и сперматогенез, и лютеинизирующий гормон (ЛГ), который вызывает овуляцию и лютеинизацию яичниковых фолликулов, стимулирует функцию интерстициальных (лейдиговских) клеток яичек и повышает продукцию стероидов как яичниками, так и яичками. Из-за своей функции у мужчин ЛГ раньше называли также гормоном, стимулирующим интерстициальные клетки (ГСИК). Третьим гипофизарным гормоном, который также влияет на яичники, является пролактин (раньше называвшийся лютеотропным гормоном или ЛТГ); у крыс он участвует в поддержании секреторной активности и жизнеспособности желтого тела после овуляции.
ФСГ и ЛГ связываются рецепторами яичников и семенников и их эффекты опосредуются механизмами с участием циклических нуклеотидов подобно эффектам других тропных гормонов гипофиза. Клетками-мишенями ФСГ в яичнике служат клетки примордиального фолликула, которые под действием этого гормона ускоряют свой рост и созревание. ЛГ стимулирует продукцию прогестерона желтым телом, увеличивает превращение холестерина в прегненолон; он необходим также для процесса овуляции. Подробнее эффекты гонадотропинов на яичник обсуждаются в другом разделе. Главными клетками-мишенями ФСГ в семенниках служат клетки Сертоли, в которых этот гормон вместе с тестостероном стимулирует продукцию андрогенсвязывающего белка, секретируемого в просвет канальцев. Клетками-мишенями ЛГ являются клетки Лейдига, в которых стимулируется продукция андрогенов, особенно тестостерона. Андрогенсвязывающий белок переносит тестостерон в клетки канальцев, где вблизи развивающихся сперматогоний создается высокая концентрация гормона, что способствует их созреванию. Подробнее эффекты гонадотропинов в семенниках рассматриваются в другом разделе.
Определение
Биологические методы. Описано много биологических методов определения ЛГ, в том числе индукция овуляции, снижение содержания в яичниках аскорбиновой кислоты и секреции прогестерона, а также рост предстательной железы. Содержание ФСГ определяли раньше по его способности увеличивать размеры женских репродуктивных органов и потенцировать действие ЛГ. Ограниченная чувствительность и точность этих методов позволяет применять их только для определения содержания гонадотропинов в моче (и гипофизе). Кроме того, изменение химической структуры гонадотропинов, например десиалилация в процессе экскреции, могло бы обусловливать получение заниженных результатов определения-секретируемых количеств. Разработаны и более чувствительные методы биологического определения гонадотропинов, находящие применение в научно-исследовательской практике. Однако для рутинных клинических анализов методом выбора стал радиоиммунологический способ.
Как и для других гипофизарных гормонов, предложены радиолигандные методы определения как ЛГ, так и ФСГ. Радиорецепторные методы очень специфичны [47, 48] и обладают достаточной чувствительностью, чтобы позволить определять уровень гонадотропинов в крови. Целесообразность использования этих методов наряду с радиоиммунологическими была доказана при изучении секреции гонадотропинов с измененными биологическими свойствами.
Радиоиммунологические методы. Для определения ЛГ и ФСГ предложены чувствительные радиоиммунологические методы. Их специфичность зависит от конкретных антигенных детерминант, распознаваемых применяемыми антисыворотками. Хотя большинство таких методов позволяет разграничивать оба гонадотропина, но часто наблюдается перекрестная реакция между интактным гормоном и отдельными его субъединицами. Обычно это не составляет проблемы для практики. В силу значительного сходства строения ЛГ и хорионического гонадотропина использование антител к интактному гормону обнаруживает выраженную перекрестную реакцию между этими гормонами. Для измерения низких концентраций ХГ с целью ранней диагностики беременности предложен метод определения b-субъединицы ХГ, который характеризуется лишь незначительной перекрестной реакцией с ЛГ.
Радиоиммунологическое определение ЛГ и ФСГ в моче, хотя и практикуется реже в силу преимуществ определений в плазме для оценки динамики секреции, но в некоторых условиях остается весьма полезной процедурой. Для определения гонадотропинов в моче можно использовать те же радиоиммунологические методы, что и для определения этих гормонов в плазме, хотя имеются данные о некотором иммунологическом различии ЛГ и ФСГ в плазме и моче, обусловленном, по-видимому, химическим изменением гормонов в процессе экскреции.
Некоторая проблема при радиоиммунологическом определении гонадотропинов в плазме связана с выбором стандартов. Препарат сравнения для биологических методов, получаемый из менопаузного гонадотропина мочи женщин в менопаузе (МГЧ), распределяется Медицинским Научным Советом Великобритании и известен под названием второго международного препарата сравнения (второй МПС/МГЧ). Поскольку по своим иммунологическим свойствам гонадотропины плазмы ближе к гонадотропинам гипофиза, чем мочи, в настоящее время Национальное Агентство гипофизарных препаратов выпускает другой стандарт (LER907), который представляет собой частично очищенный экстракт гипофиза, биологическая активность которого калибруется по второму МПС/МГЧ : 20 мЕД ФСГ и 60 мЕД в 1 мг. Поскольку отношение иммунологической активности к биологической для препаратов гонадотропинов из мочи выше, чем для гипофизарных препаратов, иногда очень трудно сравнивать данные, получаемые в разных лабораториях. Для облегчения сравнения таких данных рекомендуется выражать результаты в эквивалентах миллиединиц второго МПС/МГЧ, а не в единицах реальной массы частично очищенного препарата сравнения.

Рис. 7—6. Изменение уровня гипофизарных и яичниковых гормонов в динамике нормального менструального цикла у женщин. Можно видеть, что повышение уровня эстрадиола в позднюю фолликулярную фазу, сменяемое его снижением, предшествует «запускающему» овуляцию выбросу ЛГ и ФСГ в середине цикла (Speroff L. и соавт. Am. J. Obstet. GynecoL, 1971, 109, 234).
1 — ЛГ; 2 — ФСГ: З — прогестерон: 4 — эстрадиол: 5 — 1-оксипрогестерон..
Уровень гормона в гипофизе и плазме
Гипофиз. Содержание гонадотропинов в гипофизе у мужчин и женщин в пременопаузе составляет около 700 мЕД для ЛГ и 200 мЕД для ФСГ. После наступления менопаузы содержание гонадотропинов увеличивается более чем вдвое.
Плазма. Уровни ЛГ и ФСГ в плазме вскоре после рождения начинают повышаться и достигают пика к 1—4-му месяцу, когда содержание ФСГ у девочек превышает таковое у мальчиков, а ЛГ, напротив, выше у мальчиков [49]. Затем уровни обоих гормонов снижаются вплоть до наступления пубертатного возраста. В пубертатном периоде у мальчиков происходят ночные повышения содержания ЛГ и тестостерона в плазме, связанные с теми фазами сна, когда не отмечается быстрого движения глаз [50], что приводит к заметному увеличению уровня ЛГ в моче. У девочек циклическую секрецию ФСГ и в меньшей степени ЛГ удается наблюдать еще до начала менструаций.
Характер секреции ЛГ и ФСГ у взрослых овулирующих женщин представлен на рис. 7—6. В течение ранней фолликулярной фазы цикла уровень ФСГ слегка повышается, а затем обнаруживает прогрессирующее снижение. В то же время уровень ЛГ обычно остается постоянным или несколько повышается. В середине цикла увеличение секреции эстрогенов развивающимся фолликулом приводит к резкому увеличению содержания ЛГ и в меньшей степени ФСГ, что «запускает» овуляцию. В течение лютеальной фазы уровни ЛГ и ФСГ снижаются.
Содержание ЛГ и ФСГ у мужчин сходно с таковым у женщин в течение фолликулярной фазы цикла, если не считать овуляторного выброса этих гормонов. У представителей обоего пола снижение функции половых желез сопровождается повышением уровней ФСГ и ЛГ. У женщин такое повышение происходит в менопаузе, а у мужчин постепенное повышение уровня этих гормонов регистрируется в течение 6—8-го десятка жизни. В постпубертатном периоде у мужчин и женщин наблюдается эпизодическая секреция ЛГ с пиками каждые 2—3 ч. Вспышки секреции ФСГ менее выражены и труднее поддаются выявлению. Они могут совпадать или не совпадать со вспышками секреции ЛГ.
С помощью специфического радиоиммунологического метода в крови обнаружена свободная a-субъединица гликопротеиновых гормонов, причем у женщин после наступления менопаузы ее уровень значительно повышается. В ответ на ГнРГ увеличивается содержание как a-субъединипы, так и ЛГ-бета [51]. Как и в отношении ТТГ, внутривенная инфузия ЛГ не приводит к появлению в крови свободных субъединиц, что служит дополнительным доказательством их непосредственной секреции гипофизом.
Моча. Содержание гонадотропинов в моче обычно отражает их уровень в плазме за одним лишь важным исключением, которым является препубертатный период, когда уровень ЛГ и ФСГ в моче оказывается непропорционально низким по отношению к соответствующим уровням в плазме. Количество ЛГ и ФСГ в 3-часовых порциях мочи тесно коррелирует с интегральной концентрацией гонадотропинов в плазме за тот же период [52] и может служить поэтому полезным показателем секреции гонадотропинов.
Метаболизм и скорость секреции
Несмотря на сходство структуры, скорости метаболического клиренса отдельных гонадотропинов в плазме обнаруживают заметные различия. Период полужизни ЛГ составляет около 30 мин, тогда как ФСГ — примерно вдвое больше, а хорионического гонадотропина — много часов. Эти различия относят за счет разного содержания сиаловых кислот в трех гормонах, поскольку десиализация значительно укорачивает период их полужизни в плазме. Скорость секреции ЛГ у взрослых лиц с нормальной функцией половых желез составляет 500—1000 мЕД/сут, а ФСГ — 50— 100 мЕД/сут. Поскольку скорости метаболического клиренса этих гормонов не изменяются в постменопаузе, изменение скоростей секреции отражается на уровне гонадотропинов в плазме.
Регуляция секреции
Секреция гонадотропинов у овулирующих особей женского пола контролируется сложным и многокомпонентным механизмом, в котором принимают участие гипоталамус и половые железы. Содержание гонадотропинов и их реакция на ГнРГ при различных клинических состояниях приведены в табл. 7—3. Прогрессирующее повышение секреции эстрогенов развивающимся фолликулом, который находится под влиянием ФСГ и ЛГ, оказывает стимулирующее действие на гипоталамус, что приводит к усилению секреции ГнРГ. Имеется много данных, указывающих на то, что секреция эстрогенов в определенной степени определяется собственным яичниковым циклом. Эстрогены повышают также чувствительность гонадотрофов к эффекту ГнРГ; кульминацией всех этих влияний является овуляторный выброс ЛГ и ФСГ. Прогестерон, секретируемый желтым телом, в присутствии эстрогенов также усиливает реакцию гонадотропинов на ГнРГ, но, по-видимому, оказывает тормозное влияние на гипоталамус по механизму отрицательной обратной связи. Эффект эстрогенов в системе обратной связи на самом деле гораздо сложнее, поскольку в зависимости от дозы и длительности воздействия эстрогенов можно наблюдать как стимулирующие, так и тормозные влияния на гипофиз. Кратковременное воздействие эстрогенов снижает как исходную секрецию ЛГ, так и реакцию ЛГ на ГнРГ [53]. При более длительном воздействии эстрогенов, особенно в относительно малых дозах, реакция гонадотропинов усиливается [54]. Дальнейшее увеличение продолжительности введения эстрогенов вновь снижает эту реакцию. Реакцию гонадотропинов на ГнРГ усиливает также предварительное воздействие самого рилизинг-гормона, и этот «самозапускающий» эффект ГнРГ является эстрогензависимым. Так, реакция ФСГ и особенно ЛГ на ГнРГ усиливается при последовательных инъекциях пептида, причем эстрогены увеличивают степень этого усиления. В отсутствие предыдущего воздействия ГнРГ, что наблюдается после перерезки ножки гипофиза или при некоторых повреждениях гипоталамуса, реакция ЛГ и ФСГ на острое введение ГнРГ может вообще не проявляться.
Таблица 7—3. Реакции гонадотропинов при нарушениях в системе гипоталамус — гипофиз — половые железы
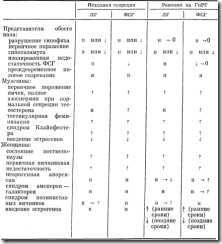
Примечание. О — отсутствие реакции, н — нормальная реакция.
По поводу точек приложения действия эстрогенов в гипоталамусе все еще имеются разногласия, но по крайней мере с функциональной точки зрения существуют два различных локуса их действия. Положительный эффект обратной связи, который заключается в повышении секреции ГнРГ, наблюдается только у особей женского пола и, -как считают, замыкается в той части гипоталамуса, которая определяет цикличность репродуктивной функции. Отрицательный эффект эстрогенов по механизму обратной связи в головном мозге легче всего показать после наступления менопаузы или хирургической кастрации, когда введение эстрогенов приводит к снижению содержания ЛГ и ФСГ до уровня, наблюдаемого в пременопаузе.
У особей мужского пола на регуляцию секреции гонадотропинов, по-видимому, не влияет циклическая функция ни гипоталамуса, ни семенников. Тестостерон оказывает главным образом отрицательное действие в системе обратной связи, причем можно показать замыкание этой системы на уровне как гипоталамуса, так и гипофиза. Повышенные уровни ЛГ и ФСГ, часто регистрируемые у лиц в возрасте старше 60 лет, а также после кастрации, снижаются при введении тестостерона. У мужчин в отличие от женщин эстрогены оказывают только тормозное влияние на секрецию гонадотропинов.
Хотя известно, что именно тестостерон является основным гормоном, участвующим в регуляции секреции ЛГ в системе обратной связи, его роль в регуляции секреции ФСГ трудно документировать. Несмотря на то что секрецию ФСГ несомненно модулируют не только эстрогены, но и андрогены, существуют веские прямые доказательства продукции семенниками другого полипептидного гормона, называемого «ингибином», который оказывает главный тормозной эффект по механизму обратной связи. Ингибин идентифицирован в жидкости сети семенников животных и в семенной жидкости здоровых мужчин; по всей вероятности, он присутствует и в яичниках, но его полная характеристика — дело будущего. На животных нескольких видов показано, что он угнетает секрецию ФСГ (но не ЛГ) как в исходных условиях, так и в ответ на ГнРГ [55], что свидетельствует о его действии на уровне гипофиза. Ингибин, по-видимому, угнетает секрецию ФСГ и после инъекции непосредственно в ЦНС; это ставит вопрос о возможности существования многих точек приложения его действия. Разработка методов определения ингибина могла бы прояснить многие аспекты в отношении физиологии регуляции секреции ФСГ.
Помимо половых гормонов, действующих по механизму обратной связи, на секрецию ЛГ и ФСГ влияет и пролактин. Предполагается его ингибиторный эффект как на гипофизарном, так и на гипоталамическом уровне, который может определяться либо самим гормоном, либо каким-то посредником его действия. Примером эффектов пролактина служит отсутствие овуляции в период послеродовой физиологической лактации, а также у больных с пролактинсекретирующими опухолями гипофиза. Реакция ЛГ на ГнРГ ослабляется при введении глюкокортикоидов, а также у больных с синдромом Кушинга, что свидетельствует о тормозном влиянии глюкокортикоидов на секрецию ЛГ.
СОМАТОМАММОТРОПНЫЕ ГОРМОНЫ
Химия
Этот класс соединений включает в себя два гипофизарных гормона — СТГ и пролактин и один гормон плацентарного происхождения — плацентарный лактоген, или хорионический соматомаммотропин. Все эти гормоны состоят из одной пептидной цепи с внутренними дисульфидными связями. Структуры как СТГ, так и пролактина обнаруживают значительное межвидовое сходство. Например, 73% аминокислотных остатков идентичны в пролактинах человека и овцы [56] и 64% остатков идентичны в СТГ человека и овцы [57]. Это указывает на относительно небольшие изменения генома в процессе эволюции позвоночных [58]. Несмотря на такое сходство, гормоны роста животных, стоящих на эволюционной лестнице ниже приматов, не проявляют биологической активности у человека. Значительная гомология существует и между первичными структурами СТГ и плацентарного лактогена; в них идентичны 159 (83%) из 191 аминокислотного остатка (рис. 7—7). В отличие от этого в пролактине и СТГ идентичны только 16% остатков, а в пролактине и плацентарном лактогене— 13%. СТГ и плацентарный лактоген содержат по две дисульфидных связи, тогда как пролактин, цепь которого на 7 аминокислот длиннее, чем в двух других гормонах, содержит три такие связи. Несмотря на различия в структуре, каждому из трех гормонов присуща как лактогенная, так и стимулирующая рост активность.
Предпринималось множество попыток установить биологически активное ядро гормона роста, для чего изучались взаимоотношения между его структурой и функцией [59]. Было обнаружено, что ростовая активность принадлежит фрагментам из нескольких разных участков молекулы, хотя чаще всего эту активность находили в области, содержащей часть или всю последовательность с 80-го по 140-й аминокислотный остаток. Синтетические фрагменты, включающие эту область, также обладают ростовой активностью.
Биосинтез
Недавно проведенные исследования по идентификации информационных РНК для СТГ и пролактина и их трансляции в бесклеточных системах показали, что оба гормона синтезируются в виде молекул с большей молекулярной массой, чем та, которую имеют секретируемые в норме гормоны. Молекулярная масса предшественников гормонов — препролактина и пре-СТГ, составляет примерно 28000; избыток ее определяется главным образом присутствием в их составе дополнительного N-концевого пептида, состоящего примерно из 30 аминокислот [60]. Этот высокогидрофобный фрагмент одинаков во всех предшественниках и считается необходимым для транспорта вновь синтезированного белка в цистерны эндоплазматического ретикулума, где происходит последующая «упаковка» гормонов. Эндоплазматические мембраны содержат ферменты, способные отщеплять сегмент предшественника от гормона.
Помимо мономерных форм этих гормонов, в экстрактах гипофиза и плазме обнаружены иммунореактивные вещества с размерами, примерно вдвое превосходящими размеры мономера («большой» СТГ, «большой» пролактин и «большой» плацентарный лактоген). Во всех трех случаях «большой» гормон представляет собой, по-видимому, димер, объединенный межцепочечными дисульфидными, а не пептидными связями [61, 62]. Установлено, что «большой» СТГ непосредственно секретируется гипофизом [63], причем высказано предположение, что его аминокислотный состав отличается от состава мономерного СТГ. «Большой» СТГ связывается с мембранными рецепторами печени и может вытеснять мономер СТГ из связи с ними [64], хотя биологическая активность «большого» гормона меньше, чем у мономера, а его физиологическая роль пока неизвестна.
В гипофизе и крови находили также формы СТГ и пролактина с еще большей молекулярной массой. Присутствие основного их количества можно объяснить агрегацией гормонов в процессе экстракции, очистки и анализа. Небольшая же их часть в гипофизе представляет собой образующийся гормон, еще не потерявший связи с рибосомами.
ГОРМОН РОСТА
Действие
Гормон роста получил свое название потому, что он увеличивает линейный рост тела, что можно наблюдать при введении его з течение нескольких дней гипофизэктомированным животным. Этому гормону принадлежит также важная роль в регуляции метаболических процессов. Взаимосвязь между метаболическими эффектами СТГ и увеличением массы тела выяснена лишь в ограниченной степени. Эффекты СТГ можно группировать по тканям, в которых они проявляются, по времени начала (острые или запаздывающие) и по типу возникающих изменений метаболизма (например, анаболические или диабетогенные).
Введение СТГ гипофизэктомированным животным или людям с недостаточностью гормона роста приводит через несколько дней к положительному азотистому балансу, снижению продукции мочевины, уменьшению содержания жира в организме и снижению скорости утилизации углеводов, что проявляется снижением дыхательного коэффициента. После однократной инъекции СТГ наблюдаются двухфазные эффекты. Вначале происходит снижение концентрации глюкозы, свободных жирных кислот и аминокислот в крови. Через несколько часов уровни глюкозы и аминокислот нормализуются, а содержание свободных жирных кислот приближается к норме. Большинство этих эффектов, хотя и менее выраженные, можно наблюдать и у здоровых лиц.
Механизм указанных изменений широко изучали путем воздействия СТГ на изолированные ткани in vitro или путем извлечения и исследования тканей через различное время после введения гормона in vivo. Многие острые эффекты СТГ в изолированных тканях напоминают эффекты инсулина. В мышцах и печени СТГ повышает поглощение аминокислот и включение их в белок. Этот процесс обусловливается острым ускорением трансляции предсуществующих РНК, а не синтезом новых молекул РНК, хотя последний также активизируется. В мышцах и жировой ткани СТГ стимулирует поглощение глюкозы, активируя процесс облегченной диффузии, и усиливает ее утилизацию. В жировой ткани СТГ препятствует липолитическому действию катехоламинов и стимулирует синтез РНК и митохондриального белка.
За исключением синтеза белка в мышцах, все эти инсулиноподобные эффекты СТГ удается показать при использовании концентраций гормона, близких к физиологическим; такие эффекты развиваются через 10—30 мин после добавления гормона и характеризуются феноменом рефрактерности: через 3—4 ч после своего возникновения эффект затухает и его не удается воспроизвести вновь путем внесения в систему дополнительных количеств гормона. Специфическую для СТГ рефрактерность можно снять с помощью средств, влияющих на синтез РНК или белка.
Одновременно с исчезновением острых эффектов СТГ начинают проявляться его запаздывающие эффекты. К ним относится 1 — ускорение мобилизации жирных кислот из жировой ткани вследствие усиления липолиза триглицеридов; 2 — повышение чувствительности к липолитическому действию катехоламинов и 3 — торможение как поглощения, так и утилизации глюкозы вследствие замедления декарбоксилирования пирувата. Все эти поздние эффекты сохраняются в течение многих часов, обнаруживают аддитивность при дополнительных воздействиях СТГ и формируют основу «диабетогенного» действия гормона роста на углеводный и липидный обмен.
Введение СТГ оказывает на секрецию инсулина сложное и, по-видимому, трехфазное влияние. Вначале происходит усиление секреции инсулина, которое является, вероятно, прямым эффектом СТГ на b-клетки и может наблюдаться уже в пределах 5 мин после инъекции как у здоровых лиц, так и у больных с недостаточностью гормона роста [65]. В течение последующих 1—5 ч обнаруживается незначительное торможение секреции инсулина, механизм которого до конца не ясен [66]. Спустя еще более длительное время наблюдается более выраженное и продолжительное повышение секреции, которое служит проявлением не прямого влияния СТГ, а вторичной реакции на нарушение утилизации глюкозы. При достаточно длительном введении СТГ, особенно в присутствии других факторов, таких, как глюкокортикоиды или соответствующая генетическая предрасположенность, может развиться выраженный диабет. После отмены СТГ описанные изменения исчезают, что указывает на отсутствие чрезмерного повреждения секреторной способности b-клеток.
Далеко не все эффекты СТГ, наблюдаемые после его инъекций интактным животным, можно воспроизвести при воздействии гормона на ткани in vitro. Кроме того, хотя связывание СТГ с мембранными рецепторами различных тканей, включая печень, молочную железу и моноциты крови, и легко показать, но корреляция его биологических эффектов с рецепторным связыванием менее очевидна, чем в отношении других гормонов. Тот факт, что СТГ стимулирует включение радиоактивного сульфата в протеогликаны хряща посредством индукции вторичного «сульфирующего фактора» [67], породил представление о присутствии в нормальной плазме ряда СТГ-зависимых ростовых факторов, стимулирующих клеточные процессы роста не только скелета, но и мягких тканей. Впоследствии был предложен термин «соматомедин» для обозначения посредника более широкого спектра биологической активности СТГ [68]. Этот посредник весьма подобен и, вероятно, идентичен фактору, называемому НИПАр [неподавляемая (антителами к инсулину) инсулиноподобная активность, растворимая (в этаноле)], который представляет собой пептид с молекулярной массой около 7500, обладающий многими свойствами инсулина, в том числе способностью связываться с инсулиновыми рецепторами фибробластов цыпленка, а также проявляющий зависимость от СТГ и сульфирующую активность в отношении хряща. Соматомедин, наиболее схожий с НИПАр, получил название соматомедина-А. Идентифицированы также имеющий более кислую реакцию белок примерно того же размера — соматомедин-С и меньший по размерам пептид (5400 дальтон) — соматомедин-В. Позднее эти пептиды стали называть ИФР (инсулиноподобные факторы роста), что отражает их общие биологические свойства. В настоящее время начинает проясняться роль этих пептидов в опосредовании эффектов на секрецию СТГ по механизму обратной связи, а также в опосредовании эффектов самого
СТГ
СТГ обладает многими влияниями на рост органов (вызывая, например, гипертрофию сердца и почек), а также на продукцию и метаболизм отдельных гормонов (например, продукцию альдостерона и ренина и превращение тироксина в трийодтиронин). Подробнее все эти эффекты рассматриваются в другом разделе.
Определение
Биологические методы. Вначале методы определения СТГ основывались на его способности увеличивать линейный рост гипофизэктомированных крыс. Затем была разработана более чувствительная методика, основанная на измерении ширины эпифизарного хряща большеберцовой кости у гипофизэктомированных крыс. Хотя этот метод (тибиа-тест) остается наиболее надежным способом определения биологической активности СТГ, экстрагируемого из гипофиза, его чувствительность невелика (около 10 мкг), что не позволяет применять его для определений уровня СТГ в плазме. Кроме того, на результаты соответствующих определений влияют многие другие факторы, что делает данный способ относительно неспецифичным в отношении грубых экстрактов гипофиза. До настоящего времени отсутствует цитохимическая методика определения СТГ.
Радиоиммунологические методы. Эти методы являются стандартными для определения СТГ в жидкостях организма. Антитела к СТГ человека легко получить у кролика, и результаты применения этих методов в разных лабораториях согласуются между собой. Чувствительность метода позволяет определять обычно менее 10 пг, что более чем достаточно для определения исходных уровней гормона в циркуляции. Перекрестные реакции с любым другим гипофизарным гормоном отсутствуют, но практически все антитела к СТГ обнаруживают перекрестную реакцию с плацентарным лактогеном, который имеет очень сходную структуру (см. рис. 7—7). В силу весьма высокого уровня плацентарного лактогена при беременности обычные радиоиммунологические определения СТГ в этот период оказываются ненадежными.
Радиорецепторные методы. Предложен радиорецепторный метод определения СТГ человека с помощью плазматических мембран печени крольчих, находящихся в периоде середины беременности. Хотя этот метод и менее чувствителен, чем радиоиммунологический, но он позволяет определять содержание СТГ в плазме. Однако он недостаточно специфичен, поскольку дает значительную перекрестную реакцию с пролактином. Радиорецепторный метод применяется для выявления молекул СТГ с измененными биологическими свойствами, которые присутствуют, например, при акромегалии [69].
Уровень гормона в гипофизе и плазме
Гипофиз. На долю СТГ в гипофизе человека приходится приблизительно 2% влажной массы, что составляет 8—10 мг, хотя современные методы и не позволяют экстрагировать весь присутствующий в железе гормон. Его содержание у мужчин и женщин почти одинаково и существенно не зависит от возраста. Каждые сутки высвобождается менее 5% СТГ, содержащегося в гипофизе, причем считается, что значительная часть гормона подвергается разрушению в гипофизе, даже не будучи секретированной.
Плазма. Уровень СТГ в плазме взрослого человека в покое натощак обычно не достигает 2 нг/мл, а иногда оказывается ниже границы чувствительности метода. У женщин содержание СТГ несколько выше, чем у мужчин, причем при физической работе, когда оно повышается у лиц обоего пола, эта разница становится более отчетливой. В конце внутриутробной жизни и в течение нескольких первых дней после родов уровень СТГ очень высок (часто выше 50 нг/мл). В течение нескольких последующих недель он резко снижается, оставаясь чуть выше, чем у взрослых.
Только очень небольшая часть присутствующего в плазме СТГ экскретируется почками в иммунологически выявляемой форме. Концентрация СТГ в моче отражает его уровень в сыворотке, повышается в условиях гиперсекреции СТГ и снижается при гипопитуитаризме, но диагностическая ценность этого показателя при нарушениях секреции СТГ невелика.
Метаболический клиренс и секреция
Из плазмы СТГ элиминируется главным образом печенью и в меньшей степени почками. Период полужизни СТГ в сыворотке составляет, 20—25 мин [70], а скорость метаболического клиренса — примерно 110 мл/м2 в 1 мин с небольшими колебаниями при состояниях, характеризующихся его избыточной или недостаточной продукцией [71]. При гипотиреозе и диабете находили снижение скорости метаболического клиренса СТГ. В связи с этим, за исключением указанных состояний, изменение уровня СТГ в плазме точно отражает изменение скорости секреции гормона. У здоровых мужчин скорость секреции СТГ составляет примерно 350 мкг/м2 в сутки, тогда как у женщин в пременопаузе эта величина достигает 500 мкг/м2 в сутки.
Регуляция секреции
Секреция СТГ регулируется как рилизинг- (СТГ-РФ), так и ингибирующим (соматостатин) факторами гипоталамического происхождения. В нормальных физиологических условиях как нервные, так и иные механизмы регуляции секреции СТГ замыкаются, по-видимому, на уровне высвобождения одного или обоих факторов, а не прямо влияют на секрецию СТГ на уровне гипофиза. Поскольку в настоящее время высвобождение этих факторов из гипоталамуса in vivo в физиологических условиях не поддается определению, то о таком высвобождении судят по их конечному эффекту — изменению секреции СТГ.
Факторы, влияющие на секрецию СТГ, суммированы в табл. 7—4. Поскольку исходные концентрации СТГ столь часто находятся вблизи нижней границы возможностей определения, для демонстрации тормозных эффектов нередко требуется одновременное использование стимулирующего агента.
Нервная. К нервным стимулам, влияющим на секрецию СТГ, относятся как физические и психические стрессы, так и факторы, определяющие его эпизодическую секрецию и не связанные ни со стрессом, ни с видимыми метаболическими изменениями, что чаще регистрируется у детей и молодых лиц, чем у взрослых. Связанные с состоянием сна (суточные) вспышки секреции СТГ наиболее выражены в детстве, когда они наблюдаются и во время дневного сна, а с возрастом постепенно затухают (рис. 7—8). Установлено, что ночью секретируется 70% от общего суточного количества СТГ. Эти «вспышки» секреции гормона появляются, по-видимому, в начале глубокого сна, поскольку они отсутствуют, если человека будят перед наступлением III и IV стадий сна. Внимательный анализ такой связи у некоторых здоровых лиц при патологических состояниях, сопровождающихся изменениями медленноволнового сна и секреции СТГ, а также при воздействии фармакологических средств (например, имипрамина, флуразепама, метилскополамина и медроксипрогестерона), которые способны блокировать реакцию СТГ, позволил заключить, что ночная секреция СТГ — это процесс, часто начинающийся одновременно с наступлением сна, но не прочно связанный с нервными механизмами, определяющими развитие медленноволнового сна.
Метаболическая. Изменение концентраций энергетических веществ в крови и, что более важно, внутри клеток играет существенную роль в регуляции секреции СТГ. Увеличение содержания сахара в крови, будь то вследствие перорального или внутривен-ого введения глюкозы, подавляет секрецию СТГ. Этот феномен широко используется в диагностике акромегалии. Напротив, снижение уровня глюкозы в крови (а точнее — внутриклеточного метаболизма глюкозы), будь то вследствие действия инсулина или глюкозотолерантного теста в нисходящую фазу, стимулирует секрецию СТГ. Значение внутриклеточного метаболизма сахара иллюстрируется стимулирующим эффектом введения 2-дезоксиглюкозы, вызывающей гипергликемию с одновременной внутриклеточной глюкопенией за счет блокады фосфорилирования глюкозы. На сегодняшний день инсулиновая гипогликемия служит наиболее надежным стимулом, позволяющим оценить секреторную способность соматотрофов. Важными детерминантами реакции СТГ является как абсолютный уровень глюкозы, так и скорость снижения ее концентрации, поскольку быстрое уменьшение содержания глюкозы с гипергликемического уровня до нормы также может вызывать секрецию СТГ. В вентральном гипоталамусе обнаружены чувствительные к глюкозе нейроны, которые, как считают, «запускают» секрецию СТГ-РФ.
Таблица 7—4. Факторы, влияющие на секрецию гормона роста
|
Стимулирующие |
Угнетающие1 |
||
|
Физиологические |
|||
|
Сон Физическая работа Стресс (физический пли психологический) Состояние после еды: гипераминацидемия гипогликемия (относительная) |
Гиперглпкемия после еды Повышение содержания свободных жирных кислот |
||
|
Фармакологические |
|||
|
Гипогликемия: абсолютная: инсулин или 2-дезо-ксиглюкоза относительная: после введевия глюкагона Гормоны: пептиды (АКТГ, a-МСГ, вазопрессин) эстрогены Нейротрансмиттеры и др. a-адренергические агонисты (клони-дин)бета-адренергические антагонисты (про-пранолол) предшественники серотонина (5-ОТ) дофаминергические агонисты (L-ДОФА, апоморфин, бром-криптин) агонисты ГАМК (мусцимол) аналоги анкефалина Пирогены (эндотоксин pseudomonas) |
Гормоны: соматостатин гормон роста прогестерон глюкокортикоиды Нейротрансмиттеры и др. a-адренергические антагонисты (фентоламин) -адренергические агонисты (изопро-теренол) серотонинергические антагонисты (метизергид) дофаминергические антагонисты (фенотиазины) |
||
|
Патологические |
|||
|
Снижение содержания белка и голодание Неврогенная анорексия Хроническая почечная недостаточность При акромегалии: ТРГ, ГнРГ |
Ожирение При акромегалии: дофаминергические агонисты Гипо- и гипертиреоз |
||
Угнетающие эффекты некоторых факторов можно наблюдать только в присутствии стимуляторов.

Рис. 7—8. Изменения во время сна секреции пролактина (1) и СТГ (2). Повышение уровня СТГ сопровождает начало медленноволнового сна (ЭЭГ—стадии III и IV), который обычно наступает через 90—120 мин после засыпания. В отличие от этого, кривая секреции пролактина имеет пилообразную форму, причем максимальный уровень регистрируется в конце периода сна или вскоре после пробуждения (Sassin J. и соавт., Science, 1973, 177, 1205). REM — фаза быстрого движения глаз; стрелки указывают на время приема пищи.
Пероральное введение отдельных аминокислот (аргинина, лизина, лейцина и др.), смеси аминокислот или белков стимулирует выброс СТГ. Повышение уровня свободных жирных кислот в плазме, вызываемое путем инфузии жировой эмульсии с гепарином (для активации липопротеиновой липазы), остро подавляет секрецию СТГ. Напротив, быстрое уменьшение содержания свободных жирных кислот стимулирует секрецию СТГ. Механизм действия аминокислот и свободных жирных кислот, равно как и конкретные точки приложения их действия в ЦНС, еще предстоит выяснить.
Гормональная. На секрецию СТГ различными путями влияют многие гормоны. Эстрогены усиливают секреторную реакцию гормона роста на действие многих стимулов, что наблюдается и в отношении пролактина, гонадотропина и ТТГ. Считается, что прогестерон подавляет секрецию СТГ, но доказательства тому весьма ограничены. Реакции СТГ на стимуляцию тормозятся экзогенными глюкокортикоидами, эндогенным гиперкортизолизмом, гипер-и гипотиреозом. Хотя показано, что как стероиды, так и тироксин оказывают свое действие непосредственно на соматотрофы, действие это, по всей вероятности, более сложно и может включать влияния и на гипоталамус, и на образование соматомединов (которое угнетается эстрогенами и глюкокортикоидами) и на другие эффекты СТГ. Сам СТГ по механизму обратной связи оказывает тормозное действие на собственную секрецию, хотя пока не известно, является ли это действие непосредственным или оно опосредовано каким-либо промежуточным веществом (например, соматомедином или одним из субстратов метаболизма). В пользу последней точки зрения свидетельствует существование карликовости Ларона [73], при которой резистентность к действию СТГ (дефект на рецепторном или пострецепторном уровне) сопровождается повышением уровня СТГ в крови.
Некоторые пептидные гормоны (вазопрессин, АКТГ и отдельные его фрагменты, а также a-МСГ) остро повышают секрецию СТГ. В настоящее время их эффект следует считать фармакологическим, который обусловлен, вероятно, взаимодействием этих пептидов с рецепторами СТГ-РФ на соматотрофах. В отличие от этого глюкагон влияет на секрецию СТГ не сразу и его действие, по всей вероятности, опосредуется изменениями углеводного обмена.
Нейротрансмиттеры и нейрофармакологические препараты. Многочисленные данные о нейрохимической медиации секреции СТГ и об эффектах веществ, обладающих нейрофармакологической активностью, подробно рассматриваются в других публикациях [74, 75]. Многочисленные сведения, касающиеся секреции СТГ у человека, можно суммировать следующим образом: независимо от характера действующих факторов их эффекты опосредуются в ЦНС, а конкретнее — в гипоталамусе одним или несколькими нейротрансмиттерами, которые в конце концов обусловливают высвобождение СТГ-РФ или соматостатина. Некоторые существующие в литературе противоречия могут, вероятно, объясняться тем фактом, что эти нейротрансмиттеры высвобождаются локально и что для воспроизведения реакции необходимо возбуждение не одного, а двух или более нейронов с участием не одного, а нескольких нейротрансмиттеров (см. главу 6). Возможно также, что нейротрансмиттер, опосредующий стимулирующую реакцию в одной цепи нейронов, в другой опосредует тормозную реакцию. Имеются указания на роль почти всех классических нейротрансмиттеров (норадреналин, адреналин, дофамин, серотонин и ацетилхолин) в регуляции секреции СТГ. b-Адренергические рецепторы опосредуют, по-видимому, ингибиторные, а a-рецепторы — стимулирующие влияния. Так, b-рецепторные антагонисты (например, пропранолол) усиливают, а a-рецепторные антагонисты (например, фентоламин) подавляют действие различных стимулов. Однако неспецифичность большинства применяемых в .клинике антагонистов рецепторов заставляет с осторожностью относиться к интерпретации отдельных результатов. Дофаминергические рецепторы опосредуют стимулирующие влияния, и такие агенты, как L-дофа (ближайший предшественник дофамина), апоморфин и бромкриптин (агонист дофаминовых рецепторов), стимулируют, тогда как хлорпромазин (аминазин )и пимозид (антагонисты дофаминовых рецепторов) препятствуют реакциям СТГ на многочисленные стимулы. Серотонинергические рецепторы также опосредуют стимулирующие метаболические сигналы, а возможно, и сигналы, обусловливающие секрецию СТГ, связанную со сном, хотя по этому вопросу еще имеются разногласия. В регуляции связанной со сном секреции СТГ участвуют, по-видимому, и холинергические механизмы. Аналоги энкефалина стимулируют секрецию СТГ [76], но роль эндогенных энкефалинов в регуляции секреции этого гормона пока не ясна. Кроме того, имеются данные о стимулирующем влиянии на его секрецию ГАМК-ергических нейронов [77].
ПРОЛАКТИН
Действие
Основной мишенью действия пролактина служит молочная железа, где он в сочетании с другими гормонами стимулирует развитие специфической ткани и лактацию. Пролактин необходим для нормального развития молочных желез у животных многих видов, но у человека его важность в этом отношении пока не установлена. Патологическое увеличение секреции пролактина обычно не сопровождается увеличением размеров молочных желез, а у мужчин гинекомастия развивается на фоне нормального уровня пролактина. Во время беременности пролактин в сочетании с эстрогенами, прогестероном и плацентарным лактогеном и в присутствии инсулина и кортизола обеспечивает дальнейшее развитие молочных желез, что приводит в конце концов к выработке молока. Пролактин специфически стимулирует синтез белков, в том числе лактальбумина, а также жиров и углеводов молока. В интактной ткани молочной железы были найдены и частично охарактеризованы рецепторы пролактина, которые локализуются на альвеолярных поверхностях клеток. Рецепторы пролактина выявлены также в ткани печени и почек, причем пролактин, по-видимому, может увеличивать число своих собственных рецепторов.
Начало лактации после родов обусловлено резким снижением уровня эстрогенов и прогестерона плацентарного происхождения. Действительно, эстрогены, будучи синергистами пролактина в отношении стимуляции развития молочных желез, одновременно являются его антагонистами в отношении влияния на лактацию. Этот феномен служит основой применения эстрогенов для угнетения лактации в послеродовом периоде, а также объясняет частое появление галактореи у женщин с гиперпролактинемией после прекращения приема оральных контрацептивов.
Для поддержания начавшейся лактации требуется непрерывная секреция пролактина. Ее торможение с помощью фармакологических или хирургических средств приводит к прекращению лактации. Секреция пролактина, стимулируемая актом сосания, в течение послеродового периода постепенно снижается до нормального уровня. Однако истинный рефлекс «выброса» молока опосредуется не пролактином, а секрецией окситоцина задней долей гипофиза. Окситоцин вызывает сокращение миоэпителпальных клеток вокруг терминальных ацинарных долек, которые выталкивают содержащееся в них молоко в протоки между дольками.
У крыс пролактин необходим для поддержания секреторной активности желтого тела и поэтому играет роль в сохранении беременности на ее ранних стадиях. У человека этот эффект, по-видимому, не является обязательным, хотя для продукции прогестерона клетками гранулезы человека все же нужны небольшие количества пролактина [78]. Высокий его уровень, напротив, обусловливает прогрессирующее торможение секреции прогестерона. Пролактин вместе с ФСГ и ЛГ присутствует в фолликулярной жидкости, причем есть данные, согласно которым он может блокировать стимулирующее влияние ФСГ на секрецию эстрогенов развивающимся граафовым пузырьком.
Помимо своего влияния на физиологию репродуктивной системы, пролактин у животных некоторых видов оказывает действие на поведение, а также на водно-электролитный обмен, хотя в отношении человека данные о подобных эффектах пока не слишком убедительны. У птиц и мышей пролактин усиливает проявления материнского инстинкта, что играет существенную роль в жизненном цикле этих видов. Хотя у человека повышенный уровень пролактина сопутствует многим психическим ощущениям (см. далее), усиление секреции гормона является, по-видимому, следствием, а не причиной таких ощущений. У млекопитающих некоторых видов пролактин снижает также экскрецию натрия, калия и воды почками и потенцирует эффекты альдостерона и вазопрессина. Попытки обнаружить эти эффекты у человека пока не увенчались успехом.
Метаболические эффекты пролактина у гипофизэктомированных животных напоминают таковые гормона роста и включают стимуляцию синтеза белка, калоригенеза и образования в хряще хондроитинсульфата. Введение овечьего пролактина людям с дефицитом гормона роста вызывает задержку азота, гиперкальциурию, мобилизацию липидов, нарушение толерантности к углеводам и некоторый рост скелета. У больных с гиперпролактинемией можно наблюдать и гиперинсулинемию, свидетельствующую об инсулинорезистентности, которая исчезает после подавления секреции пролактина [79].
Методы определения
Биологические методы. Стимулирующее влияние пролактина на зобный мешок голубей легло в основу биологического определения этого гормона, применявшегося в течение многих лет. Чувствительность биологического определения удалось повысить путем регистрации синтеза лактозы или казеина в молочных железах мышей в середине беременности. Эти методы обеспечили получение многих данных о содержании пролактина в плазме, но впоследствии все же были вытеснены радиоиммунологическими методами.
Радиоиммунологические методы. Уже вскоре после идентификации пролактина человека в качестве отдельного гормона был разработан метод его радиоиммунологического определения с использованием антител к овечьему пролактину, которые дают перекрестную реакцию с гормоном человека [80]. В настоящее время вместо гетерологичных антител в соответствующих методах используют гомологичные антитела к пролактину человека. Специфичность этих методов относительно высока, и сколько-нибудь значительная перекрестная реакция с СТГ или плацентарным лактогеном человека отсутствует.
Радиорецепторные методы. Разработаны также радиолигандные методы определения пролактина, в которых чаще всего используют мембраны молочных желез беременных крольчих [81]. Хотя эти методы достаточно чувствительны для определения уровней пролактина в плазме, надежность их ограничивается тем, что мембраны связывают и СТГ, который вытесняет радиоактивный пролактин. Как и в отношении СТГ, сравнение результатов радиоиммунологического и радиорецепторного определений может помочь различить биологически активный и биологически неактивный пролактин, что имеет существенное значение при некоторых клинических состояниях.
Уровень гормона в гипофизе и плазме
Гипофиз. По данным радиоиммунологических определений в гипофизе человека содержится приблизительно 100 мкг пролактина. Это количество значительно меньше, чем количество СТГ (примерно 10% от содержания СТГ) и, кроме того, по отношению к СТГ меньше, чем у большинства видов млекопитающих. Приведенная цифра вызывает некоторые сомнения в отношении полноты экстракции, поскольку в сутки секретируется в несколько раз больше пролактина, чем содержится в гипофизе (см. далее), что отличается от ситуации в отношении других гормонов передней доли гипофиза.
Плазма. Уровень пролактина в плазме, определяемый в разных лабораториях, варьирует, причем в последние годы с применением более специфических антисывороток к пролактину наметилась тенденция к снижению находимых его концентрацией. Средний уровень пролактина составляет примерно 5 нг/мл у мужчин и 8 нг/мл у женщин, и, по данным большинства лабораторий, верхняя граница его содержания достигает 15—20 нг/мл. Пролактин в плазме удается определить у всех здоровых людей.
У плода уровень пролактина в плазме очень высок и после 20-й недели беременности может превышать 300 нг/мл. В момент родов в крови пупочной вены содержится больше пролактина, чем в материнской крови, что убедительно свидетельствует о секреции пролактина именно плодом. У анэнцефалов определяют аналогичные концентрации гормона, что указывает на необязательность сохранности гипоталамуса для развития пролактинсекретирующей функции плода. Пролактин секретируется также хориондецидуальной тканью плаценты, и в амниотической жидкости он содержится в высокой концентрации [82].
За несколько первых месяцев жизни содержание пролактина у новорожденных снижается до уровня, наблюдаемого у взрослых. Половые различия в содержании пролактина возникают в пубертатном периоде и обусловливаются главным образом эффектами эстрогенов. У женщин в менопаузе уровень пролактина снижается. Его реакции почти на все стимулы секреции пролактина у женщин выше, чем у мужчин, а введение эстрогенов мужчинам усиливает эти реакции. На протяжении беременности содержание пролактина непрерывно увеличивается вплоть до родов, после которых оно начинает снижаться, и даже при продолжающемся кормлении грудью через несколько месяцев возвращается к уровню, характерному для небеременных.
Метаболический клиренс и секреция
Ограниченная доступность пролактина человека препятствует широким исследованиям скорости метаболического клиренса этого гормона. Данные, полученные с помощью меченого пролактина, свидетельствуют о том, что скорость его метаболического клиренса составляет примерно 40 мл/м2 в 1 мин или около Уз таковой СТГ [83]. Почки определяют приблизительно 25% клиренса пролактина, а остальная его часть, как считают, осуществляется печенью. Период полужизни пролактина в плазме равен примерно 50 мин, т. е. почти в 3 раза превышает таковой СТГ. Скорость секреции пролактина, вычисляемая на основании результатов изучения метаболического клиренса, составляет примерно 400 мкг в сутки, Регуляция секреции
В отличие от того что наблюдают в отношении других гормонов передней доли гипофиза, нейроэндокринная регуляция продукции пролактина имеет в основном ингибиторный характер. Нарушение целостности гипоталамо-гипофизарной оси, будь то вследствие перерезки ножки гипофиза, разрушения гипоталамуса или пересадки гипофиза (у экспериментальных животных) в другую область организма, приводит к повышению секреции пролактина. Выделение гипоталамического ингибитора (пролактинингибирующий фактор, или ПИФ) находится под дофаминергическим контролем и, по мнению некоторых исследователей, им может быть сам дофамин. Дофамин обнаруживается в крови воротных сосудов гипофиза крыс и связывается со специфическими рецепторами на лактотрофах, что приводит к непосредственному торможению секреции пролактина. Однако дофамин, образующийся вне мозга, по-видимому, играет минимальную роль в регуляции секреции пролактина.
Как и в отношении гормона роста, существует двойная регуляция секреции пролактина: стимулирующий и тормозной компоненты. Вначале стимулирующим фактором, выделение которого контролируется серотонинергическими механизмами, принято было считать ТРГ, столь же сильно стимулирующий секрецию пролактина, что и ТТГ. Рецепторы лактотрофов связывают ТРГ, который активирует аденилатциклазу и увеличивает как синтез, так и секрецию пролактина. Однако опосредуемая нейроэндокринными механизмами секреция пролактина и ТТГ чаще не совпадает, чем оказывается согласованной; например, при охлаждении повышается секреция ТТГ, но не пролактина, а у кормящей женщины, а также при стрессе повышается секреция пролактина, но не ТТГ. Эти данные свидетельствуют о том, что пролактинстимулирующим фактором является не ТРГ. Отличный от ТРГ гипоталамический фактор, стимулирующий секрецию пролактина, уже описан, но его структура и физиологическая роль еще ждут своей оценки [84].
Факторы, влияющие на секрецию пролактина, перечислены в табл. 7—5. К физиологическим стимулам, кроме упомянутых беременности и кормления грудью, относятся раздражение соска молочной железы как у мужчин, так и у женщин и половые сношения (что отчасти также связано с раздражением соска молочной железы). Легко можно наблюдать повышение секреции пролактина во время сна, начинающееся через 60—90 мин после засыпания. Вспышки секреции пролактина продолжаются в течение всего периода сна, что обусловливает максимальное содержание гормона в плазме через 5—8 ч после засыпания. В отличие от того что наблюдают в отношении СТГ, секреция пролактина происходит не во время глубокого сна (стадии III и IV) (см. рис. 7— 8). Напряженная физическая работа также стимулирует секрецию пролактина, возможно, с помощью тех же механизмов, которые участвуют в стимуляции секреции СТГ, поскольку, подобно секреции последнего, выделение пролактина стимулируется в условиях гипогликемии и часто тормозится в условиях гипергликемии.
Таблица 7—5. Факторы, влияющие на секрецию пролактина
|
Стимулирующие |
Угнетающие |
|
|
Физиологические |
||
|
Беременность Кормление грудью Раздражение соска молочной железы Половое сношение (только у женщин) Физическая работа Сон Стресс |
||
|
Фармакологические |
||
|
Гипогликемия Гормоны: эстрогены ТРГ Нейротрансмиттеры и др.: дофаминергические антагонисты (фенотиазины, бутирофеноны) средства, снижающие содержание катехоламинов и ингибиторы их синтеза (резерпин, a-метилдофа) предшественники серотонина (5-ОТ) агонисты ГАМК (муспимол) антагонисты Нз-репепторов гистамина (пиметидин) опиаты и др. (морфин, аналоги энкефалина) |
Гипергликемия1 Гормоны: глюкокортикоиды тироксин Нейротрансмиттеры и др.: дофаминергические агонисты (L-дофа, апоморфин, дофамин, бром криптин) антагонисты серотонина (метизер-гид) |
|
|
Патологические |
||
|
Хроническая почечная недостаточность Цирроз печени Гипотиреоз |
||
1 Эффект наблюдается не всегда
На секрецию пролактина влияют многие гормоны. Эффекты эстрогенов замыкаются непосредственно на лактотрофах, заключаются в повышении как исходной, так и стимулируемой секреции и могут наблюдаться в течение 2—3 дней. Глюкокортикоиды снижают реакцию пролактина на ТРГ, причем их действие также локализуется на уровне гипофиза. При введении тиреоидных гормонов не изменяется исходный уровень пролактина, но подавляется его реакция на ТРГ. Эта реакция усиливается при гипотиреозе, снижается при гипертиреозе и нормализуется при адекватном лечении этих состояний. У небольшого числа больных с первичным гипотиреозом отмечается гиперпролактинемия, а у некоторых — и галакторея.
Уровень пролактина изменяется под влиянием разнообразных средств, обладающих нейрофармакологической активностью [74]. Все вещества, повышающие дофаминергическую активность, например L-дофа (предшественник), бромокриптин и апоморфин (дофаминергические агонисты), а также сам дофамин, подавляют секрецию пролактина. Дофамин влияет непосредственно на гипофиз, тогда как другие агенты действуют как на гипофизарном, так и на центральном уровнях. Антагонисты рецепторов дофамина, к которым относятся прежде всего нейролептики, фенотиазины [хлорпромазин (аминазин), прохлорперазин] и бутирофенолы (галоперидол), повышают уровень пролактина и иногда вызывают галакторею. Пролактинповышающие эффекты этих соединений тесно коррелируют с их антипсихотической активностью [85], хотя максимальная стимуляция секреции пролактина наблюдается под влиянием более низких доз, чем те, которые необходимы для воспроизведения психотропных эффектов, несмотря на данные, указывающие на различия дофаминовых рецепторов в гипофизе и ЦНС [.86]. Сходным стимулирующим действием обладает и резерпин, снижающий запасы катехоламинов в ЦНС.
G-аминомасляная кислота (ГАМК) непосредственно не влияет на секрецяю пролактина, но недавно полученный аналог ГАМК мусцимол, проникающий через гематоэнцефалический барьер после системного введения, стимулирует выделение пролактина [77]. Влияние гистамина на секрецию пролактина изучено недостаточно. Циметидин, блокатор гистаминовых Н2-рецепторов, равно как и сам гистамин, стимулируют выделение пролактина, действуя опосредованно через центральные механизмы, что указывает на сложную роль этого нейротрансмиттера [87, 88а]. Поскольку блокаторы серотониновых рецепторов угнетают реакции пролактина на стресс и кормление грудью, считается, что в этих реакциях принимают участие и серотонинергические механизмы. Опиаты и эндорфины повышают секрецию пролактина [76].
Усиление секреции пролактина при хирургическом стрессе наиболее отчетливо проявляется в условиях операций, производимых под общей анестезией, и эта реакция частично (хотя и не полностью) может быть результатом применения определенного анестезирующего средства. Повышение секреции пролактина, наблюдаемое после травм грудной клетки и операций на органах грудной полости, также может обусловливаться не только стрессорными механизмами, но и стимуляцией афферентных нервов, отходящих от области соска молочной железы.
У 65% больных с хронической почечной недостаточностью, находящихся на гемодиализе, встречается гиперпролактинемия, причем у женщин при этом часто развивается галакторея [88Ь].
У таких больных обнаруживают нарушение реакций пролактина на кратковременное дофаминергическое угнетение, а также на стимуляцию ТРГ и хлорпромазином (аминазин). Хотя при; уремии тормозится метаболический клиренс пролактина, но повышается скорость его секреции, что свидетельствует о нарушении в системе обратной связи [83]. Пересадка почки обычно сопровождается нормализацией уровня пролактина.
ГИПОПИТУИТАРИЗМ
В основе гипопитуитаризма могут лежать различные причины,, приводящие к частичной или полной утрате функций передней а задней долей гипофиза. Клинические проявления гипопитуитаризма широко варьируют в зависимости от возраста в момент заболевания, скорости его развития, вовлечения в процесс того или иного гормона и степени нарушения его секреции, равно как и от характера первичного патологического процесса. В своей наиболее легкой форме гипопитуитаризм может в течение многих лет оставаться нераспознанным, тогда как при полном выпадении гормональной секреции может возникнуть угроза для жизни больного-и потребоваться неотложная помощь.
ЭТИОЛОГИЯ
Гипопитуитаризм можно разделить на первичный и вторичный» Первичный гипопитуитаризм является следствием отсутствия или разрушения секретирующих гормон клеток гипофиза. тогда как вторичный обусловлен дефицитом стимулирующих влияний на секрецию гипофизарных гормонов, вызванных нарушением сосудистых и/или нервных связей с мозгом на уровне ножки гипофиза, гипоталамуса.или внегипоталамических областей ЦНС. Недостаточность секреции гормонов передней доли гипофиза в таких случаях является результатом отсутствия соответствующих рилизинг-факторов, тогда как снижение секреции гормонов задней доли — результатом отсутствия синтеза и аксонального транспорта гормонов из места их образования в переднем гипоталамусе; последняя проблема подробнее рассматривается в главе 9.
В табл. 7—6 перечислены различные заболевания, сопровождающиеся гипопитуитаризмом. В силу того что больной с гипопитуитаризмом может предстать во многих обликах невозможно надежно оценить вероятность развития гипопитуитаризма при том или ином патологическом процессе.
ПЕРВИЧНЫЙ ГИПОПИТУИТАРИЗМ
Впервые связь между клиническими проявлениями гипопитуитаризма и ишемическим некрозом гипофиза установил Simmoncb [89] в своем классическом описании случая тяжелого послеродового сепсиса, хотя первое описание острого некроза гипофиза появилось годом раньше [90]. Sinunonds подчеркнул термин «кахексия» и в течение многих десятилетий этот симптом ошибочно считали важным признаком заболевания. В действительности же как было установлено впоследствии, у единственного истощенного больного, фотография которого переходила из руководства в руководство, гипофиз не был изменен, и, по всей вероятности, он страдал нервной анорексией. Широкие исследования Sheehan [91] впервые позволили четко разграничить некроз гипофиза и гипопитуитаризм. Было показано, что следствием ишемического некроза и инфаркта гипофиза, часто развивающегося в результате послеродового кровотечения и сосудистого коллапса, является фиброз этой железы. Были представлены также доказательства того, что кахексия не обязательно или не часто встречающееся проявление этого заболевания. Механизм развития острого ишемического некроза не совсем ясен, но большинство исследователей считают, что он развивается вследствие спазма сосудов гипофиза. То ли изменения в гипофизе во время беременности, сопровождающиеся заметным увеличением его размера под действием эстрогенов, увеличивают чувствительность его сосудов к сосудосуживающим влияниям, то ли сама железа становится чувствительнее к гипоксии — неизвестно. Однако некроз гипофиза чаще всего развивается сразу после родов и связан с тяжелым кровотечением и снижением артериального давления. Гипопитуитаризм той или иной степени развивается почти у 32% женщин, в родах перенесших кровотечение и сосудистый коллапс [92]. Степень некроза гипофиза и последующего гипопитуитаризма зависит от тяжести кровопотери. Наиболее важным указанием на развитие некроза гипофиза служит отсутствие способности к лактации в послеродовом периоде и восстановления менструального цикла. Однако в силу медленного развития картины гипопитуитаризма и часто неполного его клинического проявления сохранение способности к послеродовой лактации не исключает, по крайней мере частичной, гипофизарной недостаточности. Расхождение частоты встречаемости ишемического некроза гипофиза и гипопитуитаризма делает очевидным существование больших резервных возможностей передней доли железы. Клинические проявления гипопитуитаризма не возникают до тех пор, пока не будет разрушено 70—75% ткани аденогипофиза, хотя при современных методах тестирования гормональной функции снижение гипофизарных резервов, вероятно, можно обнаружить при менее выраженной деструкции железы. Для развития полного гипопитуитаризма необходимо, чтобы было разрушено не менее 90% всего гипофиза. В связи с этим у многих больных с некрозом гипофиза минимальные признаки гипопитуитаризма могут быть не выявлены в течение длительного времени или вообще не обнаружены.
Таблица 7—6. Патологические состояния, приводящие к гипопитуитаризму
|
I. Первичный |
П. Вторичный |
|
А. Ишемический некроз гипофиза 1. Послеродовой (синдром Шиена) 2. Сахарпый диабет 3. Прочие системные заболевания (воспаление височных артерий, серповидноклеточная анемия и ее признаки, артериосклероз, эклампсия) Б. Опухоли гипофиза 1. Первичные локализующиеся в турецком седле (хромофобная аденома, краниофарингиома) 2. Параселлярные (менингиома, глиома зрительного нерва) В. Внутричерепная аневризма внутренней сонной артерии Г. Кровоизлияние в гипофиз (почти всегда связанное с первичной опухолью гипофиза) Д. Тромбоз кавернозного синуса Е. Инфекционные заболевания (туберкулез, сифилис, малярия, менингит, грибковые поражения) Ж. Инфильтративные поражения (гемохроматоз) 3. Иммунологические нарушения (при злокачественной анемии или после повторных инъекций гетерологичных гипофизарных гормонов) И. Ятрогенный 1. Облучение носоглотки 2. Облучение турецкого седла 3. Хирургическое разрушение И. Синдром первично «пустого» турецкого седла К. Метаболические расстройства (хроническая почечная недостаточность) Л. Идиопатический (часто моногормональный и иногда семейный) |
А. Разрушение ножки гипофиза 1. Травма 2. Сдавление опухолью или аневризмой 3. Ятрогенное (хирургическое) Б. Поражения гипоталамуса или других отделов нервной системы (саркоидоз) 1. Воспалительные 2. Инфильтративные (болезни отложения липидов) 3. Травматические 4. Токсические (винкристин) 5. Вызванные гормонами (глю-кортикоиды, половые стероиды) 6. Опухолевые (первичные, метастатические, лимфомы, лейкемия) 7. Идиопатические (часто врожденные или семейные, нередко затрагивающие секрецию одного или двух гормонов и могут быть преходящими) 8. Алиментарные (голодание, ожирение) 9. Нервная анорексия 10. Психосоматическая карликовость 11. Пинеалома |
В последние 40 лет в связи с улучшением акушерской помощи синдром гипофизарного некроза стал встречаться гораздо реже. Следует подчеркнуть, однако, что значительная кровопотеря и шок, будучи важными предрасполагающими факторами, все же не являются абсолютно необходимым условием развития этого синдрома. Ишемический некроз гипофиза может развиться при многих других патологических состояниях, хотя и с весьма низкой частотой. Его находили при аутопсии у 2% умерших больных сахарным диабетом [93], хотя у большинства из них клинические признаки гипопитуитаризма отсутствовали. Развитие гипопитуитаризма у больных диабетом может существенно снижать потребность в инсулине главным образом вследствие дефицита глюкокортикоидов. Некроз гипофиза описан при эпидемической геморрагической лихорадке, но быстро наступающая смерть больных препятствовала оценке функции гипофиза у них. Его наблюдали также при других заболеваниях, в том числе при малярии, воспалении височной артерии, гемохроматозе, серповидноклеточной анемии, менингите, эклампсии, тяжелых авитаминозах, а иногда и в отсутствии какой-либо предрасполагающей болезни [94]. У некоторых больных гипофиз был достаточно разрушен, чтобы обусловить клинические проявления гипопитуитаризма, тогда как у других больных для выявления нарушений гормональной секреции требовалось провести подробное обследование.
В настоящее время наиболее частой причиной гипопитуитаризма с множественной гормональной недостаточностью среди взрослого населения является опухоль гипофиза (что подробнее рассматривается далее). Параселлярные опухоли также могут инвазировать турецкое седло и вызывать такие разрушения гипофиза, которые обусловят гипопитуитаризм. К аналогичному разрушению могут приводить и аневризмы внутричерепных ветвей внутренней сонной артерии, причем, чтобы отличить аневризму от интраселлярной опухоли гипофиза, часто требуется провести ангиографию сонных артерий.
Гипопитуитаризм в той или иной степени может явиться результатом кровоизлияния в гипофиз (апоплексия гипофиза), связанного с функционирующими или нефункционирующими опухолями этой железы. Клинические проявления кровоизлияния широко варьируют. Если кровоизлияние происходит постепенно, приводя к сдавлению гипофиза, то преобладают симптомы гипопитуитаризма, если же остро, то оно проявляется головной болью, офтальмоплегией и явлениями субарахноидального раздражения. В типичных случаях у больных появляются признаки внезапного роста предсуществующей аденомы гипофиза. Состояние большинства больных улучшается без немедленного хирургического вмешательства, хотя в некоторых случаях появляется необходимость коррекции зрительных нарушений. У большинства больных происходит определенное снижение функции передней доли гипофиза [95], но функция задней доли почти всегда сохраняется. В течение острого периода следует проводить лечение глюкокортикоидами.
С изменением структуры заболеваемости и прогрессом в лечении инфекционных болезней за несколько последних десятилетий классические причины гипопитуитаризма, такие, как туберкулез и сифилис, стали встречаться крайне редко. С другой стороны, признаки гипофункции гипофиза начали выявляться при более подробном обследовании больных с другими заболеваниями. Почти у 50% больных с гемохроматозом, у которых частым и ранним симптомом является снижение половой функции, обнаруживаются признаки нарушения секреции гонадотропинов [96]. У некоторых больных отмечается также недостаточность коры надпочечников вследствие нарушения секреции АКТГ. Причина этих нарушений заключается в отложении железа в гипофизе, что часто наблюдается при гемохроматозе. Иногда причиной гипопитуитаризма могут быть также иммунологические повреждения гипофиза [97].
Все чаще причиной гипопитуитаризма (как первичного, так и вторичного) становится применение ионизирующего излучения при лечении злокачественных новообразований органов головы и шеи (рак носоглотки, опухоли мозга, профилактическое облучение черепа при лейкозе) [98, 99]. Наиболее частым проявлением гипопитуитаризма у детей в этих случаях бывает задержка роста или отсутствие полового созревания, тогда как у взрослых на первый план выступают симптомы гонадотропной недостаточности. Гипопитуитаризм можно обнаружить через 6—12 мес после облучения в дозе 3000 рад (30 Дж/кг). Интактный гипофиз у детей, по-видимому, более чувствителен к облучению, чем у взрослых, у которых для разрушения гипофиза при раке молочной железы или диабетической ретинопатии приходится применять значительно большие дозы облучения — 10 000—18 000 рад (100— 180 Дж/кг). Для лечения опухолей гипофиза применяют облучение в дозе 4500—5000 рад (45—50 Дж/кг), причем в ближайшие сроки после него гипопитуитаризм встречается относительно редко (см. далее). Однако для определения истинной частоты ятрогенного гипопитуитаризма в этих случаях требуется обследование облученных больных в отдаленные сроки.
В ходе хирургического лечения опухолей гипофиза или в случае воздействия на него при раке молочной железы или диабетической ретинопатии иногда приходится удалять всю железу, что вызывает пангипопитуитаризм, требующий неотложного лечения.
Гипопитуитаризм нередко сопровождает синдром первичного «пустого» турецкого седла, который подробнее рассматривается в разделе об опухолях гипофиза. Хотя среди больных с этим синдромом встречались лица, у которых при исследовании эндокринных функций была обнаружена недостаточность одного или нескольких гипофизарных гормонов, но частота клинического (предъявление жалоб) гипопитуитаризма в этих случаях обычно не превышает 10% [100, 101].
Гипопитуитаризм может встречаться и вне всякой видимой первичной патологии, причем чаще всего при этом наблюдается недостаточность одного или нескольких, но не всех, гипофизарных гормонов. Хотя такие случаи обычно встречаются спорадически, но имеются сообщения об аутосомных или Х-сцепленных рецессивных вариантах гипопитуитаризма с уменьшенным, нормальным или даже слегка увеличенным турецким седлом [102—104]. Проявления и подробная характеристика различных видов идиопатического гипопитуитаризма изложены далее при описании недостаточности отдельных гормонов гипофиза.
При хронической почечной недостаточности установлено нарушение секреции ТТГ и гонадотропинов, обусловленное сочетанными дефектами на гипофизарном и гипоталамическом уровнях [105, 106]. Конкретный фактор (факторы), вызывающий эти дефекты, пока не известен, но пересадка почки, по-видимому, ликвидирует такие нарушения.
ВТОРИЧНЫЙ ГИПОПИТУИТАРИЗМ
Вторичный гипопитуитаризм может явиться следствием многочисленных нарушений ЦНС, общим результатом которых является прекращение нормального поступления в гипофиз факторов, регулирующих его активность. Отдифференцировать первичный гипопитуитаризм от вторичного при отсутствии четких заболеваний гипофиза или ЦНС часто, но не всегда удается путем применения доступных в настоящее время рилизинг-факторов — ТРГ и ГнРГ. Критерии, на основании которых нарушения секреции СТГ, пролактина и АКТГ считают следствием патологии ЦНС, а не самого гипофиза, описаны в разделе, посвященном лабораторным анализам у больных с гипопитуитаризмом.
Ножка гипофиза чаще всего вовлекается в патологический процесс вследствие травмы. При переломах основания черепа ножка иногда разрывается, что приводит к перерыву как нервных, так и сосудистых связей гипофиза. Сильное сдавление ножки с нарушением кровотока в воротных сосудах и развитием гипопитуитаризма могут вызывать параселлярные опухоли и аневризмы. Иногда вместо гипофизэктомии производят перерезку ножки гипофиза с целью вызвать гипопитуитаризм. Результаты этой операции отличаются от результатов гипофизэктомии тем, что: 1 — уровень пролактина благодаря выпадению действия гипоталамического пролактинингибирующего фактора часто повышается и остается повышенным, если только сохраняется кровоснабжение, достаточное для обеспечения жизнедеятельности лактотрофов; 2 — если на месте пересечения ножки не оставить какой-либо преграды, то развивающаяся неоваскуляризация иногда приводит к восстановлению воротного кровообращения и функции гипофиза.
Гипопитуитаризм обусловливается и такими поражениями ЦНС, особенно гипоталамуса, которые сопровождаются нарушением секреции рилизинг-факторов. Воспалительные заболевания, такие, как саркоидоз и инфильтративные процессы, в том числе болезни отложения липидов и эозинофильная гранулема, часто приводят к нарушению секреции ТТГ, гонадотропинов, СТГ и реже — АКТГ и вазопрессина. Уровень пролактина нередко повышается, что подтверждает супраселлярную локализацию процесса. Частота множественной гормональной недостаточности как при этих, так и при других повреждениях гипоталамуса зависит от их размеров и локализации. Чем ближе к границе срединного возвышения, где проявляется туннельный эффект гипоталамуса, тем больше вероятность развития множественной гормональной недостаточности.
При тяжелых повреждениях черепа часто травмируется и гипоталамус. Признаки гипопитуитаризма нередко наблюдаются у больных с длительной комой [ 107], причем улучшение неврологического статуса обычно (но не всегда) сопровождается восстановлением функции гипофиза, хотя часто сохраняются остаточные явления его гипофункции.
Вещества, применяемые для лечения злокачественных новообразований (например, винкристин), могут оказывать токсическое влияние и на гипоталамус, приводя к нарушению секреции гипофизарных гормонов. Функциональные нарушения секреции АКТГ и гонадотропинов могут встретиться также при длительном лечении глюкокортикоидами и применении оральных контрацептивов вследствие постоянного торможения выделения специфических рилизинг-факторов по механизму усиленной отрицательной обратной связи. Эти нарушения обычно обратимы, хотя для восстановления функции гипофиза может потребоваться довольно длительное время. Восстановление функции гипоталамо-гипофизарно-надпочечниковой системы после удаления аденомы коры надпочечников может происходить в течение 18—24 мес; такого же срока может требовать восстановление циклической овуляции после отмены оральных контрацептивов. Хотя при длительном приеме экзогенных тиреоидных гормонов у эутиреоидных лиц удается наблюдать временное снижение гипофизарного резерва ТТГ, клинические признаки гипотиреоза в таких случаях наблюдаются редко.
К нарушению функции гипофиза могут приводить опухоли гипоталамуса и III желудочка или поражение гипоталамуса лимфоматозными и лейкозными инфильтратами. При успешном лечений основного заболевания можно добиться некоторого восстановления функций гипофиза.
Как и при первичном гипопитуитаризме, снижение секреции гормонов гипофиза может возникать и при таких нарушениях в ЦНС, которые не сопровождаются какими-либо субъективными или объективными признаками. В этих случаях гормональная недостаточность может быть изолированной или множественной, и заболевание может проявляться в любом возрасте. Наиболее частой причиной недостаточности гормона роста в детстве, будь то изолированная его недостаточность или сочетающаяся с недостаточностью ТТГ, гонадотропинов или АКТГ, является пока еще не идентифицированное нарушение секреции соответствующих гипоталамических рилизинг-факторов. У взрослых чаще всего наблюдается нарушение секреции гонадотропинов (гипоталамический гипогонадизм или гипоталамическая аменорея). Как у детей, так и у взрослых гипоталамический гипопитуитаризм может являться следствием эмоциональных сдвигов и быть поэтому обратимым.
Дисфункция гипоталамуса, приводящая к нарушению секреции гонадотропинов, может возникать при резких изменениях массы тела. Как недоедание, так и выраженное ожирение часто сопровождаются аменореей, сохраняющейся до восстановления нормальной массы тела. У больных с нервной анорексией наблюдается снижение секреции гонадотропинов и иногда ТТГ. Хотя уменьшение массы тела играет самостоятельную роль в патогенезе эндокринных расстройств, в нем принимают участие и другие пока еще не известные факторы, поскольку аменорея часто предшествует уменьшению массы тела и может сохраняться после ее восстановления.
При пинеаломах описано как преждевременное половое созревание, так и гипогонадизм. Предполагается, что опухоль секретирует ингибитор гонадотропинов, химическая природа которого пока не известна. Подробнее эти расстройства рассматриваются в следующей главе.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ГИПОПИТУИТОРИЗМА
Признаки и симптомы гипопитуитаризма варьируют в зависимости от степени снижения секреции отдельного гипофизарного гормона и скорости развитая заболевания. На оба этих фактора влияет причина заболевания. При полном или тотальном пангипопитуитаризме, который наблюдается, например, после хирургической гипофизэктомии, тяжелого кровоизлияния в гипофиз или отмены гормонотерапии у гипофизэктомированных лиц, клинические проявления могут возникать уже через несколько часов (несахарный диабет) или дней (недостаточность функции надпочечников). При частичном гипопитуитаризме, чаще наблюдающемся при опухолях или инфильтративных процессах, признаки и симптомы прогрессируют медленно и могут быть неопределенными и неспецифическими, что в течение длительного времени не позволяет поставить диагноз. Разнообразные клинические проявления гипопитуитаризма целесообразнее описать, рассмотрев вначале эффекты недостаточности отдельных гипофизарных гормонов, а затем — взаимодействие этих эффектов.
Адренокортикотропный гормон
Недостаточность АКТГ проявляется снижением функции коры надпочечников и многие признаки и симптомы недостаточности функции надпочечников одинаковы независимо от того, связана она с поражением гипофиза или самих надпочечников. Обычно при этом наблюдают слабость, постуральную гипотензию и обезвоживание, хотя истинный аддисонический криз возникает редко в силу частичной независимости ренин-ангиотензин-альдостероновой системы от секреции АКТГ. Так, при гипопитуитаризме секреция альдостерона, хотя и снижается, но в меньшей степени, чем при первичной надпочечниковой недостаточности. Могут возникать также тошнота, рвота и резкая гипертермия. Иногда вследствие нарушения глюконеогенеза наблюдается гипогликемия, особенно после длительного голодания и/или приема умеренного количества алкоголя. У больных с изолированным дефицитом АКТГ гипогликемия может быть единственным симптомом заболевания. В отличие от больных с первичной недостаточностью функции надпочечников, при которой секреция АКТГ повышена, при дефиците АКТГ редко встречается гиперпигментация. В действительности могут наблюдаться даже депигментация и снижение степени загара при солнечном облучении. Поскольку секреция АКТГ часто выпадает не полностью, соответствующие симптомы у больных могут появляться только в периоды стресса (например, при хирургических вмешательствах, травмах, тяжелых инфекционных заболеваниях), что в течение длительного времени затрудняет постановку диагноза. Нарушение экскреции воды при водной нагрузке, наблюдаемое при аддисоновой болезни, встречается и при недостаточности АКТГ, но выражено слабее и часто маскируется одновременной недостаточностью вазопрессина (см. далее). Прекращение секреции надпочечниковых андрогенов у мужчин мало влияет на общее состояние, если сохранена функция семенников. Однако у женщин это может определять снижение либидо и играет главную роль в патогенезе выпадения волос под мышками и на лобке.
Тиротропный гормон
Состояния тиреоидной недостаточности, вызываемые снижением секреции ТТГ, называют вторичным или гипофизарным гипотиреозом. Клинические проявления первичного и вторичного гипотиреоза, как правило, не отличаются друг от друга, за исключением тяжести течения. У больных с дефицитом ТТГ нарушается толерантность к холоду, появляются запоры, сухость и бледность кожных покровов, замедление психических процессов, брадикардия и хриплый голос. Истинная микседема отмечается очень редко; нечасто встречается также гиперхолестеринемия и каротинемия. Может отмечаться как усиление, так и уменьшение менструальных кровотечений. Недостаточность ТТГ, возникающая в детстве, приводит к резкой задержке роста, резистентной к лечению СТГ. У некоторых больных с изолированной недостаточностью ТТГ наблюдали псевдогипопаратиреоз [ 108].
Лютеинизирующий и фолликулостимулирующий гормоны
Дефицит гонадотропинов у женщин проявляется аменореей и клиническими признаками эстрогенной недостаточности, в том числе атрофией молочных желез, сухостью кожи и снижением секреции влагалища, что часто становится причиной нарушения супружеских отношений. Может наступить и снижение либидо. У мужчин выпадение гонадотропной функции гипофиза сопровождается уменьшением размера яичек, которые становятся мягкими и относительно нечувствительными к давлению, а также симптомами снижения продукции андрогенов, к которым относится снижение либидо и потенции, замедление вторичного роста волос на соответствующих участках тела и уменьшение мышечной силы. Недостаточность гонадотропинов, развивающаяся до периода полового созревания или во время этого периода, приводит к полному или частичному отсутствию вторичных половых признаков. При изолированной недостаточности гонадотропинов или при сохранении секреции СТГ отсутствие вызываемого половыми стероидами закрытия эпифизарных зон в длинных костях обусловливает чрезмерный рост конечностей, что придает больному евнухоидный вид.
Гормон роста
Нарушение секреции СТГ у взрослых не сопровождается сколько-нибудь значительной клинической симптоматикой. Хотя СТГ обладает отчетливой метаболической активностью, но включение ряда компенсаторных механизмов при выпадении его эффектов маскирует клинические проявления дефицита этого гормона. У больных с дефицитом СТГ нарушается толерантность к углеводам, что связано с гипоинсулинемией. Однако это состояние резко отличается от сахарного диабета, прежде всего отсутствием микроангиопатии. СТГ принимает участие в заживлении ран, в силу чего можно ожидать (хотя это и не доказано), что при недостаточности СТГ сращение костей при переломах потребует большего времени. Недостаточность СТГ у детей сопровождается задержкой роста. У них часто наблюдается и гипогликемия натощак, которая становится постоянным симптомом при сочетании с недостаточностью АКТГ [109].
Пролактин
Единственным клиническим проявлением недостаточности пролактина служит отсутствие послеродовой лактации.
Вазопрессин
Отсутствие секреции антидиуретического гормона обусловливает синдром несахарного диабета, подробно рассматриваемый в главе 9. Почки теряют способность реабсорбировать воду, что приводит к полиурии и полидипсии, и без увеличения потребления жидкости (что часто встречается у больных со спутанным сознанием) может развиться тяжелая дегидратация. Больные страдают от сильной жажды, которая удовлетворяется предпочтительно ледяной водой. При дефиците АКТГ полиурия может и не проявляться, так как для экскреции свободной воды необходимы глюкокортикоиды. Развитие полиурии в процессе проведения пробы с АКТГ или после начала лечения глюкокортикоидами служит веским указанием на сочетанную недостаточность вазопрессина и АКТГ.
Окситоцин
Отсутствие окситоцина у человека не сопровождается клинической симптоматикой. У беременных с пангипопитуитаризмом начинается родовая деятельность, и роды протекают нормально, несмотря на отсутствие этого гормона.
Общая симптоматика
У больных с гипопитуитаризмом кожа часто теряет нормальный тургор и становится восковидной. Нередко наблюдается морщинистость ее, особенно вокруг рта и глаз, что преждевременно старит больного. Упитанность обычно сохраняется, а кахексия, которую Simmonds первоначально считал проявлением этого заболевания, была, вероятно, следствием нервной анорексии. Часто развивается умеренная анемия, обычно нормоцитарная, но иногда гипохромная или макроцитарная. Наиболее важным фактором патогенеза анемии является недостаточность тиреоидных гормонов, хотя определенная роль принадлежит, по-видимому, и снижению секреции тестостерона, а также нарушению продукции эритропоэтина. Гипопитуитаризм сопровождается изменениями психики, причем умственная отсталость или апатия наблюдались почти у половины больных, описанных Sheehan и Summers [ 110]. К другим симптомам нарушения психики относятся маниакальность и иногда параноидные психозы.
У больных гипопитуитаризмом без сахарного диабета в анамнезе углеводный обмен, как правило, почти не нарушается. Напротив, развитие гипопитуитаризма у больных диабетом, нуждающихся в лечении инсулином, приводит к выраженному снижению потребности в этом гормоне (часто на 20—50% от исходной дозы) и повышает наклонность к гипогликемическим реакциям. Эти изменения сохраняются даже на фоне полной заместительной терапии глюкокортикоидами, что указывает на важную роль СТГ, а также адреналина.
Относительная частота различных проявлений гипопитуитаризма зависит от причины этого расстройства. В публикациях последних лет описывают больных с опухолями гипофиза, которые на сегодня считают наиболее частой причиной гипопитуитаризма. Хотя результаты различных наблюдений и не полностью совпадают, но, по-видимому, раньше всего и поэтому чаще прекращается секреция СТГ, а затем гонадотропинов. Дефицит АКТГ и ТТГ встречается реже и развивается на более поздних стадиях заболевания. Однако возможность существования моногормональной или избирательной гипофизарной недостаточности резко ограничивает информативность оценки функции этой железы по результатам исследования одного—двух гормонов.
Изолированная гормональная недостаточность
Нередко дефицит отдельных гормонов гипофиза может встречаться даже без видимых анатомических изменений железы. Признаки и симптомы таких состояний описаны ранее. Недостаточность ТТГ и гонадотропинов часто невозможно клинически отличить от первичного снижения секреции гормонов желез-мишеней, тогда как дифференцировать недостаточность АКТГ от первичной надпочечниковой недостаточности помогает отсутствие гиперпигментации и пристрастия к соленому. Чаще всего встречается изолированный дефицит СТГ, являющийся болезнью детства и юношества. Локализацию первичного нарушения при изолированной гормональной недостаточности гипофиза обычно удается определить лишь при тщательном обследовании больного.
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ ГИПОПИТУИТОРИЗМА
Гипопитуитаризм можно спутать с болезнями двух категорий. К первой относится гормональная недостаточность, обусловленная первичной гипофункцией периферических желез или нарушениями в той области ЦНС, которая принимает участие в нейроэндокринной регуляции (гипоталамус). Вторая же охватывает заболевания, имеющие ряд общих с гипопитуитаризмом признаков и симптомов, но не связанных с гипофункцией эндокринных желез.
Гипофункция периферических желез внутренней секреции и гипоталамуса
Изолированную недостаточность гипофизарных гормонов следует отличать от первичной недостаточности функции щитовидной, надпочечных или половых желез. Как уже отмечалось, симптоматика в этих случаях может полностью совпадать с симптоматикой гипопитуитаризма. Последний особенно трудно дифференцировать от множественной недостаточности периферических желез (например, синдром Шмидта, при котором сочетается недостаточность функции щитовидной и надпочечных желез). Последний диагноз можно предположить на основании признаков «аутоиммунности» заболевания, наличия сахарного диабета, монилиаза или гипопаратиреоза и семейного характера этой патологии. Хотя степень гормональной недостаточности при первичном поражении периферических желез зачастую больше, чем при гипопитуитаризме, это не может служить дифференциально-диагностическим критерием, поскольку не исключена возможность неполной недостаточности функции периферической железы.
Характерным для первичной надпочечниковой недостаточности признаком служит гиперкалиемия, обусловленная снижением секреции альдостерона. При гипопитуитаризме же секреция альдостерона сохраняется в достаточной степени, чтобы предотвратить повышение уровня калия в сыворотке. В этих случаях отсутствуют также характерные для аддисоновой болезни гиперпигментация и потребность в соли. У некоторых больных с первичной недостаточностью функции половых желез может отмечаться расхождение между степенью нарушения секреции гормонов (андрогенов или эстрогенов), с одной стороны, и сперматогенеза или овуляции — с другой. При гипопитуитаризме обе функции половых желез обычно снижаются в равной степени. Первичная яичниковая недостаточность, будь то физиологическая (менопауза) или патологическая, часто, но не всегда, обусловливает некоторые характерные симптомы (горячие приливы), которые отсутствуют при вторичном по отношению к недостаточности гонадотропинов выпадении функции яичников.
Гипопитуитаризм следует отличать также от поражений ЦНС, сопровождающихся нарушением секреции рилизинг-факторов. На основании неэндокринной симптоматики, например аносмии при синдроме Каллманна или прогрессирующего ожирения, можно предположить внегипофизарное происхождение заболеваний. В дифференциальной диагностике этих нарушений решающая роль принадлежит, однако, лабораторным методам исследования, что подробнее рассматривается в следующей главе.
Неэндокринные расстройства
Гипопитуитаризм часто подозревают у больных с хроническим недоеданием или заболеванием печени, у которых отмечаются слабость, сонливость, непереносимость холода и снижение либидо. Как уже подчеркивалось, кахексия не является характерным признаком гипопитуитаризма, и она должна указывать на другое заболевание. С гипопитуитаризмом часто путают нервную анорексию, которая встречается главным образом у молодых женщин. Полезными дифференциально-диагностическими признаками служат резкое уменьшение массы тела, характерные расстройства психики и сохранение волос в подмышечной и лобковой областях. При хронической недостаточности питания и нервной анорексии секреция СТГ и АКТГ не только не снижается, но иногда даже повышается. Подробнее это состояние рассматривается в следующей главе.
Диагностические методы
Диагноз гипопитуитаризма должен устанавливаться с помощью адекватно и тщательно проводимого исследования секреции гормонов гипофиза, так как именно на этом основании принимают решение о пожизненной заместительной гормонотерапии. Исследования должны быть направлены на решение двух вопросов: 1 — снижена ли секреция гипофизарных гормонов; 2 — каков генез заболевания — гипофизарный или внегипофизарный. Кроме того, для выяснения причины гипопитуитаризма необходимы и неэндокринологические (нейроанатомические) исследования. Последние обсуждаются в разделе, посвященном опухолям гипофиза.
Диагностические методы исследования, направленные на оценку гормональной функции передней доли гипофиза, за последние годы претерпели существенные изменения и продолжают пересматриваться. Косвенные тесты, с помощью которых определяют функцию гипофиза, такие, как показатели углеводного обмена или оценка состояния желез-мишеней путем инъекции гипофизарных гормонов, уступают место непосредственному определению уровня (в крови) гормонов гипофиза. Разные лаборатории располагают разными возможностями, но в большинстве случаев исследования могут выполняться если не в отдельных лечебных учреждениях, то в центральных лабораториях.
В настоящем разделе рассматриваются способы определения 6 основных гормонов передней доли гипофиза, а также пути дифференциации области первичного поражения (гипофиз или вне-гипофизарные ткани). Обсуждаются показания к применению различных тестов, их преимущества и недостатки. В конце главы описаны специфические детали каждого метода и теста.
Гормоны передней доли гипофиза удобно разделить на две категории: 1 — для которых можно установить локализацию нарушения секреции—гипофиз или ЦНС (гипоталамус); к ним относятся ТТГ, пролактин и часто ЛГ и ФСГ; 2 — в отношении которых можно оценить состояние только всей нейроэндокринной гипоталамо-гипофизарной оси (АКТГ и СТГ).
Адренокортикотропный гормон
Для оценки секреции АКТГ давно используют определение уровня кортизола в плазме и 17-ОН-кортикостероидов (17-ОН-КС) в моче. Хотя интерпретация результатов соответствующих определений требует уточнения состояния самой коры надпочечников, эти методы сохраняют свое значение в силу малой доступности надежных способов определения АКТГ в плазме. Для определения уровня 17-OH-KG и 17-кетостероидов (17-КС) необходимо аккуратно собрать суточную мочу. Этот метод постепенно вытесняется методами определения гормонов в плазме, в которой вначале измеряли общее содержание кортикоидов, а позднее начали определять непосредственно кортизол. Поскольку дефицит АКТГ клинически проявляется недостаточностью коры надпочечников, определение кортизола в плазме является полезным диагностическим приемом. Гипопитуитаризм можно подозревать в том случае, если утром в плазме содержится менее 100 мкг/л кортизола или в условиях стресса менее 200 мкг/мл. В отличие от больных с первичной недостаточностью функции надпочечников больные с гипопитуитаризмом могут не предъявлять никаких жалоб даже при уровне кортизола в плазме, близком к нижней границе чувствительности метода.
Для того чтобы расценить снижение уровня кортизола как следствие низкой (абсолютная недостаточность) или нормальной (относительная недостаточность) секреции АКТГ, нужно показать, что введение АКТГ (250 мкг синтетического АКТГ 1-24) способно повысить содержание кортизола в плазме, тогда как стимулы, требующие участия всей гипоталамо-гипофизарно-надпочечниковой оси, неэффективны. Необходимо помнить, что у больных с длительной недостаточностью АКТГ обычно развивается атрофия надпочечников, и поэтому реакция на острую стимуляцию АКТГ у них может и отсутствовать. Это иногда используется для косвенной оценки секреции АКТГ и, по-видимому, тесно коррелирует с реакцией надпочечников на инсулиновую гипогликемию (см. далее). Введение длительно действующего кортикотропина (цинк-кортикотропина или АКТГ-гель) или непрерывная внутривенная инфузия АКТГ в течение 3 дней почти всегда восстанавливает острую реакцию на АКТГ до нормы.

Рис. 7—9. Реакция СТГ и кортизола плазмы у здоровых лиц на гипогликемию, вызванную введением инсулина в дозе 0,1 ЕД/кг внутривенно (стрелка). Для адекватной стимуляции уровень глюкозы в крови должен снизиться на 50% (или до 400 мгл).
Если уровень кортизола находится в пределах нормы и сохраняется реакция на АКТГ, то состояние гипоталамо-гипофизарного звена можно оценить путем: 1 — проведения инсулинотолерантного теста с регистрацией реакции на гипогликемический стресс; 2 — стимуляции бактериальным пирогеном (другой вид центрально опосредуемого стресса); 3 — введение метирапона (метопирона), что позволяет выяснить реакцию на «выпадение» эффектов кортизола по механизму отрицательной обратной связи; 4 — введения вазопрессина, который, как полагают, высвобождает кортикотропин-рилизинг фактор из срединного возвышения и, возможно, сам АКТГ из гипофиза (последний эффект легко показать in vitro, но все еще неизвестно, существует ли он у человека in vivo). Эффект инсулиновой гипогликемии определяется нормальной активацией гипоталамо-гипофизарно-надпочечниковой оси в ответ на глюкопению в ЦНС (рис. 7—9). Адекватная стимуляция предполагает необходимость снижения уровня сахара в крови на 50% (или до 400 мг/л). У здоровых лиц при этом появляются адренергические симптомы гипогликемии (потоотделение, тахикардия,, легкое беспокойство, головная боль), что указывает на достаточную степень снижения уровня глюкозы в крови. У больных с ожирением, диабетом взрослых, акромегалией или другими состояниями, характеризующимися инсулинорезистентностью, может потребоваться увеличение стандартной дозы инсулина (0,1 ЕД/кг внутривенно) до 0,15—0,2 ЕД/кг, тогда как у больных с подозрением на панпитуитаризм рекомендуется уменьшить дозу инсулина до 0,05 ЕД/кг. Инсулиновую пробу не следует проводить у больных с подозрением на аддисонову болезнь или у лиц, у которых налицо четкие признаки и симптомы недостаточности функции надпочечников.
Давно известно, что пирогены клеточной оболочки бактерий активируют гипоталамо-гипофизарную ось, и после введения эндотоксина Е. coli, Salmonella или Pseudomonas (пиромен) через 2—4 ч повышается уровень кортизола в плазме на 50—100%. У некоторых больных с клиническими проявлениями недостаточности коры надпочечников сохраняется реакция на пироген, что указывает на нарушение механизма высвобождения АКТГ, а не на уменьшение количества самого АКТГ. Основным недостатком пирогенной стимуляции является развитие у большинства больных умеренно выраженных лихорадки, озноба, миалгии и головной боли, что снизило популярность этого теста.
Метопирон нарушает биосинтез кортизола в коре надпочечников, блокируя гидроксилирование 11-дезоксикортизола и препятствуя действию кортизола по механизму обратной связи на ЦНС и гипофиз. Введение метопирона приводит к активации гипоталамо-гипофизарной оси и накоплению 11-дезоксикортизола в крови и тетрагидро-11-дезоксикортизола в моче. Последний представляет собой 17-ОН-КС и его можно определить, используя стандартные методы. Для определения исходных показателей дважды последовательно собирают суточную мочу, на 3-й день внутрь вводят метолирон, а на следующий день вновь собирают мочу. У здоровых лиц содержание 17-ОН-КС в моче на 3-й и 4-й день вдвое превышает исходный уровень, тогда как у больных с поражением гипоталамуса или гипофиза могут наблюдаться различные изменения этой реакции. Изменения всасывания метопирона в желудочно-кишечном тракте, ускоренное разрушение его в организме больных, получающих дифенилгидантоин (дилантин), и затруднения, часто встречаемые при попытках аккуратного и полного сбора мочи, снизили энтузиазм, с которым вначале относились к этой пробе. Кроме того, в процессе ее проведения у больных с резким снижением секреции кортизола иногда наблюдаются признаки недостаточности коркового слоя надпочечников (в первую очередь снижение артериального давления). Как и инсулиновую гипогликемию, этот тест не следует проводить у больных с подозрением на первичную недостаточность функции надпочечников.
Появление радиоиммунологических методов определения 11-дезоксикортизола в плазме позволило сократить время проведения метопиронового теста: метопирон вводят в течение 4 ч (35 мг/кг внутривенно) и регистрируют повышение уровня 11-дезоксикортизола в плазме на 4-м и 5-м часу. Эффективность метопироновой блокады биосинтеза кортизола легко проверить по снижению уровня кортизола в плазме в период инфузии. Кратковременность. процедуры и одновременное введение солевого раствора позволяют предотвратить развитие гипотонии. Важно подчеркнуть, что больные не должны при этом подвергаться лечению глюкокортикоидами, так как тест основан на воспроизведении кратковременной недостаточности коры надпочечников.
Вазопрессин стимулирует секрецию АКТГ прежде всего за счет высвобождения гипоталамического кортикотропин-рилизинг фактора. У некоторых больных с повреждением ЦНС на фоне нарушения реакций на метопирон или инсулин реакция на вазопрессин может сохраняться. Побочные эффекты вазопрессина (главным образом гипертензия) делают эту процедуру потенциально опасной у больных с поражением коронарных артерий.
При выборе того или иного теста (тестов) нужно руководствоваться практическими соображениями. Тест проводят для уточнения диагноза у больных с подозрением на относительную недостаточность функции надпочечников, т. е. у лиц, у которых может развиться неадекватная реакция на стресс. Реакция, кортизола на инсулиновую гипогликемию соответствует его реакции на хирургический стресс и, по мнению автора, именно этот тест является средством выбора. Он позволяет одновременно оценивать секрецию и другого гипофизарного гормона (СТГ). Реакция на внутривенное введение метопирона коррелирует с реакцией на инсулиновую гипогликемию и составляет поэтому разумную альтернативу ей. Положительная реакция на вазопрессин отмечалась и у больных, не реагирующих на хирургический стресс, что делает эту пробу наиболее полезной при попытках охарактеризовать природу недостаточности АКТГ, развивающейся вследствие нарушений в ЦНС.
Повышение доступности надежных способов определения АКТГ должно в будущем повысить также точность и надежность описанных диагностических тестов. В настоящее время расхождения данных, получаемых в разных лабораториях, требуют тщательной проверки границ колебаний реакции АКТГ в норме.
В отличие от диагноза первичной недостаточности функции надпочечников, который относительно легко установить независимо от того, получал ли больной при первичном обследовании заместительную терапию, предшествующее лечение глюкокортикоидами, подавляющими функцию гипоталамуса и гипофиза, может сильно затруднять обследование больного с подозрением на гипопитуитаризм. Подавляющее действие их особенно сказывается на результатах метопироновой стимуляции, но может также искажать данные других тестов. Снижение или отсутствие реакции на любой стимул у больного, длительно лечившегося глюкокортикоидами, требует очень осторожной интерпретации. Глюкокортикоиды, если это возможно, следует отменять по крайней мере за 1 мес до проведения соответствующих проб.
Тиреотропный гормон
Исходный уровень ТТГ в плазме у здоровых людей часто находится в области нижней границы чувствительности методов определения и поэтому не может служить критерием различий между нормой и сниженной секрецией этого гормона. В качестве косвенного показателя секреции ТТГ используют уровень Т4 в плазме. Нормальное содержание Т4 исключает полное (хотя не обязательно частичное) нарушение секреции ТТГ. Повышение уровня ТТГ (по крайней мере в 2—3 раза выше верхней границы нормы) при снижении содержания Т4 и Т3 в плазме указывает на сохранность тиротропной функции гипофиза. Патологические изменения в гипофизе дифференцируют от таковых в гипоталамусе, оценивая реакцию ТТГ на введение максимальной стимулирующей дозы ТРГ (500 мкг; рис. 7—10). У здоровых лиц максимальный уровень ТТГ регистрируется на 15—30-й минуте после введения ТРГ, причем он обычно не менее чем вдвое превышает верхнюю границу исходных значений. Снижение или отсутствие реакции указывает на уменьшение гипофизарного резерва. У больных, у которых снижение секреции ТТГ определяется гипоталамической патологией, реакция на ТРГ часто повышена. Еще более характерным для этого состояния является запаздывание пика реакции, который регистрируется на 60—120-й минуте [ 112]. Важно предусмотреть отмену лечения тиреоидными препаратами не менее чем за 1 мес до проведения пробы с ТРГ, чтобы исключить возможность подавляющего действия тиреоидных гормонов на реактивность тиротрофов по отношению к ТРГ.

Рис. 7—10. Реакции ТТГ и пролактина плазмы на введение ТРГ в дозе 500 мкг внутривенно (показано стрелкой) здоровым мужчинам и женщинам. Использованная доза обеспечивает максимальную реакцию. У больных с гипоталамическими нарушениями наблюдается задержка реакции ТТГ (Hershinan J. M., Pitman J. A., Jr. J. Clin. Endocrinol. Metab., 1970, 31, 457; Jacobs L. et al. J. Clin. Endocrinol. Metab., 1973, 36, 1068 в модификации) .
1 — пролактин; 2 — ТТГ.
Резервы ТТГ можно оценивать путем определения его реакции на отмену кратковременно проведенного лечения глюкокортикоидами (дексаметазон). Однако эта методика не имеет преимуществ перед более легко выполнимой пробой с ТРГ. Проба со стимуляцией холодом не нашла применения для оценки резервов ТТГ у человека; не была доказана и целесообразность попыток блокады действия Т4 (путем введения пролитиоурацила) на гипофиз по механизму отрицательной обратной связи.

Рис. 7—11. Реакции ЛГ и ФСГ плазмы у здорового человека на введение гонадотропин-рилизинг гормона (ГнРГ) в дозе 250 мкг внутривенно (показано стрелкой). Реакция ЛГ (1) выше и достигает пика раньше, чем реакция ФСГ (2). Реакция ЛГ (но не ФСГ) у здоровых женщин зависит от стадии менструального цикла, причем наибольшая реакция регистрируется в период овуляции (по данным Snyder P. и соавт., J. din. Endocrinol. Metah., 1975, 41, 938 в модификации).
Лютеинизирующий и фолликулостимулирующий гормоны
Исходный уровень ЛГ и ФСГ у больных с гипопитуитаризмом часто неотличим от нижней границы нормального их содержания у мужчин и женщин в фолликулиновой фазе цикла. У женщин с клиническими проявлениями гипогонадизма при низком или неопределимом уровне эстрадиола в плазме (менее 30 пг/мл) или у мужчин с гипогонадизмом при низком уровне тестостерона в плазме (менее 3 нг/мл), если гипогонадизм обусловлен первичным поражением яичек, содержание ЛГ и ФСГ повышено. В связи с этим гипопитуитаризм можно подозревать у больных с гипогонадизмом только при нормальном содержании ЛГ и ФСГ. Однако различить гипофизарную и супрагипофизарную (гипоталамическую) локализацию первичного процесса, обусловившего снижение секреции гонадотропинов, сложнее, и это никогда не удается сделать с достаточной определенностью. Можно проводить следующие три вида обследования: 1 — прямую стимуляцию гипофиза ГнРГ (который в момент написания этой книги был доступен в США только в качестве средства для научных исследований); 2 — нарушение действия эстрогенов по механизму отрицательной обратной связи с помощью кломифена; 3 — воспроизведение у женщин действия эстрогенов по механизму положительной обратной связи на секрецию ГнРГ с помощью экзогенных гормонов.
Инъекция ГнРГ в наиболее часто применяемой дозе (100 мкг внутривенно) приводит к повышению уровня ЛГ в плазме, который по меньшей мере в 3 раза, а часто и в 10 раз, превышает исходный, причем пик реакции регистрируется через 15—30 мин после введения (рис. 7—11). Реакция ФСГ, менее выраженная, обнаруживает сходную временную динамику, хотя иногда и запаздывает [113]. У больных с гипопитуитаризмом, несмотря на клинические проявления гипогонадизма, можно наблюдать любые изменения реакций гонадотропинов: они могут быть в пределах нормы, сниженными или даже отсутствовать в зависимости от степени деструкции гонадотрофов. В отличие от этого у больных с первичным гипогонадизмом повышен не только исходный уровень гонадотропинов, но и их реакция на ГнРГ. У больных с нефункционирующими опухолями гипофиза несколько чаще отсутствует реакция ЛГ, нежели ФСГ [114]. Повторное введение ГнРГ таким больным не увеличивает степени реакции ЛГ и ФСГ, что указывает на нарушение остаточной секреторной способности гонадотрофов. При дефиците лишь ФСГ реакция ЛГ на ГнРГ остается в пределах нормы, тогда как реакция ФСГ снижается или полностью отсутствует.
У больных с недостаточностью гонадотропинов гипоталамического происхождения реакции ЛГ и ФСГ на ГнРГ также могут быть в пределах нормы, сниженными, полностью отсутствовать или даже усиливаться. Характер реакции ЛГ, по-видимому, особенно зависит от эндогенной секреции ГнРГ, повторные инъекции которого часто восстанавливают сниженную или отсутствующую реакцию ЛГ до нормы. Таким образом, хотя снижение или отсутствие реакции ЛГ и ФСГ на ГнРГ и не позволяет разграничить повреждения гипоталамуса от повреждений гипофиза, но появление реакции после повторных инъекций ГнРГ указывает на сохранность функционального резерва гипофиза и на повреждение гипоталамуса в качестве причины заболевания [ 115].
Оценка гипоталамического звена нейроэндокринной регуляции секреции гонадотропинов предполагает проверку отрицательных и положительных влияний эстрогенов по механизму обратной связи у женщин и отрицательного влияния эстрогенов и тестостерона по механизму обратной связи у мужчин. Кломифенцитрат — слабый эстроген, химически близкий трианизилхлорэтану (ТАХЭ), способен конкурировать с эстрадиолом за связь с рецепторами в матке, гипофизе и гипоталамусе. При введении взрослым женщинам, у которых уровень эстрогенов находится почти в пределах нормы, кломифен действует как антагонист эстрогенов и стимулирует высвобождение эндогенного ГнРГ, что приводит к секреции гонадотропинов. Если установлено, что последняя не нарушена (нормальная реакция на ГнРГ), то отсутствие реакции гонадотропинов на кломифен (100 мг в день в течение 5 дней) свидетельствует о нарушении гипоталамической реакции на блокаду отрицательного действия эстрогенов по механизму обратной связи.
Положительное действие эстрогенов по механизму обратной связи, обнаруживаемое при повышении уровня эстрадиола в течение по меньшей мере 24 ч (путем инъекции длительно действующего эстрогенного препарата, например эстрадиола бензоата или эстрадиола валерата, или путем непрерывной инфузии эстрадиола), приводит к повышению содержания ЛГ (но обычно не ФСГ) предположительно за счет влияния на высвобождение ГнРГ, которое достигает максимума на 4—5-й день. У ановуляторных женщин при нормальном уровне гонадотропинов нарушение реакции на экзогенное введение эстрадиола указывает на гипоталамический дефект восприятия действия эстрогенов по механизму положительной обратной связи. Такой дефект обычно наблюдается у больных с гиперпролактинемией.
У мужчин эстрогены оказывают только тормозное влияние на секрецию ЛГ и их применение не имеет диагностической ценности. Однако кломифен оказывается полезным в качестве пробы на сохранность действия тестостерона по механизму отрицательной обратной связи. После введения кломифена в дозе 100 или 200 мг в день на протяжении 6—7 дней уровень ЛГ у здоровых мужчин по крайней мере вдвое превышает исходный. В связи с этим кломифен находит применение как тест на состояние гипоталамо-гипофизарной оси, если только уровень эндогенного тестостерона оказывается не ниже 1 нг/мл.
Гормон роста
Дефицит СТГ важно установить у низкорослых детей, когда рассматривается вопрос о назначении им эндогенного гормона, У взрослых это имеет большое значение в качестве доказательства приобретенности гипопитуитаризма, что обычно наблюдают при опухолях гипофиза. Исходный уровень СТГ и особенно его содержание в плазме через 60—90 мин после наступления сна нередко позволяет отдифференцировать детей с дефицитом СТГ от здоровых детей по частоте «вспышек» секреции этого гормона. Концентрация в плазме 6 нг/мл или выше служит признаком нормальной секреции СТГ. У взрослых, у которых исходный уровень гормона ниже, а «секреторные вспышки» реже, обычно не удается отличить больных с дефицитом СТГ от здоровых лиц без помощи. стимуляционных тестов.
Наиболее надежным стимулом секреции СТГ является инсулиновая гипогликемия (см. рис. 7—9). Уровень СТГ через 60— 90-мин достигает пика, который составляет 10 нг/мл или выше. Примерно у 20% здоровых лиц обнаруживают субнормальную реакцию, и для установления диагноза необходимо применять второй стимул. При введении аргинина (0,5 г/кг при максимальной дозе 30 г) в той же степени повышается содержание СТГ у 70% здоровых людей, причем лица мужского пола чаще не реагируют на него. Хотя предварительное введение эстрогенов и усиливает реакцию СТГ, по практическим соображениям этим методом пользуются редко. L-Дофа (0,5 г внутрь) стимулирует секрецию СТГ у 60—70% здоровых лиц до уровня не менее 6 нг/мл, причем максимальная реакция наблюдается через 60—150 мин. Примерно у 15—20% обследуемых появляются легкая или умеренная тошнота и рвота в силу фармакологической стимуляции рвотного центра. Эндотоксин Pseudomonas (пироген), но не другие бактериальные пирогены, стимулирует секрецию СТГ в той же степени, что и другие агенты, но из-за побочных эффектов, описанных в, литературе, он в настоящее время не применяется. Другие стимулы, в том числе пропранолол с глюкагоном и синтетический .AKTГ1--24, не обладают какими-либо преимуществами перед описанными выше. В связи с этим при отсутствии реакции на инсулин в качестве второго стимула следует применять L-дофа или .аргинин. При дефиците и других гормонов передней доли гипофиза и особенно в случае приобретенного заболевания гипофиза достаточным доказательством дефицита СТГ служит отсутствие реакции на единственный стимул. Следует подчеркнуть, что при ожирении реакция этого гормона обычно отсутствует независимо от используемого стимула, причем это наблюдается у тучных детей даже при нормальном линейном росте. Реакции СТГ нарушаются также при гипотиреозе, причем после лечения тироксином они часто восстанавливаются до нормы.
Пролактин
Нижняя граница содержания пролактина в плазме здоровых лиц совпадает с границей чувствительности большинства методов определения этого гормона. Наиболее простым и полезным способом доказательства сохранности функции лактотрофов служит проверка реакции пролактина на стимуляцию ТРГ, которая достигает пика одновременно с реакций ТТГ (через 15—30 мин). При этом можно определить обе гормональные функции гипофиза ь .помощью одного и того же стимула. У больных с подозрением на .недостаточность пролактина и нормальной реакцией этого гормона на ТРГ состояние гипоталамо-гипофизарной оси в целом можно оценить с помощью антагонистов дофаминовых рецепторов, из которых чаще всего применяется хлорпромазин (аминазин) в дозе 25 мг внутримышечно. Повышение уровня пролактина в 2—3 раза через 30—60 мин указывает на сохранность гипоталамо-гипофизарной регуляции, тогда как нарушение этой реакции свидетельствует об изменении нейроэндокринного контроля секреции пролактина. Чаще всего этот тест применяют у больных с гиперпролактинемией, что изложено в разделе, посвященном опухолям гипофиза. Реакция пролактина на инсулиновую гипогликемию также является показателем состояния гипоталамо-гипофизарной оси [116]. Интерпретация сниженной реакции (повышение уровня гормона менее чем в 2 раза) требует выяснения реакции пролактина на ТРГ.
ЛЕЧЕНИЕ
Заместительную терапию при гипопитуитаризме следует планировать отдельно для каждого гормона, четко очерчивая задачи лечения. Применение гормонов передней доли гипофиза в терапевтических целях ограничивается СТГ при задержке роста и гонадотропинами для индукции овуляции или сперматогенеза, что обсуждается ниже. Использование гипоталамических рилизинг-гормонов и/или их синтетических аналогов в настоящее время все еще не вышло из стадии изучения, хотя будущий прогресс в этой области обещает большие перемены в современных терапевтических подходах к больным со вторичным гипопитуитаризмом. Однако чаще всего лечение заключается в замещении секреции периферических желез с помощью природных гормонов или их синтетических аналогов.
Адренокортикотропный гормон
Больных с дефицитом АКТГ лечат глюкокортикоидами коры надпочечников. Для большинства больных в нормальных условиях достаточным оказывается лечение кортизоном (25 мг внутрь) или гидрокортизоном (20 мг внутрь), которые назначают в дробных дозах. Поскольку секреция альдостерона происходит относительно независимо от гипофиза, заместительная терапия минералокортикоидами не является необходимой. Почти всегда можно применять более дешевый преднизон (5 мг внутрь). Некоторые больные нуждаются в полной заместительной терапии глюкокортикоидами (37,5 мг кортизона или 7,5 мг преднизона), хотя у других при этом могут возникать признаки передозировки стероидов (синдром Кушинга). В условиях стресса (острые заболевания с высокой температурой, умеренные или тяжелые травмы и др.) дозу их следует увеличивать в 2—3 раза и по мере выхода больного из состояния стресса постепенно снижать ее. Если больной не может принимать лекарственные препараты через рот, следует вводить стероиды парентерально [гидрокортизона гемисукцинат (солюкортеф) в дозе 100 мг одномоментно внутримышечно или внутривенно или кортизона ацетат длительно в дозах 50—100 мг внутримышечно каждые 12 ч]. При остром лечении всех больных с тяжело протекающим гипопитуитаризмом требуется та же доза гидрокортизона (100—300 мг/сут), что и при первичной недостаточности функции надпочечников. Поскольку у некоторых больных с длительно текущим гипопитуитаризмом на фоне полных заместительных или более высоких доз глюкокортикоидов развивается эйфория или даже психотические реакции, следует применять лишь минимальные поддерживающие дозы. При выезде в районы, где трудно рассчитывать на неотложную медицинскую помощь, больные должны брать с собой стероиды для инъекций на случай острой необходимости. Если больным предстоит операция, то они должны получать то же лечение, что и больные с первичной надпочечниковой недостаточностью, т. е. гидрокортизона гемисукцинат 50 мг внутримышечно каждые 6 ч или кортизона ацетат 100 мг внутримышечно каждые 12 ч, начиная с вечера накануне операции, причем это лечение следует продолжить и в ближайшем послеоперационном периоде, постепенно снижая дозы до поддерживающих.
Решение о назначении больному глюкокортикоидов следует принимать на основании низкого исходного уровня кортизола или симптоматики надпочечниковой недостаточности при нормальном уровне кортизола, но нарушении реакции на стимуляцию. Труднее принять решение в отношении больных с частичным дефицитом АКТГ без клинической симптоматики вне стресса. При правильном обучении многие больные этой группы могут обходится без поддерживающей заместительной терапии глюкокортикоидами и нуждаться в ней только в периоды стресса. Исходя из практического медицинского опыта, этим больным в особенности, да и всем больным, получающим поддерживающую глюкокортикоидную терапию, рекомендуется носить специально идентификационные браслеты.
Реакция на лечение достаточно быстрая и зачастую очень выражена, и многие больные только ретроспективно осознают недомогание и слабость, которые были у них до начала лечения. Применение глюкокортикоидов может способствовать также клиническому выявлению несахарного диабета, проявляющегося полиурией и полидипсией. Лечение несахарного диабета см. в главе 9.
Тиреотропный гормон
Больных с дефицитом ТТГ лечат так же, как и больных с первичным гипотиреозом. Показания к лечению основываются не на оценке резерва ТТГ, поскольку у больных с нарушением реакции ТТГ на ТРГ или отсутствием этой реакции уровень тироксина в сыворотке может быть в пределах нормы, а именно на снижении уровня тироксина в сыворотке. Предпочтительное лечение заключается в применении L-тироксина в дозе 0,15—0,2 мг/сут, хотя у некоторых больных достаточными оказываются и меньшие дозы. При подборе необходимой дозы ориентируются на клиническое состояние больных с периодическим (через определенные интервалы) определением содержания тироксина в сыворотке. В отличие от первичного гипотиреоза определение уровня ТТГ в плазме не имеет существенного значения.
Перед началом лечения тиреоидными гормонами крайне важно корригировать выраженную недостаточность функции надпочечников; потребность в заместительной глюкокортикоидной терапии у больных с частичной надпочечниковой недостаточностью может появиться только после начала заместительной терапии тиреоидными гормонами. При тяжелом или длительно текущем гипотиреозе лечение следует начинать с малой дозы тироксина (0,025 мг/сут), постепенно повышая ее до поддерживающей. Таких больных предпочтительней лечить трийодтиронином, начиная с дозы 5 мкг/сут и увеличивая ее постепенно каждые 4—7 дней до 50 мкг/сут, после чего можно переходить на поддерживающую дозу тироксина. Длительное введение больному трийодтиронина не рекомендуется, поскольку короткий период полужизни его обусловливает более быстрое появление симптомов тиреоидной недостаточности, если больной по той или иной причине не примет препарат.
У больных с гипоталамическим гипотиреозом после введения ТРГ через рот нормализуется уровень тироксина в плазме. Однако» это лечение не имеет преимуществ перед лечением самим тироксином и не рекомендуется в качестве поддерживающей терапии.
Лютеинизирующий и фолликулостимулирующий гормоны
Восстановление функции половых желез означает как замещение» секреции половых стероидов, так и лечение бесплодия.
У женщин в пременопаузе заместительная терапия эстрогенами показана по многим причинам, в том числе для сохранения; вторичных половых признаков, т. е. размеров молочных желез, а. также тургора и функционирования желез влагалища и вульвы,. профилактики остеопороза и, возможно, поражения коронарных. артерий, а также сохранения общего самочувствия. Можно применять различные препараты эстрогенов, включая этинилэстрадиол в дозе 5—20 мг/сут и конъюгированные эстрогены (премарин) в» дозах 0,6—1,25 мг/сут. Следует назначать наименьшую дозу, способную вызвать желаемые клинические эффекты. Учитывая возможность развития кистозных изменений в молочных железах и,. что более важно, недавно полученные (хотя пока и противоречивые) данные о том, что у женщин, длительно получающих эстрогены, частота развития рака эндометрия увеличивается в 5— 10 раз, гормон следует принимать только 25 дней в течение месяца на фоне приема в течение не менее 5 дней прогестинового агента,, например медроксипрогестерона в дозе 5—10 мг/сут, который вызывает менструальные кровотечения и предотвращает гиперплазию-эндометрия. Альтернативно можно применять один из пероральных контрацептивных препаратов, содержащих количество эстрогенов, эквивалентное не более 25 мкг эстрадиола в сутки. Неизвестно, имеется ли у больных с гипопитуитаризмом повышенный? риск развития тромбоэмболии, гиперлипидемии и нарушения толерантности к углеводам, который наблюдают при использовании пероральных контрацептивов здоровыми женщинами. Однако преимущества восстановления нормальной физиологической функции оправдывают применение заместительной эстрогенной терапии у этих женщин. Все еще существуют противоречия по вопросу о том, сохраняются ли преимущества заместительной терапии после срока ожидаемой менопаузы, т. е. после 45—50 лет. Правильное решение требует откровенной беседы с больной в отношении всех> опасностей и .преимуществ соответствующего лечения.
Хотя лечение эстрогенами обычно приводит к восстановлению-у женщин с гипопитуитаризмом возможности половой жизни и чувства удовлетворения половым актом, что считается результатом местных тканевых изменений, но либидо, сниженное в силу отсутствия надпочечниковых андрогенов, часто не восстанавливается. Его восстановления можно добиться путем инъекций небольших доз длительно действующего андрогена, например тестостерона энантата (тестэнат) в дозе 50 мг каждые 1—2 мес, или приема активного при пероральном применении флуоксиместрона в дозах 5—10 мг 1—2 раза в неделю. Следует применять наименьшую эффективную дозу, чтобы избежать развития гирсутизма. Важно специально интересоваться либидо, так как больные не всегда добровольно говорят об этом и могут считать, что сниженное либидо не поддается лечению.
Восстановления способности к деторождению можно добиться у большого процента женщин с дефицитом гонадотропинов. У многих больных с недостаточностью гонадотропинов гипоталамического происхождения лечение цитратом кломифена приводит к овуляции. Если этого не происходит, а также если отмечается первичная гипофизарная патология, почти у 75% больных эффект вызывается сочетанным применением препаратов ФСГ и ЛГ. Лечение начинают с ежедневных инъекций менотропинов (пергонал), содержащих большие количества ФСГ, препаратов мочи, полученной от женщин в постменопаузе, для того чтобы вызвать рост и созревание фолликулов, о чем судят по содержанию эстрадиола в плазме. Когда уровень эстрадиола превысит 1200 нг/мл (обычно через 2 нед), инъецируют хорионический гонадотропин человека, чтобы вызвать овуляцию. Этот вид лечения дорогостоящий и, кроме того, может вызвать многоплодие. Его следует проводить только под наблюдением врача, обладающего опытом в этом отношении.
У взрослых мужчин заместительную терапию тестостероном можно проводить либо путем внутримышечного введения длительно действующего препарата тестостерона, например тестостерона энантата (тестэнат) или тестостерона ципионата в дозе 200 мг каждые 3—4 нед, либо с помощью флуоксиместрона — единственного имеющегося перорально используемого препарата, легко всасывающегося в желудочно-кишечном тракте. Однако в силу изменений его всасывания он зачастую оказывается менее эффективным, чем тестостерон, введенный парентерально. Перорально применяемые препараты у небольшого процента больных вызывают развитие холангита и гепатита, тогда как парентерально введенный тестостерон не вызывает этих осложнений. Все это свидетельствует в пользу предпочтительного лечения парентерально вводимыми препаратами, которые к тому же более дешевы. Целью лечения тестостероном является полное восстановление андрогенизации, которая включает рост волос на лице, общее повышение силы мышц, либидо и потенции. Передозировка препаратов сопровождается задержкой соли и воды, что приводит к отеку, а также чрезмерным сексуальным возбуждениям, приапизмом, ночными кошмарами и иногда гинекомастией и появлением угрей; поведение становится агрессивным. У лиц с генетическим предрасположением к облысению оно может появиться у мужчин с гипопитуитаризмом, леченных тестостероном. Лечение андрогенами детей с задержкой роста следует по возможности откладывать, чтобы не вызвать преждевременного закрытия эпифизарных щелей и не ограничить возможности линейного роста в будущем.
Восстановление либидо и потенции может требовать лечения тестостероном в течение многих месяцев; этот срок зависит от длительности существования гипогонадизма. У некоторых больных с дефицитом гонадотропинов, развившимся до полового созревания, вообще не удается добиться полной андрогенизации. У других больных может возникнуть проблема изменения пола. При длительном существовании гипогонадизма появляются нарушения психосоциального поведения, которые могут влиять на весь образ жизни больного, в том числе на род занятий и выбор партнера для половой жизни. Изменения либидо и общие поведенческие сдвиги в результате заместительной терапии могут привести к появлению серьезных проблем адаптации как в сексуальном, так и в иных отношениях. До начала заместительной терапии необходимо тщательно взвесить возможность развития соответствующих осложнений.
Бесплодие у мужчин с гипопитуитаризмом, как и у женщин, поддается сочетанному лечению менотропинами и ХГЧ, но его следует проводить в течение не менее 2—3 мес, и эффект достигается менее чем у 50% больных. В последнее время проведен ряд клинических испытаний с ГнРГ, который следует назначать в виде повторных инъекций в течение 3 мес, а также с его новыми аналогами, эффективными при интраназальном введении. Таким образом открывается прекрасная перспектива более удобного и менее дорогостоящего лечения больных гипоталамическим гипопитуитаризмом. Предлагается также хранить сперму, полученную от способных к оплодотворению мужчин, которым предстоит потенциально опасная операция на гипоталамо-гипофизарной области, в специальном банке. В соответствующих условиях такая сперма сохраняет жизнеспособность в течение нескольких лет.
Гормон роста
В настоящее время дефицит СТГ лечат только при выраженной задержке роста, у детей в пубертатном периоде, когда у них еще не закрылись эпифизарные щели длинных костей. Единственным доступным препаратом является получаемый из гипофизов человека, взятых при аутопсии. СТГ распределяется Национальным агентством гипофизарных препаратов, а также начинает поступать в продажу. Обсуждение подробностей лечебного применения СТГ в настоящем разделе опускается. С учетом высокого сходства двух гормонов в структурном и функциональном отношении предпринимались многочисленные попытки применения плацентарного лактогена вместо СТГ. Хотя первые результаты были обнадеживающими, в настоящее время очевидно, что плацентарный лактоген не имеет терапевтической ценности.
Проводятся исследования, направленные на поиски биологически активного ядра плацентарного лактогена и, если они увенчаются успехом, то в будущем может быть получен более богатый источник лечебного средства. Поскольку считается, что у большинства детей с дефицитом гормона роста имеются достаточные-запасы гормона в гипофизе, но отсутствует соответствующий механизм его высвобождения, выделение, расшифровка структуры и в конце концов, синтез СТГ-рилизинг фактора также могут привести к получению эффективного средства терапии. У взрослых людей с гипопитуитаризмом, получающих заместительную терапию тиреоидными, надпочечниковыми и половыми гормонами, отсутствуют какие бы то ни были клинические или биохимические признаки нарушений, которые можно было бы отнести за счет недостаточности СТГ, и поэтому нет убедительных показаний для применения данного гормона в качестве заместительной терапии.
Пролактин
Крайне малая в настоящее время доступность пролактина препятствует его использованию даже в целях научных исследований. За исключением отсутствия послеродовой лактации, проявления дефицита пролактина если и существуют, то в настоящее время неизвестны. Сообщалось, что у женщин с нарушением послеродовой лактации повторное .введение ТРГ увеличивает продукцию молока [177]. Хотя этот вид терапии и может найти применение в некоторых странах, но в США он имеет ограниченное значение.
ОПУХОЛИ ГИПОФИЗА
Опухоли гипофиза можно классифицировать, исходя из их гистологических особенностей и функциональной активности. Оба эти параметра представляются весьма важными и отражают круг-проблем, которые необходимо рассматривать при обследовании больного с подозрением на опухоль гипофиза. Гипофизарные опухоли подразделяются на два основных гистологических типа: аденомы и краниофарингиомы. Кроме того, в турецком седле могут находиться опухоли, имеющие параселлярное происхождение, например менингиомы, глиомы зрительного нерва и саркомы крыльев основной кости, а также метастазы других опухолей; все их необходимо дифференцировать от первичных опухолей гипофиза. Хотя опухоли самого гипофиза могут локально инвазировать соседние участки, истинно злокачественные опухоли встречаются крайне редко, а возможная их злокачественность не должна влиять на решение относительно диагноза и лечения. Опухоли гипофиза можно также разделить на сопровождающиеся гиперсекрецией гормонов (функционирующие) и не сопровождающиеся ею (не функционирующие). Относительная частота развития опухолей каждого типа в последнее десятилетие значительно изменилась, причем вывод о том, что участились случаи развития функционирующих опухолей, основан не столько на более частом обнаружении их клинической симптоматики, сколько на усовер- шенствовании методов определения уровня гормонов в крови. В некоторых опухолях может сохраняться синтез гормонов, но из-за нарушения внутриклеточных механизмов секреции или процессов распада эти гормоны в кровь не поступают [118].
Аденомы гипофиза
Эти опухоли развиваются из аденогипофизарных клеток того или иного типа, и на их долю приходится более 90% всех новообразований гипофиза. Их уже очень давно подразделяют на хромофобные (которые вначале отождествляли с нефункционирующими) и хромофильные, включающие эозинофильные (сопровождаются акромегалией) и базофильные (сопровождаются синдром Кушинга). После того как выяснилось, что гистологическая картина разных участков одной и той же опухоли часто неодинакова, что опухоли у больных с акромегалией и синдром Кушинга часто оказываются хромофобными и что у больных с хромофобными опухолями часто имеет место гиперсекреция пролактина, целесообразность такого цитохимического деления стала менее очевидной. В настоящее время понятие «хромофобная аденома» означает только то, что она не содержит видимых гранул секрета (запаса гормона). Такая аденома либо не продуцирует гормон, либо запасает его в измененной химической форме, не окрашиваемой при данной методике, либо, что наиболее вероятно, секретирует гормон сразу же по мере синтеза, не запасая его внутри клеток. Новейшие методики с применением электронной микроскопии и иммуногистохимического окрашивания позволили получить данные в пользу последней точки зрения.
По результатам нейрохирургического обследования нескольких больших групп больных, на долю опухолей гипофиза приходится от 6 до 18% всех опухолей головного мозга [119, 120], а по данным наиболее обширных патологоанатомических исследований, частота клинически невыявленных аденом гипофиза составляет 22% [121], причем максимум приходится на возраст между 40 и 50 годами. Функциональная активность этих опухолей неизвестна, но если предположить, что большинство из них является функционирующими, то изменения, которым раньше придавали малое клиническое значение, предстанут в новом свете.
Данные, указывающие на различия в характере роста или биологии между функционирующими и нефункционирующими опухолями, отсутствуют. И те и другие могут расти как очень медленно, так и очень быстро. Медленно растущие нефункционирующие опухоли могут вообще не сопровождаться клинической симптоматикой и обнаруживаются при аутопсии в качестве случайной находки. Недавно проведенный анализ 941 случая аденом [122] показал, что более 50% из них впервые были обнаружены только при аутопсии. Быстро растущие опухоли гипофиза обычно проявляются признаками, связанными с увеличением массы ткани в турецком седле, а гиперсекреция гормона либо распознается случайно, либо мало что вносит в общую клиническую ситуацию. В отличие от этого медленно растущие функционирующие опухоли создают возможность полного развития заболевания, обусловленного гиперсекрецией гормона. По данным использования современных методов радиоиммунологического определения гормонов передней доли гипофиза, к функционирующим опухолям относят 70—80% аденом гипофиза, причем большинство из них секретирует пролактин [123]. Согласно большинству наблюдений, максимальная частота опухолей гипофиза приходится на возраст между 40 и 50 годами [122, 124], хотя при современных возможностях раннего распознавания возраст, в котором они встречаются чаще всего, наверняка будет более молодым. По данным большинства наблюдений, аденомы гипофиза с равной частотой встречаются у мужчин и женщин, хотя и здесь намечаются изменения в связи с возрастающим выявлением пролактинсекретирующих аденом у женщин с аменореей.
Аденомы гипофиза обычно представляют собой солидные опухоли с хорошо выраженной капсулой. Иногда они могут быть кистозными с признаками кровоизлияния в опухолевой ткани. В отдельных случаях центр кисты может сообщаться с субарахноидальным пространством и содержать спинномозговую жидкость,-что определяет синдром «пустого» турецкого седла. Кальцификация, если она появляется, представляет собой конечную стадию организации бывшего кровоизлияния.
Краниофарингиомы
Это врожденные доброкачественные опухоли, которые могут частично или полностью иметь кистозное строение. Гистологически! они состоят из переплетенных эпителиальных тяжей, часто напоминая опухоли эмалевого органа зубов. Наиболее поверхностные клетки опухоли нередко образуют микро- или макрокисты, содержащие коричневую жидкость с высокой концентрацией холестерина, которые у 50% больных подвергаются кальцификации. Вид этих опухолей может варьировать и часто их трудно отличить от эпендимом или эпидермоидных кист. Они растут с различной скоростью и могут полностью прекращать рост. У половины больных клинические симптомы появляются в детстве, у V4 — между 20 и 40 годами, а у остальных—в более позднем возрасте [125]. По-видимому, большинство опухолей растет по средней линии верхнего края ножки гипофиза, хотя некоторые берут начало в более-низких отделах ножки, а около 15% захватывают верхнюю часть/ передней доли гипофиза и поэтому располагаются в границах турецкого седла. Крупные опухоли сдвигают вверх перекрест зрительных нервов, а также смещают гипоталамус и III желудочек. Снизу опухоль может сдавливать переднюю долю гипофиза, но чаще приводит к атрофии задней доли в силу повреждения ножки. Обычно считают, что опухоль происходит из остатков кармана
Ратке, однако это сомнительно, поскольку она нечасто локализуется внутри седла и редко располагается вдоль эмбрионального тракта, проходящего через кость.
ПРИЗНАКИ И СИМПТОМЫ ОПУХОЛИ ГИПОФИЗА
Начальные проявления опухолей гипофиза, равно как и их последующие симптомы, можно разделить на три основные группы нейроанатомические, рентгенологические и эндокринные. Ниже рассматривается главным образом неэндокринная симптоматика, свойственная всем опухолям гипофиза; особенности отдельных гормонсекретирующих опухолей будут рассмотрены порознь.
За последние два десятилетия, по мере того как совершенствование методов нейрорентгенологических исследований и оценки гормональной функции гипофиза обусловливало возможность все более ранней постановки диагноза и начала лечения, частотное распределение симптомов опухолей гипофиза значительно изменилось. Например, если из большого числа больных с опухолями гипофиза, диагностированными в 1940—1950 г., почти у 90% имелись нарушения зрения [124], то среди недавно обследованных больных такие нарушения встречались только в 25% случаев [126, 127]. Можно ожидать, что этот процент будет снижаться и в дальнейшем. И наоборот, в настоящее время наиболее распространенными симптомами являются нарушения эндокринной функции, чаще всего аменорея, снижение либидо или бесплодие, связанные с пролактинсекретирующими опухолями, тогда как, согласно прежним наблюдениям, такая симптоматика имелась всего у 25—35% больных. Как ранее, так и в настоящее время на долю случайно обнаруженных при рентгенографии черепа опухолей гипофиза приходился и приходится небольшой процент случаев.
Нейроанатомические проявления
Увеличение размеров внутриселлярной опухоли приводит к компрессии окружающей гипофизарной ткани и давлению на лежащую сверху твердую мозговую оболочку, которая образует диафрагму турецкого седла. Это в свою очередь обусловливает головную боль различного характера, локализующуюся в лобной, височной или позадиглазничной области, обычно тупую, не сопровождающуюся тошнотой или симптомами нарушения зрения, не зависящую от положения тела и не всегда снимающуюся анальгетиками. При разрыве твердой мозговой оболочки головная боль часто прекращается.
Начав расти вверх, опухоль встречает на своем пути зрительные нервы, зрительный перекрест или зрительные тракты. Чаще всего опухоль оказывает давление именно на зрительный перекрест, приводя к появлению классических признаков битемпоральной гемианопсии. При обследовании больного в самые ранние сроки сдавления перекреста зрительных нервов можно обнаружить дефект только верхнебокового поля зрения, причем часто наблюдаются асимметричные изменения. С продолжением роста опухоли потеря зрения может прогрессировать до полной слепоты и в конце концов разовьется атрофия зрительных нервов. Иногда опухоль растет преимущественно кпереди от зрительного перекреста, приводя к нарушению зрения лишь в одном глазу. Отек соска зрительного нерва при аденомах гипофиза встречается редко, но при краниофарингиомах его можно обнаружить у 27% больных [125]. По мере дальнейшего роста опухоли вверх могут появляться симптомы сдавления вентрального гипоталамуса, что проявляется в колебаниях температуры тела, гиперфагии, изменении характера сна и эмоциональных сдвигах. При давлении на III желудочек может возникнуть внутренняя гидроцефалия. В редких случаях происходит сдавление лобных или височных долей мозга, что сопровождается поведенческими нарушениями и припадками; можно наблюдать также признаки поражения пирамидных путей, свидетельствующие о сдавлении среднего мозга. Сдавление внегипоталамических структур чаще происходит при краниофарингиомах, которые могут локализоваться вне турецкого седла, чем при аденомах гипофиза. Рост опухоли в латеральном направлении может привести к сдавлению III, IV и VI пар черепных нервов в месте, где они проходят через кавернозный синус, что обусловливает офтальмоплегию и диплопию. Рост опухоли вниз приводит к разрыву дна турецкого седла и распространению процесса на скат или пазухи основной кости, что может вызвать истечение из носа спинномозговой жидкости (СМЖ).
Хотя обычно опухоль растет медленно и симптомы прогрессируют постепенно, у больных с гипофизарными опухолями симптоматика может появиться внезапно, что связано с кровоизлиянием в опухоль, или апоплексией гипофиза [95]. Это осложнение опухолей гипофиза вначале распознавали лишь при его наибольшей выраженности и считали весьма неблагоприятным прогностическим признаком. Однако в настоящее время выяснилось, что кровоизлияние в опухолевую массу встречается очень часто. В своей наиболее мягкой форме оно может протекать бессимптомно или сопровождаться внезапной головной болью разной интенсивности, проходящей через несколько дней. Кровоизлияние часто ускоряет рост опухоли, что при ее интраселлярном расположении приводит к развитию гипопитуитаризма, а при экстраселлярном — к острому нарушению зрения или полной слепоте. Результатом может явиться также «спонтанное излечение» от гормонпродуцирующей опухоли.
Факторы, определяющие рост опухоли, выяснены недостаточно. У крыс развитию опухоли способствуют большие дозы эстрогенов, но до сих пор отсутствуют данные о роли эстрогенов в этом процессе у человека. Важно учитывать, однако, что иногда рост опухоли ускоряется при беременности. Беременные с признаками опухоли гипофиза во II и III триместре подвергаются повышенному риску развития симптомов сдавления зрительного перекреста.
Связано ли это с ростом опухоли или с нормальным увеличением размеров гипофиза — неясно, поскольку такие симптомы обычно спонтанно исчезают после родов.
Нейрорентгенологические данные
Небольшой процент (5—15) опухолей гипофиза впервые обнаруживают при рентгенографии черепа, проводимой с другими целями. На рентгенограммах видно увеличенное или деформированное турецкое седло. У больных с этими рентгенологическими признаками, у которых, кроме того, проявляется эндокринная симптоматика, опухоль гипофиза встречается чаще, чем в 70% случаев. Однако при отсутствии симптомов наиболее вероятным диагнозом является синдром «пустого» турецкого седла (см. ниже, а также табл. 7—7).
Таблица 7—7. Клинические симптомы у больных с увеличением турецкого седла
|
Клинические симптомы |
Первичная интраселлярная опухоль, % (27 больных в группе) |
Экстраселлярный генез повреждения, % (13 больных в группе) |
Синдром «пустого» турецкого седла, % (25 больных в группе) |
Диагноз отсутствует, % (10 больных в группе) |
|
Головная боль |
85(18) |
100(69) |
48(24) |
80(80) |
|
Истечение СМЖ из носа |
0 |
0 |
8(8) |
0 |
|
Эндокринные |
67(67) |
54(31) |
0 |
0 |
|
Зрительные |
0 |
31(0) |
0 |
0 |
|
Отсутствие симптомов |
15(15) |
0 |
44(44) |
20(20) |
Примечание. Цифры в скобках — процент больных только с указанным симптомом (по Weisberg и соавт. [137] в модификации). Из группы исключены 22 человека с симптомами нарушения зрения.
Эндокринологические проявления
У больных с опухолями гипофиза эндокринные симптомы бывают двух типов: 1 — гипофункция в результате разрушения здоровой ткани аденогипофиза, вызванного давлением опухоли или нарушением воротного кровоснабжения и 2 — гиперфункция вследствие опухолевого перерождения и/или гиперплазии. Гиперфункция обусловливается прежде всего опухолями, продуцирующими гормон роста, пролактин и АКТГ, но может характеризовать также ТТГ- и ФСГ-секретнрующие опухоли (см. ниже). Кроме того, могут сосуществовать гипер- и гипофункция, что встречается при гипогонадизме, вторичном по отношению к гиперпролактинемии.
Признаки и симптомы эндокринной гипофункции были описаны в предыдущем разделе. Чаще всего появляются симптомы, связанные со снижением функции половых желез, а затем — симптомы недостаточности функции надпочечников и щитовидной железы. Дефицит гормона роста по частоте занимает промежуточное положение, но приобретает клиническое значение только если развивается до завершения процесса роста. Дисфункция задней доли гипофиза (несахарный диабет) при аденомах гипофиза встречается весьма редко (пока опухоль не достигает очень больших размеров), но при краниофарингиомах наблюдается часто.
ДИАГНОСТИЧЕСКИЕ МЕТОДЫ ОПУХОЛИ ГИПОФИЗА
Целью обычно применяемых диагностических методов являются 1 — дифференцирование опухолей гипофиза от других параселлярных расстройств; 2 — определение размеров опухоли и степени разрушения турецкого седла и внеселлярных образований; 3 — выяснение степени дефицита гормонов. Кроме того, применяются некоторые исследования для точного определения анатомических границ опухоли и степени смещения окружающих структур, что необходимо для выработки плана лечения.
Эндокринологическая оценка гипофункции гипофиза рассматривается далее в настоящей главе, а также в главе 9, а гиперфункции — в следующем разделе. По возможности полную эндокринологическую оценку следует проводить до начала лечения, поскольку характер и объем лечебных мероприятий зависит от степени гипопитуитаризма. Однако в некоторых обстоятельствах это сделать невозможно, например у больного с быстро прогрессирующим снижением зрения или на фоне других прогрессирующих неврологических симптомов, которые требуют неотложного хирургического вмешательства. В таких случаях больного следует рассматривать как страдающего пангипопитуитаризмом и перед стрессорной диагностической или лечебной процедурой (например, пневмоэнцефалография и операция) ему необходимо вводить стероиды.
Нейрорентгенологические исследования
Примеры обычно применяемых нейрорентгенологических исследований, а также характер получаемой с их помощью информации показаны на рис. 7—12.
Рентгенография черепа. Вначале больному с подозрением на опухоль гипофиза следует произвести боковую и передне-заднюю рентгенографию черепа. Специалисты значительно расходятся во мнении относительно нормальных размеров, формы и тонких особенностей костной структуры турецкого седла на рентгенограммах. На обычном боковом снимке максимальные размеры передне-заднего диаметра, т. е. наибольшего расстояния от передней вогнутости турецкого седла до переднего края его спинки, не превышают 17 мм, а максимальная глубина гипофизарной ямки, т. е. наибольшее расстояние между дном и перпендикуляром, опущенным от вершины спинки седла на его бугорок, составляет 13 мм [128]. Однако определение размеров турецкого седла мало

Рис. 7—12. Методики непрорентгенологпчеекого исследования, применяемые для оценки патологии гипофиза. а — (расширенное турецкое седло с разрушенным дном и спинкой у больного с СТГ-секретирующей опухолью. Видны также увеличенные размеры синусов; б — латеральная томограмма турецкого седла, на которой видна локальная эрозия передней части дна (стрелка) у

больного с небольшой пролактинсекретирующей опухолью: в — латеральная томограмма турецкого седла, на которой видна интра- и экстраселлярная кальцификация (стрелки) у больного с краниофарингиомой; г — пневмоэнцефалограмма, на которой можно видеть воздух в турецком седле у больного с синдромом «пустого» турецкого седла Виден ободок остаточной гипофизарной ткани вдоль нижней и задней части турецкого седла- д е — нормальная и патологическая картина при двусто-

ронней ангиографии сонных артерий (стрелка), обнаруживающая верхнее и боковое смещение обеих передних мозговых артерий вследствие интенсивного супраселлярного роста опухоли гипофиза: ж — компьютерная томографическая сканограмма и з — усиленная (путем инфузии контрастного вещества) сканограмма, обнаруживающая супраселлярное распространение опухоли гипофиза (стрелки) (любезно предоставлено D. Fatal, госпиталь Michael Reese).
что дает для диагностики опухоли гипофиза [129], поскольку при превышении нормальных размеров обычно имеются другие признаки его патологии, а при явных изменениях по другим критериям размеры седла часто остаются в пределах нормы. Пытаясь точнее определить размеры турецкого седла, DuChiro и Nelson [1] для вычисления его объема предложили использовать ширину, измеряемую на переднезаднем снимке черепа. По данным этих авторов, максимальный объем седла в норме составляет 1100 мм3, хотя при другом способе расчета была получена цифра, почти вдвое превышающая эту [130]. Более субъективной является оценка формы турецкого седла, и для передачи впечатления о минимальном его увеличении применяют такие термины, как «набухание» или «баллоновидное» расширение. Имеются также разногласия в отношении того, являются ли вариантами нормы или ранними признаками опухолей небольшое истончение или эрозия кортикального слоя кости, формирующей твердую пластинку седла, а также двойной контур его нижней поверхности («двойное дно»), что встречается у 30% лиц без подозрения на опухоль гипофиза [131].
Ни одно из этих изменений не является, однако, патогномоничным для опухоли гипофиза. Они могут наблюдаться при синдроме «пустого» турецкого седла, параселлярных новообразованиях, прорастающих в гипофизарную ямку, повышении внутричерепного давления и в наименее выраженном виде даже у лиц без эндокринологических или неврологических признаков патологии гипофиза. Эти изменения приобретают значение только в сочетании с другими клиническими и лабораторными данными.
На боковых и переднезадних снимках турецкого седла могут быть обнаружены также интраселлярные и экстраселлярные очаги кальцификации. Их присутствие особенно в супраселлярной области служит веским указанием на краниофарингиому, при которой они встречаются в 50% случаев. С другой стороны, при аденомах гипофиза кальцификаты встречаются не чаще, чем в 5% случаев.
Такие изменения обычно располагаются в пределах турецкого седла, почти всегда имеют округлую форму и находятся в капсуле опухоли или стенке кисты.
Томография турецкого седла. Томография турецкого седла быстро приобрела чрезвычайно важное значение в качестве метода уточнения сомнительных признаков, выявляющихся на плоскостных рентгенограммах. Применяемая вначале линейная томография уступила свое место бипланарной гипоциклоидальной томографии, которая дает лучшее разрешение и позволяет избежать некоторых артефактов, свойственных первоначальному методу. Применяя срезы толщиной в 1—2 мм, можно обнаружить локальные участки эрозии или истончения, которые совершенно не видны на плоскостных снимках, выявить распространение опухоли на основную кость или синус и получить представления об анатомии пазухи основной кости. Томографию следует производить тогда, когда на обычных рентгенограммах обнаруживают подозрительные изменения, а при гиперсекретирующей опухоли гипофиза даже в отсутствии каких-либо изменений — на обычных рентгенограммах. При интерпретации небольших изменений на томограмме необходима осторожность, поскольку провести четкую грань между ранними изменениями и вариантами нормы довольно сложно [131]. Если при обычной рентгенографии турецкого седла обнаруживают отчетливые признаки опухоли, то необходимость в томографии часто отпадает.
Пневмоэнцефалография. В настоящее время пересматривается диагностическое значение пневмоэнцефалографии при опухолях гипофиза и существуют разногласия по поводу важности сведений, получаемых с помощью этого метода, по сравнению с информацией, которую можно получить с помощью других, неинвазивных методов исследования (см. ниже), причиняющих больному меньшие неудобства [126, 127]. Пневмоэнцефалография несомненно служит прекрасным методом определения наличия и степени супраселлярного распространения опухоли; она способствует также разграничению интраселлярного и параселлярного процессов. Этот метод является наиболее надежным и доступным в настоящее время и в отношении диагностики синдрома «пустого» турецкого седла. Некоторые нейрохирурги пользуются пневмоэнцефалографней для выбора хирургического подхода, поскольку при значительном супраселлярном распространении опухоли может оказаться необходимым фронтальный, а не транссфеноидальный доступ. Другие исследователи, однако, считают, что этот метод следует применять только у больных, у которых клиническая симптоматика и/или другие диагностические методы доказывают или делают высоко вероятным существование супраселлярного распространения процесса. С пневмоэнцефалографией часто сочетают политомографическое исследование, что особенно полезно при определении размеров интраселлярных аденом, которые могут сосуществовать с синдромом «пустого» турецкого седла [132]. Введение контрастных средств (метризамида) вместо воздуха позволяет получить прекрасное изображение параселлярной области и поэтому весьма полезно для определения размеров опухоли [133]. Этот метод вызывает, по-видимому, несколько менее тяжелые побочные эффекты, чем пневмоэнцефалографпя.
Ангиография сонных артерий. Двусторонняя ангиография сонных артерий оказывает помощь при определении степени латерального и супраселлярного распространения опухоли гипофиза п, кроме того, позволяет увидеть смещение или сдавление передних мозговых артерий или их ветвей. Этот метод позволяет получить полезные сведения при предоперационном анализе возможностей неожиданного обнаружения анатомических особенностей кавернозной части сонных артерий. Кроме того, только с ее помощью можно до операции установить диагноз аневризмы сонной артерии, которая может вызвать расширение и эрозию турецкого седла и тем самым послужить причиной ошибочного диагноза

Рис. 7—13. Поля зрения и форма вызванных зрительных потенциалов (ВЗП) у больного с опухолью гипофиза при супраселлярном ее распространении. а — стимуляция всего зрительного поля (левый глаз) в обратном шахматном порядке В левой затылочной доле. воспринимающей стимуляцию назального поля через неперекрещивающиеся в хиазме волокна, регистрируется высокоамплитудный ВЗП В правой затылочной доле, стимулируемой с темпорального поля через перекрещивающиеся в хиазме волокна, регистрируется низкоамплитудный искаженный ВЗП. б — поля зрения больного, обнаруживающие небольшие дефекты верхних отделов височных половин с обеих сторон. При использовании всех, кроме самых мелких объектов, поля зрения оставались в норме: в—раздельная стимуляция назального и темпорального полей левого глаза. При стимуляции назального поля в левом полушарии, получающем информацию через неперекрещивающиеся в хиазме волокна, регистрируется высокоамплитудный синусоидальный ВЗП. С правой затылочной доли снимается низкоамплитудный противоположный по фазе ответ, отражающий либо объемное проведение внутри мозга, либо активность, проводимую через мозолистое тело (стрелка). Стимуляция темпорального поля не вызывает ответа в правой затылочной доле (любезно предоставлено Goodwin J., госпиталь Michael Reese). нефункционирующей опухоли гипофиза. В опытных руках эта процедура сопряжена лишь с небольшим риском.
Компьютерная томография. Разработка компьютерной томографии (КТ-сканпрование) изменило диагностические мероприятия при множестве видов внутричерепной (и внечерепной) патологии и позволила заменить инвазивные методы, например артериографию и пневмоэнцефалографию, на неинвазивные. Использование контрастных веществ, вводимых внутривенно либо непосредственно в СМЖ [133], еще более повысило точность КТ-сканирования. Область турецкого седла и супраселлярное пространство увидеть с помощью этого метода труднее, хотя более новые конструкции приборов обладают большей разрешающей способностью. Особую пользу КТ-сканирование приносит при анализе пара- и супраселлярного распространения опухолей гипофиза, а также при определении СМЖ в турецком седле (синдром «пустого» турецкого седла). Окончательное значение этого метода следует оценивать по тому, насколько информация, получаемая с его помощью, позволяет избежать необходимости предоперационной ангиографии и/или пневмоэнцефалографии.
Нейроофтальмологические исследования
Поля зрения. Исследование полей зрения, производимое у постели больного, служит полезной первичной диагностической процедурой. Однако из-за часто отсутствующей возможности установить с помощью этого метода небольшие отклонения от нормы все больные с подозрением на гипофизарные нарушения должны проходить формальную проверку полей зрения с помощью периметра. При использовании тест-объектов различного размера и цвета, проецируемых на шарообразный прибор (периметр Гольдмана), можно получить надежную оценку как центральных, так и периферических полей зрения. Воспроизводимость и чувствительность этого метода делает его чрезвычайно полезным для последовательного наблюдения за больными (рис. 7—13).
Хотя сдавление зрительного перекреста с битемпоральными дефектами полей зрения является характерным симптомом при опухолях гипофиза с супраселлярным распространением, это не служит ни специфическим, ни единственным признаком подобных опухолей. Битемпоральные дефекты полей зрения, кроме опухолей гипофиза, могут встретиться при параселлярных опухолях, сосудистых нарушениях, очагах демиелинизации в зрительном перекресте, фокальном (секторальном) пигментозном ретините, слип- чивом арахноидите, саркоидозе ЦНС, лучевых поражениях перекреста и иногда при пролабировании его в седло в сочетании с синдромом «пустого» турецкого седла. Точно так же у больного, у которого зрительный перекрест фиксирован спереди («префиксация») или сзади («постфиксация»), поля зрения могут изменяться в основном в одном глазу (зрительный нерв) или может изменяться лишь одно поле зрения (зрительный тракт). Наконец, у некоторых больных встречаются атипичные дефекты полей зрения (асимметричные или даже характерные для сдавления спереди), которые исчезают после удаления опухолей гипофиза.
Вызванный зрительный ответ. Недавно разработанную методику регистрации вызванного зрительного ответа (ВЗО), применяемую для исследования патологии зрительных путей, расценивают в настоящее время как более чувствительную для выявления ранних признаков сдавления хиазмы гипофизарными опухолями (см. рис. 7—13). ВЗО характеризует форму и латентный период электрического ответа затылочной коры, вызванного фотостимуляцией глаз. Можно избирательно оценивать состояние участков отдельных полей и дифференцировать влияние на перекрещивающиеся и неперекрещивающиеся волокна. При давлении на хиазму в первых можно наблюдать более поздний и/или слабый ответ, чем во вторых. Надежность и чувствительность метода регистрации ВЗО наряду с меньшей утомляемостью наблюдателя, которая при визуальной проверке полей зрения иногда довольно велика, может сделать применение этого метода весьма целесообразным.
Прочие исследования
Гипофизарные гормоны присутствуют в СМЖ, причем показано, что их уровень в ней в норме более низкий, чем в периферической крови, у больных с опухолями гипофиза с супраселлярным распространением (но не при полностью интраселлярной локализации опухоли) повышается [134, 135] независимо от того, функционирует опухоль или нет. Единственным исключением из этого правила являются пролактинсекретирующие опухоли, при которых уровень пролактина в СМЖ может повышаться даже при отсутствии супраселлярного роста [136]. Повышение концентрации гормонов в СМЖ обусловлено, по-видимому, не нарушением целостности барьера между кровью и СМЖ, а, что наиболее вероятно, непосредственным попаданием гипофизарных гормонов в СМЖ [135]. Хотя прежде чем можно будет оценить прогностическое значение определения уровня гормонов в СМЖ, необходимо дальнейшее накопление опыта таких определений, они могут способствовать отбору больных с супраселлярным распространением гипофизарных опухолей.
Дифференциальный диагноз
Диагноз опухоли гипофиза основывается на выявлении нейроанатомических признаков опухолевой массы и, если возможно, на доказательстве гиперсекреции гормонов. В присутствии того и другого диагноз не вызывает сомнений. Дифференциальный диагноз гиперсекреции гормонов, наблюдаемой в отсутствии нейроанатомических изменений, рассматривается в следующем разделе. Если же опухоль не обладает гормональной активностью, то неспецифичность многих нейроанатомических признаков и клинических симптомов диктует необходимость тщательного учета других диагностических возможностей. Следует подчеркнуть, что гипопитуитаризм, частичный или полный, при нейрорентгенологических данных, свидетельствующих об увеличении размеров или деструкции турецкого седла, не обязательно указывает на опухоль гипофиза.
Дифференциальная диагностика сниженной функции гипофиза уже обсуждалась. Состояния, при которых наблюдают увеличение размеров турецкого седла, перечислены в табл. 7—8 в соответствии с частотой встречаемости. У больных, у которых увеличены размеры турецкого седла, но не нарушено зрение, частота первичных интраселлярных опухолей и синдрома «пустого» турецкого седла была одинаковой (36 и 33%); внеселлярные повреждения (в том числе опухоли, а также явления гранулематоза) наблюдались реже (17%), а в остальных 14% случаев диагноз установить не удалось [137]. Другие заболевания, упомянутые в табл. 7—8, встречаются редко, но тем не менее требуют дифференциально-диагностических и терапевтических подходов.
Синдром «пустого» турецкого седла
Термин «пустое седло» применяют во всех случаях, когда при пневмоэнцефалографии турецкое седло заполняется воздухом. Это обусловлено расширением субарахноидального пространства в интраселлярную область и часто сопровождается уплощением гипофиза обычно вдоль задней части дна и спинки. Турецкое седло, как правило (хотя и не всегда), увеличено. Термин синдром первично «пустого» турецкого седла применяется в тех случаях, когда это не связано с предыдущим хирургическим вмешательством или лучевой терапией. На аутопсийном материале первично «пустое» турецкое седло обнаруживали почти в 24% случаев; при этом в анамнезе обычно не было указаний на эндокринное заболевание [138].
Этиология синдрома первично «пустого» турецкого седла неясна. Считают, что пе полностью сформированная диафрагма седла создает возможность передачи давления СМЖ на его содержимое, что постепенно приводит к выбуханию паутинной оболочки с уплощением аденогипофиза и перестройки самого турецкого седла. Другая возможность заключается в предсуществовании опухоли или кисты с последующим кровоизлиянием и резорбцией, приводящими к утрате массы ткани.
Почти все случаи синдрома первично «пустого» турецкого седла являются бессимптомными. Хотя часто отмечается головная
Таблица 7—8. Дифференциальный диагноз нефункционирующих опухолей гипофиза
|
Диагноз |
Размеры турецкого седла |
Деформация турецкого седла |
Функция гипофиза |
Прочие особен» ности |
|
Синдром «пустого» турецкого седла |
Обычно увеличены |
Может развиться |
Почти всегда в пределах нормы |
Тесты на эндокринную функцию могут выявлять легкие нарушения. Может наблюдаться ожирение и доброкачественная внутричерепная гипертензия |
|
Параселлярная опухоль |
В пределах нормы или увеличены |
Обычно развивается |
В пределах нормы или снижена |
Головная боль различного характера. Часто в процесс вовлекаются вне-глазничные нервы. Атипичные дефекты полей зрения |
|
Интраселлярная аневризма |
То же |
То же |
То же |
Может встречаться пульсирующая головная боль с рвотой. Обычно поражены вне-глазничные нервы. Симптомы появляются остро и часто имеют периодический характер |
|
Гранулематозные заболевания |
Увеличены |
Может развиться |
Обычно в пределах нормы |
Снижение эндокринной функции обусловлено только гипоталамическими повреждениями. Развивается несахарный диабет |
|
Первичный гипотиреоз |
То же |
То же |
Обычно в пределах нормы, но может быть снижена |
Повышенный уровень ТТГ, подавляемый тироксином |
|
Первичный гипогонадизм |
» » |
» » |
В пределах нормы с повышением уровня гонадотропинов |
Повышенный уровень гонадотропинов, подавляемый половыми стероидами |
|
Диагноз |
Размеры турецкого седла |
Деформация турецкого седла |
Функция гипофиза |
Прочие особенности |
|
Семейный гипопитуитаризм |
Увеличены |
Отсутствует |
Снижение уровня СТГ, ТТГ и, возможно, гонадотропинов |
Бессимптомное течение, за исключением дефицита гормонов |
боль, но она, вероятно, не связана с состоянием седла, а просто служит поводом к рентгенографии черепа, при которой и устанавливается диагноз. Этот синдром чаще всего наблюдается у тучных женщин и сочетается с повышенной распространенностью гипертонической болезни, доброкачественной внутричерепной гипертензии (псевдоопухоль мозга) и истечения СМЖ из носа, что отмечено в табл. 7—9 [100, 101]. Зрительные нарушения, чаще развивающиеся при вторичной форме синдрома (после операции или лучевой терапии), встречаются и при синдроме первично «пустого» турецкого седла, в том числе генерализованное сужение периферических полей зрения, битемпоральная гемианопсия и отек соска зрительного нерва.
Турецкое седло обычно симметрично увеличено или баллоновидно расширено (84% больных) но может быть и деформировано (42%), причем чаще всего обнаруживается выпрямление спинки с ее деминерализацией и реже — асимметрия дна и эрозия отклоненных отростков. Эти изменения могут быть неотличимы от тех, которые встречаются при опухолях гипофиза. Диагноз устанавливают с помощью пневмоэнцефалографии. При изменениях конфигурации седла с уплощением гипофиза заполнение его воздухом не является обязательным признаком. Некоторые исследователи считают, что для подтверждения диагноза вместо пневмоэнцефалографии можно использовать КТ-сканирование, тогда как, по мнению других исследователей, большинство соответствующих приборов обладает недостаточной для этой цели диагностической точностью.
При проверке эндокринной функции у большинства больных с синдромом первично «пустого» турецкого седла получают нормалные результаты, хотя есть сообщения о снижении у некоторых больных резервов ТТГ и гонадотропинов, притуплении реакции гормона роста и иногда пангипопитуитаризме или несахарном диабете.
Диагноз синдрома первично «пустого» турецкого седла устанавливают обычно в процессе обследования на предмет определения опухоли гипофиза. Возможность этого синдрома следует предполагать у больного с увеличенными размерами турецкого седла при отсутствии клинической симптоматики (или минималь-
Таблица 7—9. Состояния, часто сопровождающие синдром первично «пустого» турецкого седла
|
Частота. % |
|
|
Женщины |
83,7 |
|
Ожирение |
78,4 |
|
Гипертоническая болезнь |
30,5 |
|
Доброкачественная внутричерепная гипертензия (псевдоопухоль мозга) |
10,5 |
|
Истечение СМЖ из носа |
9,7 |
Случаи, описанные в течение 1977 г. (по Jordan и соавт. [101] в модификации) ной ее выраженности) и неизмененной эндокринной функцией. В этих условиях часто нет необходимости в проведении пневмоэнцефалографии и за больным следует просто наблюдать. Важно помнить, однако, что «пустое» турецкое седло не исключает одновременного существования опухоли гипофиза. У больных с синдромом первично «пустого» турецкого седла были СТГ-, пролактин- и АКТГ-секретирующие опухоли [100, 132, 139]. Правда, задачи диагностики у таких больных определяются признаками гиперсекреции гормонов, а синдром «пустого» турецкого седла, если он диагностируется перед операцией, не влияет на план лечения. До настоящего времени не описаны случаи одновременного существования нефункционирующей опухоли гипофиза и синдрома первичного «пустого» турецкого седла.
Параселлярные заболевания
Многие и разнообразные нарушения, возникающие в параселлярной области, сопровождаются признаками и симптомами, которые имитируют опухоли гипофиза. К таким нарушениям относятся воспалительные и гранулематозные заболевания (саркоидоз, эозинофильная гранулема, арахноидит), дегенеративные процессы (аневризмы) и новообразования (менингиомы, глиомы, саркомы, гамартомы и иногда метастазы других опухолей). Распространяясь на турецкое седло, эти процессы могут вызывать его расширение и деформацию костной структуры и, помимо их супрасселярных проявлений, могут сопровождаться той или иной степенью гипопитуитаризма. Для выбора правильного лечения их следует отличать от первичных опухолей гипофиза.
При супраселлярных опухолях обычно наблюдают развитие преимущественно неврологических симптомов: тяжелой головной боли, часто сопровождающейся тошнотой и рвотой, асимметричных нарушений полей зрения, отека зрительного нерва и поражения внеглазничных нервов. Опухоли гипоталамуса или стенок III желудочка часто вызывают симптомы дисфункции гипоталамуса и повышение внутричерепного давления.
В отличие от опухолей гипофиза в этих случаях эндокринные проявления обычно появляются позднее, а не раньше неврологических симптомов. Рентгенологическое исследование часто способствует выяснению происхождения супраселлярных опухолей, когда обнаруживают, например, супраселлярную кальцификацию при краниофарингиомах и менингиомах и эрозию передних отклоненных отростков в остальном интактного турецкого седла. Обычным методом выявления супраселлярных опухолей является пневмоэнцефалография, хотя многие из этих опухолей легко идентифицируются с помощью КТ-сканирования.
Аневризмы сифона внутренней сонной артерии или передней коммуникантной артерии могут распространяться на турецкое седло и подобно супраселлярным опухолям имитировать опухоль гипофиза [140]. Преобладающим симптомом является головная боль часто пульсирующего характера и меняющейся остроты; также часто наблюдается поражение III, IV и VI пар черепных нервов. До операции диагноз можно установить только с помощью ангиографии сонных артерий.
Саркоидоз и другие гранулематозные заболевания первично поражают гипоталамус, и механизм, с помощью которого они вызывают увеличение размеров турецкого седла, выяснен не полностью. Диагноз ставят обычно на основании неэндокринных проявлений, и предположение о вторичности гипофизарной патологии необходимо подтвердить реакцией на соответствующее лечение и результатами длительного катамнестического наблюдения.
Увеличение размеров гипофиза при других эндокринных заболеваниях
Длительный первичный гипотиреоз или первичный гипогонадизм сопровождается расширением турецкого седла, увеличением секреции ТТГ или гонадотропинов и у некоторых больных развитием ТТГ-секретирующих опухолей гипофиза [8—10, 141]. Как можно показать на лабораторных животных, длительная недостаточность функции периферической железы приводит к гиперплазии клеток, секретирующих соответствующий тропный гормон и в конце концов к развитию опухоли. Иногда при недостаточности функции одной из периферических желез проявляется гиперсекреция не только соответствующего, но и других тропных гормонов гипофиза, что наблюдают при длительном ювенильном гипотиреозе, который сопровождается преждевременным половым созреванием. Крайне важно диагностировать этот, хотя и очень редко встречающийся, синдром на его ранних стадиях, так как гиперсекрецию и гиперпластические изменения в гипофизе удается снять с помощью соответствующей терапии, т. е. тироксином или половыми стероидами. После развития аденомы сделать бывает это уже невозможно, и может возникнуть необходимость в хирургическом удалении опухоли.
Недавно описан синдром семейного гипопитуитаризма, при котором снижается секреция гормона роста, ТТГ и, возможно, гонадотропинов и наблюдается увеличение размеров турецкого седла [142]. Причина такого увеличения седла без его деформации неизвестна, и возможность развития опухоли не исключается, поскольку в описанных случаях хирургического вмешательства не производилось.
ЛЕЧЕНИЕ
Лечить больных с нефункционирующими опухолями гипофиза необходимо для предотвращения или ограничения потери функции гипофиза и последствий супраселлярного распространения этих опухолей на близлежащие структуры ЦНС, например на перекрест зрительных нервов и гипоталамус. Альтернативными подходами являются операция и облучение.
Хирургическое вмешательство
Операции на гипофизе, которые в качестве безопасных и эффективных мероприятий разработал Кушинг, служат надежным методом лечения опухолей этого органа. Трансфронтальный доступ, обычно применявшийся до последнего десятилетия, остается методом выбора при параселлярных опухолях, краниофарингиомах, возникающих вне турецкого седла, и первичных интраселлярных опухолях со значительным супраселлярным распространением, особенно когда они отделяются от интраселлярной опухоли узким перешейком. Опухоли, окружающие зрительный нерв, могут быть удалены только при фронтальном доступе. После разработки способов лечения массивными дозами глюкокортикоидов послеоперационная смертность, ранее связанная с манипуляциями в области гипоталамуса, перестала быть проблемой. По современным данным, смертность при трансфронтальных операциях колеблется от 1,2 [143] до 10% [144] в зависимости от характера подобранных случаев.
Необходимость лучшего доступа к передней и нижней части гипофиза, в которых часто располагаются небольшие функционирующие опухоли, заставила Guiot [145], а затем Hardy [146] вернуться к транссфеноидальному микрохирургическому методу. Этот метод, вначале разработанный Кушингом, был оставлен из-за осложнений, заключавшихся в истечении СМЖ из носа и постоянно развивавшегося менингита, приводящего в доантибиотическую эру к смерти больного. В настоящее же время транссфеноидальный доступ в сочетании с флуороскопией и микрохирургическим методом применяется во все большем проценте случаев при любых опухолях гипофиза, причем смертность варьирует от 3% (максимум) почти до нуля [146, 147]. Транссфеноидально можно удалять опухоли с умеренным супраселлярным распространением и даже опухоли, которые требуют фронтального доступа, часто удаляются двухмоментно: после удаления супраселлярной части Транссфеноидально удаляют интраселлярную часть опухоли. Такой подход особенно показан в тех случаях, когда внутричерепной путь сопряжен с чрезмерно высоким риском, что можно наблюдать у пожилых, почти ослепших из-за длительного сдавления хиазмы, больных и у больных, у которых опухоль распространяется в пазуху основной кости. Противопоказаниями к транссфеноидальному подходу являются недостаточная пневматизация пазухи основной кости и анатомические аномалии, при которых сифон сонной артерии смещен к средней линии.
Эндокринологическое обследование больных перед операцией помогает определить объем предстоящей хирургической резекции. Если функция периферических желез у больного не нарушена, то показана несколько более консервативная операция, чтобы сохранить остатки гормонсекретирующей ткани гипофиза. Однако если до операции установлен гипопитуитаризм, то нет причин беспокоиться в отношении сохранения содержимого турецкого седла. На практике для поддержания функции гипофиза часто оказывается достаточной узкая полоска аденогипофизарной ткани по краю турецкого седла.
Нейрохирурги по-разному оценивают необходимость нейрорентгенологических исследований перед операцией. Большинство из них считают необходимым произвести артериографию и/или пневмоэнцефалографию для выяснения анатомии окружающей ткани и ее потенциального повреждения опухолью, тогда как некоторые исследователи полагают, что достаточную информацию можно получить с помощью КТ-сканирования. Ожидается, что с накоплением опыта частоту применения инвазивных методов предоперационного исследования, по крайней мере при опухолях некоторых типов, удастся снизить.
Поскольку может потребоваться удаление большего объема нормальной ткани гипофиза, чем предполагалось до операции, целесообразно проводить операционный период под «прикрытием» стероидов даже у больных с интактной гипофизарно-надпочечниковой системой. Достаточное «прикрытие» обеспечивает парентеральное введение гидрокортизона по 50 мг каждые 6 ч или кортизона ацетата по 100 мг каждые 12 ч, причем после операции дозы стероидов быстро уменьшают. В послеоперационном периоде следует оценивать функцию гипофиза, чтобы решить вопрос о необходимости заместительной терапии.
После операции больного нужно тщательно обследовать на предмет развития несахарного диабета, особенно потому, что в заторможенном состоянии жажда может не проявляться. Даже в случае легкой травмы ножки гипофиза в ближайшем послеоперационном периоде часто наблюдается полиурия и повышенная осмоляльность плазмы. Сохранение этих нарушений в течение более 48 ч после операции обычно указывает на деструкцию ножки или задней доли гипофиза и постоянное нарушение функции последней. У некоторых больных возникает фаза улучшения, вслед за ко- торой вновь появляется соответствующая симптоматика, сохраняющаяся уже постоянно. Период улучшения состояния считают результатом высвобождения вазопрессина из дегенерирующих питуицитов задней доли. Поскольку развитие событий в течение нескольких первых послеоперационных суток непредсказуемо, необходимо тщательно следить за водным балансом и при необходимости назначать больному не длительно действующие препараты вазопрессина, а его водный раствор (5 ЕД внутримышечно). Более подробно вопросы лечения несахарного диабета обсуждаются в главе 9.
Если после транссфеноидальной операции из носа появляются выделения, следует с помощью пропитанных глюкозоксидазой полосок (декстростикс) проверить, не представляет ли собой отделяемое СМЖ. Послеоперационная ринорея СМЖ часто спонтанно исчезает через 7—10 дней. Если этого не происходит, то требуется хирургическая коррекция дефекта дна турецкого седла.
Лучевая терапия
В качестве альтернативы хирургическому удалению аденом гипофиза применяют различные виды лучевой терапии. Кандидатами на лучевую терапию считают больных, у которых опухоль гипофиза практически не распространяется выше турецкого седла. При выраженных дефектах полей зрения применение наружного облучения чревато повышенной опасностью дальнейшего снижения зрения в силу начальной воспалительной реакции, возникающей в опухоли. Кроме того, большая площадь облучения, необходимая при опухолях со значительным супраселлярным распространением, создает повышенный риск повреждения окружающих нервных структур.
Нейрорентгенологические исследования, которые нужно проводить у больных, подвергаемых лучевой терапии, столь же обширны, что и перед хирургической операцией. При нефункционирующих опухолях особенно необходимо исключить возможность аневризмы с помощью артериографии и определить степень супраселлярного распространения с помощью пневмоэнцефалографии и КТ-сканирования.
В настоящее время при лечении большинства больных используют дозу облучения в 45—50 Дж/кг, эффективно разрушающую опухолевые клетки и не повреждающую нормальную гипофизарную ткань, что наблюдается при дозе 80—90 Дж/кг. Применяются множественные дробные дозы облучения с помощью ротационных аппаратов, что обычно приводит лишь к минимальным побочным эффектам и практически не вызывает выпадения волос на голове.
Чаще всего используются обычное излучение источников высокой энергии (супервольтное). Стереотоксическую имплантацию пилюль c 90Y вначале считали эффективной альтернативой наружному облучению, но часто развивающиеся осложнения, в том числе неправильное местоположение пилюль и ринорея СМЖ, заставили отказаться от этой процедуры. Весьма эффективным методом является облучение тяжелыми частицами (протонный пучок), но в настоящее время он доступен лишь в немногих географических районах, где имеется циклотрон [148—150]. Нужную дозу можно дать за несколько часов, а получаемые результаты, по меньшей мере не ниже, а возможно и выше, чем при обычном излучении. Неврологические осложнения, в том числе параличи глазодвигательных нервов, нарушение полей зрения и некроз височной доли, встречаются несколько чаще, чем при обычном облучении, но они редко значительно выражены. Функция гипофиза, по крайней мере в ближайшие после облучения сроки, сохраняется, по-видимому, у 80—85% больных.
Вначале считали, что краниофарингиомы в отличие от хромофобных аденом являются радиорезистентными опухолями. Однако есть сообщения о положительных результатах лучевой терапии и при этих опухолях [151, 152]; эта форма лечения остается заслуживающей внимания.
Факторы, влияющие на выбор метода лечения
Многие больные с опухолями гипофиза являются кандидатами либо на хирургическое, либо на лучевое лечение в качестве основного способа терапии. Главными преимуществами хирургического лечения являются: 1 — быстро получаемый результат, что иногда необходимо применительно к зрительным симптомам и гиперсекреции гормонов (см. ниже); 2 — возможность оценки состояния ткани и эффективного воздействия на относительно радиорезистентные опухоли (например, кистозные опухоли и краниофарингиомы). Недостатки хирургического лечения связаны с возможностью в отдельных случаях летальных исходов и развития операционных осложнений, главным образом повреждений лобной доли и ножки гипофиза, кровоизлияния в гипофиз, инфекции и особенно при транссфеноидальном доступе — ринореи СМЖ.
Лучевая терапия, с другой стороны, позволяет избежать острых осложнений, связанных с хирургической операцией, и гораздо легче переносится больным. К ее недостаткам относятся: 1 — отсутствие эффекта у некоторых больных с радиорезистентными опухолями (некоторые рентгенотерапевты настаивают на необходимости гистологического диагноза до начала лечения); 2 — медленная реакция, сопряженная с опасностью острого набухания опухоли; 3 — развитие иногда апоплексии гипофиза; 4 — в очень редких случаях повреждение окружающей нервной ткани; 5 — отдаленная перспектива развития гипопитуитаризма вследствие облучения здоровой ткани аденогипофиза. Вероятность развития синдрома «пустого» турецкого седла со зрительными нарушениями вследствие пролабирования перекреста зрительного нерва при хирургическом и лучевом лечении одинакова.
При выборе метода лечения следует руководствоваться в основном такими критериями, как отдаленные результаты в отношении сохранения и/или восстановления зрения, сохранение эндокринной функции и частота рецидивов. Хотя при описании результатов лечения большинства больных не делали различия между функционирующими и нефункционирующими опухолями гипофиза, но частота рецидивов после хирургического и лучевого лечения, по-видимому, почти одинакова [147, 153, 154]. Ободряет тот факт, что частота рецидивов при обоих видах лечения в последние годы ниже, чем 10—20 лет назад. Важно отметить, однако, что диагностические критерии, методы лечения и обследования больных после него резко различаются в разных клиниках, и группы больных поэтому во многих отношениях оказываются несравнимыми. Тем не менее для большинства больных без чрезмерно крупных опухолей гипофиза прогноз в отношении смягчения зрительных симптомов и рецидивов, по-видимому, весьма благоприятен.
Относительная частота развития гипопитуитаризма после операции и облучения также примерно одинакова, хотя имеются различия в сроках возникновения этого осложнения. Гипопитуитаризм после хирургического лечения развивается сразу же, а после лучевой терапии обычно через несколько лет. Хотя некоторое снижение функции гипофиза наблюдали после операции почти у 1/3 больных, но согласно более поздним данным, частота этого осложнения снизилась примерно до 15%, т. е. до уровня, сравнимого с таковым при лучевой терапии.
Применение облучения в качестве первичного метода лечения при нефункционирующих опухолях гипофиза не препятствует последующей операции в случае рецидива, первичная операция также не препятствует последующему облучению. Исходя из результатов лечения, проведенного несколько десятилетий назад, принято считать, что для профилактики рецидивов нефункционирующих опухолей, частота которых у больных в некоторых группах достигает 15—20% [147], лучевую терапию предпочтительнее использовать в качестве дополнения к хирургическому лечению. Хотя совершенствование приемов лечения уменьшило в настоящее время необходимость в комбинированной терапии, но ее все еще рекомендуют [126, 147].
ГИПОФИЗАРНЫЕ ОПУХОЛИ, СЕКРЕТИРУЮЩИЕ ГОРМОН РОСТА: АКРОМЕГАЛИЯ
Гиперсекреция СТГ связана обычно с опухолью гипофиза, которая примерно у 20% больных содержит эозинофильные, а у остальных — хромофобные гранулы. Однако с помощью электронной микроскопии в сочетании со специальными методами цитохимической и иммунохимической окраски СТГ-содержащие секреторные гранулы удается обнаружить почти во всех хромофобных опухолях [155]. Присутствие или отсутствие заполненных СТГ секреторных гранул в клетках опухоли не коррелирует с уровнем СТГ в плазме, а отражает соотношение между способностью клетки хранить гормон, с одной стороны, и синтезировать и секретировать его — с другой. Отсутствие секреторных гранул указывает, однако, на относительно меньшую дифференцированность опухоли, что в свою очередь отражается на скорости ее роста. Действительно, эозинофильные аденомы обычно имеют меньшие размеры, растут медленнее и создают возможность длительного развития признаков и симптомов гиперсекреции СТГ, тогда как хромофобные опухоли часто обнаруживают более быстрый рост и сопровождаются симптомами экспансии опухолевой массы при меньшей выраженности признаков гиперсекреции СТГ.
Признаки и симптомы
Классические проявления СТГ-секретнрующих опухолей обусловливаются одним или более из следующих трех факторов: экспансией опухоли, недостаточностью гипофизарных гормонов и гиперсекрецией СТГ. Клинические признаки, определяющиеся первыми двумя факторами, уже рассматривались, их частота у больных с СТГ-секретирующими опухолями в прошлом была весьма значительна. С появлением возможности более ранней диагностики эти признаки встречаются относительно реже.

Рис. 7—14. Лицо 43-летней женщины с акромегалией, болеющей в течение 15 лет. Разрастание мягких тканей вокруг глаз, носа и рта привело к огрубению черт лица. Видны увеличенные слезные мешки, утолщенные кожные складки и фиброзные узелки (acrochordon).
Признаки и симптомы гиперсекреции СТГ обычно появляются после 20—30 лет жизни и развиваются медленно. Ранее всего проявляющимися признаками служат отеки и гипертрофия мягких тканей, распространяющиеся на конечности и лицо (рис. 7—14). Фотографии, полученные с 10—20-летним интервалом, часто свидетельствуют о прогрессирующих изменениях внешнего вида больного. Изменения конечностей наиболее выражены в области кистей и стоп: пальцы становятся лопатообразными, а увеличение объема мягких тканей приводит к необходимости постоянно увеличивать размер колец, перчаток и обуви. Кожа утолщается и становится грубой, а выраженность кожных складок усиливается. Может развиваться генерализованный гирсутизм и усиливаться пигментация. У 1/4 больных появляются кожные фиброзные узелки и иногда отмечается acanthosis nigricans. Часто усиливается секреция сальных желез, обусловливающая жирность кожи и образование кист, а также дольчатость языка. У больных с наиболее активной акромегалией проявляется повышенная потливость, служащая чувствительным клиническим показателем активности процесса. Костные изменения развиваются медленнее и включают в себя утолщение кортикального слоя костей, образование костных наростов и шипов в области концевых фаланг. Гипертрофическая артропатия, сопровождающаяся утолщением и в конце концов дегенерацией суставных хрящей, и гипертрофия связок вызывают появление симптомов, варьирующих от легкой артралгии до деформирующего артрита, ведущего к инвалидности. Заметно увеличивается нижняя челюсть, что приводит к прогнатизму и значительному выступанию нижних резцов. Кроме того, часто увеличиваются промежутки между зубами. Костные края черепа утолщаются и часто разрастаются лобные, скуловые и носовые кости. Костные пазухи, как правило, увеличиваются в размере, что вместе с гипертрофией голосовых связок приводит к появлению низкого голоса. Гипертрофия слизистых оболочек обусловливает иногда закупорку слуховых труб и развитие серозного воспаления среднего уха.
Если гиперсекреция СТГ начинается в детстве до слияния эпифизарных пластинок, то увеличение роста обычно бывает пропорциональным, что приводит к истинному гигантизму. Вследствие частого развития гипогонадизма закрытие эпифизарных щелей запаздывает, и срок возможного роста удлиняется. Рост наиболее известного «гипофизарного» гиганта (гигант Альтон) достигал 3 м. Чаще приходится наблюдать больных со смешанными чертами гигантизма и акромегалии, что отражает сохранение гиперсекреции гормона роста в зрелом возрасте. По современным данным, СТГ-секретирующие опухоли составляют 20% всех диагностируемых в детстве аденом гипофиза [156].
Часто отмечается периферическая нейропатия, обусловленная сочетанием: 1 — сдавления нервов вследствие разрастания окружающих связок и фиброзной ткани, что чаще всего сказывается на срединном нерве (запястный туннельный синдром) и реже — на спинномозговых нервных корешках и cauda equina; 2 — демиелинизации аксонов периферических нервов в связи с пролиферацией периневральных и субэпиневральных элементов, что приводит к возможности пальпировать нервы [157]. У больных акромегалией появляются парестезии и потеря чувствительности, а также характерная слабость проксимальных мышечных групп, которая обычно выражена умеренно, но может приводить к инвалидности. Гистологическая картина мышечной ткани у большинства больных меняется относительно мало, хотя в отдельных случаях имеются признаки дегенерации мышц.
Длительная гиперсекреция СТГ приводит к генерализованной висцеромегалии, захватывающей слюнные железы, печень, селезенку и почки. Увеличение слюнных желез проявляется клинически, тогда как гипертрофия других органов, как правило, не дает клинической симптоматики. Так, значительная гепатоспленомегалия указывает обычно на то, что больной страдает одновременно каким-либо другим заболеванием [158]. Гипертрофия почек сопровождается повышением как секреторной, так и реабсорбционной функции.
При акромегалии нередко отмечается гипертрофия и гиперфункция других эндокринных желез. Распространенным признаком является тиромегалия с аденоматозными изменениями, хотя истинная гиперфункция щитовидной железы встречается редко. Интерпретация результатов проб на функцию щитовидной железы осложняется снижением уровня тироксинсвязывающего глобулина и повышением содержания тироксинсвязывающего преальбумина в сыворотке. Часто как проявление синдрома множественной эндокринной неоплазии (I тип) наряду с опухолями островков поджелудочной железы и карциноидными опухолями встречается гиперплазия околощитовидных желез и образование аденом в них, что объясняет нередко наблюдаемые гиперкальциурию и почечнокаменную болезнь. Роль карциноидных и островковоклеточных опухолей в патогенезе акромегалии подробнее обсуждается далее. Галакто-, аменорея и снижение либидо связаны обычно с гиперсекрецией пролактина опухолью гипофиза, что может встречаться почти у 1/3 больных. Патофизиология этих проявлений обсуждается в разделе, посвященном пролактинсекретирующим опухолям. Иногда наблюдаемое снижение уровня тестостерона в плазме может быть следствием гиперпролактинемии, но в определенной степени обусловлено и уменьшением содержания тестостеронсвязывающего глобулина в сыворотке.
Некоторые разногласия существуют по поводу влияния СТГ на сердечно-сосудистую систему. Это связано с небольшим числом обследуемых больных, различием способа их подбора и методов обследования. В возрасте между 40 и 50 годами у больных часто развивается гипертония, но обычно она незначительно выражена и поддается лекарственному лечению. При аутопсии, как правило, находят кардиомегалию, но, по-видимому, не существует характерной для акромегалии формы поражения сердца [159]. Выраженная сердечная недостаточность развивается главным образом у больных с гипертонией и не обнаруживает четкой корреляции с другими показателями гиперсекреции гормона роста. Однако у больных с акромегалией чаще встречаются сердечно-сосудистые заболевания, характеризующиеся повышенной смертностью [160].
Увеличение массы тела не является распространенным признаком акромегалии. Ожирение наблюдается менее чем у 1/3 больных. Однако давно известны нарушения углеводного обмена при этом заболевании, обусловленные диабетогенными эффектами гормона роста. Часто наблюдаются нарушение толерантности к глюкозе и гиперинсулинемия, а диабет (определяемый как гипергликемия натощак) встречается примерно у 25 % больных, в основном у лиц с семейным анамнезом заболевания; это указывает на то, что акромегалия может просто способствовать проявлению скрытого генетического предрасположения. В силу инсулинорезистентности часто возникает потребность в больших дозах инсулина, причем у некоторых больных отмечается склонность к кетозу. Несмотря на эти нарушения, диабетические сосудистые осложнения при акромегалии крайне редки. Хотя могут развиваться небольшие проявления ретинопатии, значительное снижение зрения, недостаточность функции почек вследствие диабетической нефропатии, периферическая диабетическая нейропатия и сосудистая недостаточность даже при длительном течении болезни встречаются лишь в исключительных случаях.
При обследовании больных с акромегалией как до лечения, так и после него иногда приходится встречаться с типичными для длительно текущего заболевания изменениями конечностей и черт лица, но лишь с небольшими признаками свежих метаболических нарушений. В этих случаях болезнь либо действительно неактивна в результате инфаркта опухоли (с апоплексией гипофиза или без нее), либо эффекты гиперсекреции гормона роста вышли на плато. Чтобы отличить одно от другого, необходимо определить уровень гормона роста в плазме.
Данные лабораторных исследований
Существует множество косвенных показателей гиперсекреции СТГ, которые больше не используются или их регистрируют только для дополнительной информации, поскольку имеются надежные методы определения уровня СТГ в крови. Часто отмечают повышение содержания неорганического фосфора в сыворотке, равно как и канальцевой реабсорбции фосфата. Обычно наблюдается гиперинсулинемия с нарушением глюкозотолерантности или без него; повышен также уровень соматомединов независимо от способа их определения. Рентгенологические изменения включают в себя образование костных шипов в области концевых фаланг, увеличение синусов и утолщение пяточного бугра. Если появляется гиперкальциемия, то она указывает на гиперпаратиреоз и синдром множественной эндокринной неоплазии.
Диагноз акромегалии ставят на основании повышенного уровня СТГ в плазме и отсутствия его нормальной реакции на стимулирующие и тормозящие агенты. Верхняя граница нормального содержания СТГ составляет 5 нг/мл у мужчин и 10 нг/мл у женщин. У больных с акромегалией уровень СТГ может колебаться от верхней границы нормы до 1000 нг/мл и более. Этот уровень обычно отражает секреторную активность опухоли, но не обязательно продолжительность заболевания или тяжесть его клинической симптоматики. Поскольку даже у здоровых детей и молодых лиц уровень СТГ спорадически может повышаться почти до 30 нг/мл, при исходном уровне его, ненамного превышающем эту цифру, следует проводить динамические исследования секреции гормона. Секреция СТГ при акромегалии по многим параметрам и качественно отличается от нормальной. При акромегалии отсутствует тормозящее влияние принятой внутрь глюкозы, которая у здоровых лиц вызывает снижение уровня СТГ (у мужчин ниже 2 нг/мл, а у женщин ниже 5 нг/мл), причем проверка этой реакции служит наиболее надежным способом подтверждения диагноза. Следует учитывать, однако, что у больных с акромегалией уровень СТГ в плазме под действием глюкозы может снижаться, оставаться неизмененным или даже парадоксально увеличиваться. Изменения уровня СТГ при приеме глюкозы наблюдаются у 70—80% больных с акромегалией [161а]. Однако даже в тех случаях, когда этот уровень снижен, он не достигает предела нормальных колебаний.
Недавно проведенные исследования свидетельствуют о том, что при радиоиммунологическом определении содержания соматомедина С в крови получают результаты, теснее коррелирующие с клиническими проявлениями гиперсекреции СТГ, чем при определении самого СТГ. Однако для того чтобы оценить пользу таких определений для диагностики и лечения акромегалии, необходимы дальнейшие наблюдения [161Ь].
У 70—80% больных акромегалией (но не у здоровых лиц) уровень СТГ в плазме повышается в ответ на введение ТРГ, причем этот тест в отношении диагностики столь же надежен, что и тест с глюкозой [162]. Увеличение содержания СТГ в плазме наблюдается также после введения ГнРГ, хотя как величина этой реакции, так и ее частота обычно оказываются меньшими, чем в отношении реакции на ТРГ. У некоторых больных акромегалией отмечается н реакция (иногда парадоксальная) на инсулиновую гипогликемию или введение аргинина, но соответствующие пробы не имеют диагностического значения. После введения L-ДОФА у большинства больных акромегалией в отличие от нормы уровень СТГ [163] снижается. Этот эффект можно удвоить апоморфином и системной инфузией дофамина; он обусловливается непосредственным тормозящим влиянием дофаминергических средств на опухоль. К другим отличиям секреции СТГ у больных акромегалией от таковой у здоровых людей относятся отсутствие его выброса в течение глубоких стадий сна и тенденция к более широким спонтанным колебаниям его уровня, что указывает на прерывистую секреторную активность опухоли.
Дифференциальный диагноз
Клинические проявления акромегалии трудно спутать с признаками какого-либо другого заболевания. Гораздо чаще приходится сталкиваться с вопросом о том, обусловлен ли вид больного (в основном изменение конечностей и черт лица) текущей акромегалией или заболевание, имевшее место в прошлом, в настоящее время неактивно. Для постановки диагноза неактивной акромегалии могут потребоваться динамические исследования секреции СТГ с применением не одного, а нескольких агентов (например, глюкозы, ТРГ, L-ДОФА). Гигантизм в детстве встречается н при отсутствии гиперсекреции СТГ (церебральный гигантизм), а иногда может обусловливаться чрезмерной продукцией соматомедина.
Уровень СТГ повышается и обнаруживает реакцию на ТРГ у больных хронической почечной недостаточностью, циррозом печени, при голодании, нервной анорексии и белковокалорической недостаточности питания. Однако это не создает трудностей для диагностики, поскольку отсутствуют клинические проявления акромегалии. Повышенный уровень СТГ наблюдается н при карликовости Ларона [164], при которой, по-видимому, нарушается продукция соматомединов, хотя у таких детей определяются клинические признаки дефицита, а не избытка СТГ.

Рис. 7—15. Возможные нейроэндокринные нарушения в патогенезе СТГ-секретирующих опухолей гипофиза. а — нормальная регуляция секреции СТГ по принципу обратной связи, которая опосредуется самим СТГ или каким-то интермедиатором (возможно, соматомедином) и предположительно сводится к стимуляции выделения соматостатина и торможению выделения СТГ-рилизинг фактора; б — изменения, развивающиеся при образовании опухоли гипофиза de novo. Повышение секреции СТГ должно было бы тормозить выделение СТГ-рилпзпнг фактора и стимулировать выделение соматостатина, подавляющего функцию нормальных соматотрофов. Следовательно, чтобы продолжать секретировать избыточное количество СТГ. опухоль гипофиза должна обладать резистентностью к соматостатину. Секреция СТГ при акромегалии тормозится экзогенным соматостатином, но ее чувствительность к этому фактору по сравнению с нормальной секрецией выяснена недостаточно; в — изменения при гипоталамическом генезе заболевания. Предполагается, что первичная гиперсекреция СТГ-рилизинг фактора приводит к гиперплазии соматотрофов и в конце концов к образованию опухоли. Это означает также нарушение тормозного влияния по механизму обратной связи на выделение СТГ-рилизинг фактора, аналогичное нарушение выделения соматостатина или относительную резистентность опухоли к действию соматостатина. 1 — СТГ-секретпрующая опухоль.
Повышение уровня СТГ с характерными для акромегалии признаками наблюдали при опухолях центральной нервной системы (например, эпендиомы III желудочка, глиомы гипоталамуса), изредка вследствие эктопической продукции СТГ бронхогенным раком легких [165], а недавно и в сочетании с карциноидными островковоклеточными опухолями, удаление которых приводило к нормализации уровня СТГ и ремиссии акромегалии [166—169]. Некоторые из этих опухолей содержат СТГ-рплизинг фактор [169, 170].
Патогенез акромегалии: патология гипоталамуса или гипофиза
Существуют значительные разногласия по вопросу о том, является ли акромегалия первичным гипофизарным заболеванием, обусловленным развитием автономной опухоли, или она имеет гипоталамическое (или иное центрально-нервное) происхождение, связанное с избыточной секрецией СТГ-рилизинг фактора (или, возможно, со снижением секреции соматостатина) (рис. 7—15).
В пользу гипоталамического происхождения заболевания свидетельствует следующее: 1 — у большинства больных акромегалией секреция СТГ не автономна, а реагирует на стимулы, опосредуемые гипоталамусом, такие, как глюкоза, инсулиновая гипогликемия и аргинин. Это означает, что соматотрофы, несмотря на свое опухолевое перерождение, сохраняют способность реагировать на сигналы, поступающие из гипоталамуса; 2 — опухоли гипоталамуса, сопровождающиеся гиперсекрецией СТГ и акромегалией, свидетельствуют о возможном участии в процессе СТГ-рилизинг фактора; 3—в плазме больных акромегалией присутствует СТГ-рилизинг активность, проявляющаяся в опытах in vitro [171— 173]; 4 — акромегалия, вызываемая СТГ-секретирующими опухолями, исчезает после удаления бронхиальных карциноидных или островковоклеточных опухолей, которые содержат СТГ-рилизинг фактор [169—170]. Таким образом, гиперсекреция СТГ и даже опухоль гипофиза могут развиваться в ответ на длительную стимуляцию СТГ-рилизинг фактором; 5 — кроме того, реакции СТГ на ингибирование глюкозой и стимуляцию инсулином при проверке после удаления СТГ-секретирующих аденом обычно остаются нарушенными, даже если исходный уровень СТГ находится в пределах нормы [174]; б—наконец, секреция СТГ при акромегалии изменяется под влиянием нейрофармакологических агентов (a-адренергических антагонистов и b-адренергических агонистов) [175], которые, как считают, действуют в пределах ЦНС. Все эти аргументы свидетельствуют о гипоталамическом происхождении гиперсекреции СТГ, но не исключают возможность образования в конце концов автономной опухоли гипофиза.
Данные о первично гипофизарном генезе СТГ-секретирующих опухолей основаны на двух наблюдениях: 1 — в некоторых случаях после полного удаления опухоли наступала нормализация не только уровня СТГ, но и его секреторных реакций на сигналы, опосредованные нервной системой [176]; 2 — гистологическое исследование ткани аденогипофиза, окружающей опухоль, не обнаруживает признаков гиперплазии соматотрофов [177].
Противоречивость данных не позволяет в настоящее время прийти к определенному заключению. Однако вполне возможно, что существует две подгруппы акромегалии, одна из которых имеет гипоталамическое, а другая — гипофизарное происхождение. Разделить эти две группы можно, вероятно, с помощью детального обследования больного до удаления опухоли и в различные периоды после ее удаления, хотя для окончательного ответа могут потребоваться специфические методы определения в крови СТГ-рилизинг фактора и соматостатина гипоталамического происхождения.
Лечение
Существует три вида лечения акромегалии: хирургическое, облучение и лекарственная (фармакологическая) терапия. Как и у больных с нефункционирующими опухолями гипофиза, необходимо учитывать последствия распространения опухолевой массы внутри черепа, необходимость сохранения остаточной функции гипофиза и заместительную терапию при дефиците гормонов. Гиперсекреция СТГ опухолью не меняет оснований для лечения гипофизарных опухолей. В данном разделе обсуждается эффективность различных видов лечения главным образом в отношении нормализации уровня СТГ и смягчения клинической симптоматики его гиперсекреции. Задачи лечения заключаются в коррекции метаболических нарушений, ликвидации по возможности изменений мягких тканей и приостановке нарастания костно-мышечных осложнений. Может быть отмечена и некоторая регрессия костных изменений, но это встречается относительно редко. Сообщалось, что снижение уровня СТГ благоприятно влияет на предсуществующие сердечно-сосудистые заболевания, хотя и не у всех больных. В настоящее время лечение акромегалии не зависит от того, имеет она гипоталамическое или гипофизарное происхождение. Однако до начала лечения, направленного на гипофиз, необходимо тщательно рассмотреть возможность развития внегипофизарной опухоли (карцинодная или из островков поджелудочной железы), удаление которой может ликвидировать гиперсекрецию СТГ.
Хирургическое вмешательство
Хирургическое удаление СТГ-секретирующих опухолей с помощью транссфеноидального или фронтального доступа является быстрым и эффективным методом лечения акромегалии. Показания и противопоказания к операции, в том числе сопряженные с ней опасности, не отличаются от таковых при нефункционирующих опухолях, за тем исключением, что если диагноз акромегалии установлен, хирургическое вмешательство оправдано даже при минимальных рентгенологических данных. Эффективность операции, варьирующая в разных группах больных, достигает 92%, если ее критерием считать снижение содержания СТГ в плазме до нормы [177]. Некоторые несовпадения этого показателя [146, 178—180] можно объяснить различиями в понимании разными авторами термина «нормализация» уровня СТГ (например, исходный уровень 10 нг/мл или 5 нг/мл, либо уровень его после приема глюкозы 5 нг/мл). Эффективность нормализации уровня СТГ находится в обратной зависимости от размеров опухоли; если размеры опухоли превышают 2 см, что далеко не всегда позволяет осуществить избирательное удаление ее, то результаты оказываются гораздо менее благоприятными. Хотя размеры опухоли не обязательно связаны с уровнем СТГ в крови, вероятность нормализации его содержания в плазме существенно ниже в тех случаях, когда до операции оно превышает 100 нг/мл. Почти у всех больных, у которых удалось добиться умеренного снижения уровня СТГ, наступает ремиссия клинических симптомов и метаболических изменений, характерных для акромегалии. Однако эти показатели не всегда коррелируют со степенью гиперсекреции
СТГ, и у некоторых больных клинические проявления могут полностью исчезать даже при сохранении повышенного уровня СТГ. Таким образом, уровень СТГ в плазме является наиболее объективным критерием оценки эффективности лечения. Рецидив опухоли у больных, у которых удалось нормализовать уровень СТГ, встречается редко (примерно в 5% случаев) и почти всегда на протяжении 1-го года после операции [147, 177, 179]. При более крупных опухолях, когда для нормализации уровня СТГ может потребоваться удаление почти всего аденогипофиза, целесообразно оставлять достаточное количество ткани, чтобы сохранить функцию передней доли гипофиза, а затем применить послеоперационную лучевую терапию.
Лучевая терапия
Для первичного лечения акромегалии в настоящее время применяют две формы наружного облучения. Обычное (супервольтное) облучение, доступное в большинстве крупных медицинских центров, предполагает использование пучка фотонов с энергией 1 МэВ или выше при дозе воздействия на гипофиз 40—50 Дж/кг. Облучение проводят дробными дозами с интервалами 4—6 нед. Самостоятельным методом может служить лечение тяжелыми частицами (протонный пучок), при котором энергия излучения достигает гораздо большей величины (340—900 МэВ), а доза облучения—несколько выше (45—65 Дж/кг). Обычная супервольтная лучевая терапия не требует предварительной пневмоэнцефалографии пли артериографии и реже сопровождается нежелательными побочными эффектами (в плане повреждения внегипофизарных структур), чем облучение тяжелыми частицами. Предполагается, что в первом случае реже развивается и гипопитуитаризм. Облучение тяжелыми частицами не показано при опухолях со значительным супрасселярным распространением, поскольку при этом усиливается опасность повреждения зрительного нерва.
Оба метода дают сравнимые результаты в отношении смягчения клинической симптоматики и снижения уровня СТГ, причем нормальный его уровень через 2 года после облучения наблюдается у 70—80% больных. Отмечалось, что использование протонного облучения дает лучшие результаты через 5—10 лет, но пока число больных, наблюдавшихся на протяжении такого периода, невелико.
Из-за различия групп больных, леченных хирургическим и лучевым методом, прямое сравнение эффективности этих двух методов достаточно, сложно, но общее впечатление таково, что они дают примерно одинаковые результаты. Главное их различие заключается в скорости нормализации уровня СТГ и возможности утраты других гипофизарных функций. Сравнивать частоту рецидивов также весьма трудно, поскольку в настоящее время изменились размеры опухолей, удаляемых хирургическим путем, а срок послеоперационного наблюдения в большинстве случаев стал короче. В качестве способа снижения частоты рецидивов рекомендуется после хирургического удаления СТГ-секретирующих опухолей применять облучение [154]. Эта рекомендация, по-видимому, оправдана в случаях сохранения гиперсекреции СТГ после-операции. У тех же больных, у которых после операции уровень СТГ нормализовался, вероятно, нет необходимости к дополнительной лучевой терапии.
Фармакотерапия
Началом фармакотерапии акромегалии явилось применение гормонов, которые, как предполагалось, противодействуют периферическим эффектам СТГ (эстрогены) или каким-то не полностью понятным образом тормозят секрецию СТГ опухолью (прогестерон). Иногда наблюдалась некоторая регрессия клинических симптомов заболевания, хотя у большинства больных эффект, если и отмечался, то был минимальным. Секрецию СТГ при акромегалии тормозит соматостатин [181], но для этого необходима непрерывная внутривенная инфузия его.
Данные о том, что пероральный прием L-ДОФА остро подавляет секрецию СТГ при акромегалии [163], послужили основой попыток применения этого средства для хронического торможения секреции гормона. Частичного торможения удавалось достигнуть, но кратковременность действия этого вещества и частые побочные
Y Y эффекты применения его в нужных дозах препятствуют широкому распространению этого метода лечения. Однако 2-a-бромэргокрпптин (бромкриптин) — производное эрготалкалоидов с выраженной дофаминергической активностью, изучавшееся первоначально как средство подавления секреции пролактина, обладает при акромегалии мощным снижающим СТГ действием [182]. Хотя бромкриптин может проникать через гематоэнцефалический барьер и проявлять центральную дофаминергическую активность, его действие на секрецию СТГ при акромегалии обусловлено непосредственным воздействием на опухоль, что можно показать in vitro.
Реакция на бромкриптин, выражающаяся в снижении уровня СТГ в плазме до нормы, наблюдается примерно у 80% больных акромегалией [183]. Необходимые дозы колеблются от 2,5 до 15 мг/сут; их вводят в два приема. Иногда отмечают незначительное снижение артериального давления и появление тошноты (вследствие центральных эффектов этого вещества), но со временем эти симптомы, как правило, исчезают и их обычно удается предотвратить, начиная лечение с небольшой дозы вечером и постепенно увеличивая ее до получения нужного эффекта. Опыт длительного применения бромкриптина у нескольких больных показывает, что оп сохраняет эффективность при непрерывном приеме в течение 7 лет. Отмена бромкриптина сопровождается возобновлением гиперсекреции СТГ и поэтому лечение следует продолжать в течение неопределенно длительного времени. Бром криптин уменьшает размеры экспериментально вызванных опухолей у крыс [184], а у человека он обладает не только подавляющей секрецию гормона, но и противоопухолевой активностью [185—188]. Однако пока не будут получены результаты его применения у достаточного числа больных, использование бромкриптина в качестве противоопухолевого средства не должно выходить за рамки эксперимента. Таким образом, лечение бромкриптином показано у больных, у которых операция ц/илп облучение либо не нормализуют уровень СТГ, либо противопоказаны.
Установлено, что уровень СТГ у больных акромегалией остро снижается и под влиянием блокаторов серотониновых рецепторов. Однако терапевтическое значение этих средств пока не известно.
ОПУХОЛИ, СЕКРЕТИРУЮЩИЕ ПРОЛАКТИН: СИНДРОМ АМЕНОРЕИ — ГАЛАКТОРЕИ
Клинические проявления пролактинсекретирующих опухолей были известны задолго до идентификации пролактина в качестве отдельного гормона. Галакторею и аменорею классифицировали вначале по развитию их в послеродовом периоде (синдром Киари— Фроммеля) или вне его (синдром Аумады—Дель Кастильо или Форбса—Олбрайта). Длительное наблюдение за больными обеих этих групп, особенно последней, показало, что у значительного их числа в конце концов появляются признаки опухоли гипофиза. С появлением радиоиммунологического метода определения пролактина было установлено не только высокое содержание этого гормона в циркуляции больных без видимых признаков опухоли гипофиза, но и отсутствие галактореи у значительного числа больных с гипофизарной опухолью и гиперпролактинемией. Действительно, частота повышения уровня пролактина при аденомах гипофиза колеблется от 60 до 80%, что выше, чем для любого другого гипофизарного гормона [123]. В настоящее время все чаще у больных с аменореей, нерегулярностью менструальных циклов или бесплодием находят необъяснимую гиперпролактинемию в отсутствие анатомических признаков опухоли гипофиза (идиопатическая гиперпролактинемия) .
При обычных методах окрашивания пролактинсекретирующие опухоли гипофиза часто выглядят хромофобными, и именно поэтому большинство гипофизарных опухолей ранее считали нефункционирующими. С помощью иммуногистохимического окрашивания почти во всех этих опухолях удается обнаружить пролактин [155].
Признаки и симптомы
У женщин с гиперпролактинемией отмечают галакторею, нарушения менструальной функции или бесплодие. Для развития галактореи, кроме пролактина, необходимы и половые стероиды, и поэтому она не является обязательным признаком гиперпролактинемии. Галакторея часто встречается у лиц, принимающих пероральные контрацептивы, и еще чаще после прекращения их приема. Считается, что появление галактореи определяется острым снижением уровня эстрогена и прогестерона у лиц, молочные железы которых «подготовлены» предыдущим сочетанным воздействием половых стероидов и гиперпролактинемии, что происходит и в физиологических условиях в ближайшем послеродовом периоде. Частота галактореи у больных с пролактинсекретирующими опухолями гипофиза колеблется от 50 до 90% [189—191] и отражает степень гиперпролактинемии, зависящую от сроков распознавания заболевания.
Аменорея или олигоменорея с нарушением цикличности встречаются у 60—90% женщин с гиперпролактинемией и почти у всех женщин, у которых отмечены рентгенологические признаки опухоли гипофиза. Аменорея может предшествовать галакторее и наоборот, причем один симптом опережает другой на месяцы или годы. Гиперпролактинемия могла бы препятствовать нормальному функционированию системы гипоталамус—гипофиз—гонады на трех уровнях. Во-первых, пролактин может подавлять продукцию прогестерона клетками гранулезы в яичнике [192]. Однако яичники у женщин с гиперпролактинемией сохраняют способность реагировать на экзогенный гонадотропин, что свидетельствует об интактности яичниковой функции. Во-вторых, пролактин мог бы действовать в самом гипофизе, тормозя реакцию гонадотропинов на ГнРГ. Это опять-таки маловероятно, ибо, согласно многочисленным наблюдениям, реакция гонадотропинов на ГнРГ у женщин с гиперпролактинемией находится в пределах нормы или усилена [193, 194]. Наконец, гиперпролактинемия может тормозить (и действительно тормозит) ультрациркадную секрецию ЛГ, которая определяется пульсирующим выделением эндогенного ГнРГ [195]. Гиперпролактинемия, угнетает также стимулирующее влияние эстрогенов на секрецию гонадотропинов по механизму положительной обратной связи [196, 197], а возможно, и реакцию по механизму отрицательной обратной связи. Таким образом, наиболее вероятной причиной гипогонадизма при гиперпролактинемии является нарушение секреции ГнРГ гипоталамусом, обусловленное либо самим пролактином, либо теми первичными нейроэндокринными нарушениями, которые вызвали гиперпролактинемию (см. ниже). Помимо отсутствия овуляции, у больных с гиперпролактинемией обычно отмечается гипоэстрогенемия, сопровождающаяся снижением секреции влагалищных желез, что приводит к нарушению супружеских отношений и может обусловливать снижение либидо. У некоторых женщин с гиперпролактинемией отмечается нерезко выраженный гирсутизм, связанный с повышенной продукцией надпочечниками дигидроэпиандростерона сульфата [198].
Главными клиническими проявлениями гиперпролактинемии у мужчин являются импотенция и утрата либидо [199]. В отличие от женщин, у которых симптомы гиперпролактинемии часто отмечаются при едва заметных опухолях гипофиза, у мужчин к моменту обращения к врачу пролактинсекретирующие опухоли обычно достигают достаточно крупных размеров. Уровень тестостерона постоянно снижается, и нарушение у мужчин, как и у женщин локализуется, по-видимому, в гипоталамусе, поскольку функция клеток Лейдига, оцениваемая с помощью введения ХГЧ, равно как и реакция ЛГ и ФСГ гипофиза на ГнРГ остаются в пределах нормы. Отсутствие повышения уровня ЛГ на фоне низкой концентрации тестостерона в таких условиях указывает на нарушение эндогенной секреции ГнРГ, аналогично тому, что наблюдается у женщин. Импотенция определяется не только снижением продукции тестостерона, но отчасти и другими факторами так как заместительная терапия только тестостероном часто оказывается неэффективной в плане восстановления потенции. У некоторых мужчин с гиперпролактинемией наблюдается также олигоспермия [198, 200, 201]. Снижение уровня пролактина до нормы обычно нормализует как либидо, так и число сперматозоидов [201].
Данные лабораторных исследований
Уровень пролактина в плазме у больных с пролактинсекретирующими опухолями варьирует, начиная от цифр, чуть превышающих верхнюю границу нормы (15—20 нг/мл), до 10000 нг/мл и более. Содержание пролактина выше 200 нг/мл почти всегда указывает на опухоль гипофиза. При повторном проведении у одного и того же больного обнаруживают значительные колебания уровня пролактина, свидетельствующие о том, что, как и при акромегалии, опухоль секретирует гормон прерывисто. Часто наблюдается также отсутствие связанного со сном повышения уровня пролактина, но этот вид нарушений не имеет диагностического значения при пролактинсекретирующих опухолях.
При динамическом исследовании секреции пролактина обнаруживают ряд различий у здоровых лиц и больных с опухолями, но обычно невозможно с уверенностью отличить опухоль гипофиза от других причин гиперпролактинемии. Реакция пролактина на ТРГ у больных с пролактинсекретирующими опухолями в процентном отношении снижена по сравнению с нормой, но абсолютные реакции у таких больных могут либо вообще отсутствовать, либо не отличаться от нормы. Объяснение нарушенной реакции (в тех случаях, когда это наблюдается) заключается в том, что опухоль секретирует гормон с максимальной скоростью и не поддается дальнейшей стимуляции, или в том, что мембраны опухолевых клеток утрачивают рецепторы к ТРГ.
Реакция пролактина на хлорпромазин (аминазин) или другие блокаторы дофаминовых рецепторов у больных с опухолями почти всегда отсутствует. Эти вещества действуют как на уровне ЦНС, так и на уровне гипофиза, либо снижая секрецию ПИФ (дофамина?), либо блокируй дофаминовые рецепторы в самом гипофизе.
Отсутствие повышения секреции пролактина свидетельствует либо о том, что опухоль не реагирует на тормозной сигнал, либо о том, что сам этот сигнал снижен или отсутствует. Однако хлорпромазин (аминазин) не влияет на секрецию пролактина и у больных с гипоталамическими нарушениями, и его применение не оказывает помощи в диагностике. L-ДОФА и дофамин у большинства больных с опухолями гипофиза подавляют секрецию пролактина в той же степени, что и у здоровых лиц [193, 202], хотя у некоторых больных секреция его не подавляется [203]. К сожалению, у больных, у которых наиболее четко проявляются нарушения реакций на все три агента, уровень пролактина резко повышен и имеются бесспорные рентгенологические признаки опухоли гипофиза, а у больных с умеренным повышением уровня пролактина (например, менее 100 нг/мл) и нормальными рентгенологическими данными реакции гормона на эти агенты, как правило, не позволяют сделать определенное заключение.

Рис. 7—16. Различное влияние центральной и периферической дофаминергической стимуляции на секрецию пролактина у здоровых людей и больных с пролактинсекретирующими опухолями. Введение одного L-ДОФА в силу центрального и периферического декарбоксилирования приводит к образованию дофамина (ДА), который подавляет секрецию пролактина у здоровых и больных. Предварительное введение карбидофа (периферический ингибитор дофа-декарбоксилазы — ИДД) ограничивает прирост ДА после действия L-ДОФА на ЦНС. Отсутствие подавления секреции пролактина у больных с опухолями свидетельствуют о нарушении опосредованного ДА центрального механизма торможения (Fine S., Frohraan L. A. J. Clin. Invest, 1978, 61, 973 в модификации).
1 — введенние L-ДОФА и ИДД 8 больным с опухолью; 2 — введение L-ДОФА 10 здоровым: 3—введение L-ДОФА и ИДД 10 здоровым: 4 — введение L-ДОФА 8 больным с опухолью.
Непрерывные поиски методов выявления больных с пролактинсекретирующими опухолями привели к разработке других потенциально полезных подходов. Введение L-ДОФА в сочетании с ингибитором дофа-декарбоксилазы (карбидофа) обусловливает торможение декарбоксилирования дофа на периферии и повышенное поглощение L-ДОФА ЦНС. Длительное подавление секреции пролактина под влиянием комбинации этих агентов у здоровых лиц указывает на опосредованное через ЦНС тормозящее действие L-ДОФА. У больных с пролактинсекретирующими опухолями тормозящий эффект этих соединений заметно ослабляется, что свидетельствует о нарушении центрального эффекта L-ДОФА [202] (рис. 7—16). Первые данные, полученные в этом направлении, указывают, однако, на то, что у больных с идиопатической гиперпролактинемией реакции пролактина не отличаются от таковых у больных с опухолями.
Антагонист Н2-рецепторов гистамина циметидин увеличивает у здоровых лиц секрецию пролактина, действуя опосредованно через ЦНС [87, 88а]. Имеющиеся немногочисленные данные свидетельствуют о том, что больные с пролактинсекретирующими опухолями не реагируют на циметидин [88а].
Опубликованы данные о том, что номифензин (ингибитор обратного захвата дофамина синаптосомами) тормозит секрецию пролактина у здоровых женщин и при послеродовой гиперпролактинемии, но лишь у небольшого числа больных с идиопатической гиперпролактинемией или пролактинсекретирующими опухолями [204а, 204b]. Необходим дальнейший опыт применения этого агента, прежде чем можно будет определить степень его полезности для диагностики пролактинсекретирующих опухолей до появления рентгенологических изменений.
Дифференциальный диагноз
Пролактинсекретирующие опухоли присутствуют, вероятно, у большинства больных с хроническим повышением уровня пролактина, у которых это не находит других объяснений. Бесспорный диагноз пролактинсекретирующей опухоли требует выявления не только гиперпролактинемии, но и нейрорентгенологических признаков опухоли, причем последние чаще всего отмечаются у больных с чрезмерным повышением уровня пролактина. У больных, у которых уровень пролактина в крови превышает 200 нг/мл, этот диагноз будет почти наверняка правильным даже при отсутствии изменений на томограммах, а динамические пробы, направленные на определение секреции пролактина, в таких случаях, как правило, будут давать патологические результаты. У больных, у которых уровень пролактина в крови ниже 200 нг/мл, увеличивается необходимость обнаружения нейрорентгенологических изменений для принятия решения в отношении лечения. В литературе часто пользуются терминами «микроаденома» и «макроаденома» по отношению к пролактинсекретирующим опухолям. В общем смысле они отражают клиническую оценку размеров гипофизарной опухоли, основанную на нейрорентгенологических данных, и тем самым легкость постановки диагноза. К сожалению, эти термины неточны, применяются разными авторами для обозначения разных понятий, и их смысл меняется по мере того, как более новые и тонкие нейрорентгенологические методики позволяют обнаруживать все меньшие участки эрозии или деформации турецкого седла. Следует отдавать себе отчет в том, что эти термины применяются для обозначения разных стадий одного и того же процесса.
При отсутствии рентгенологических признаков опухоли гипофиза у больных с гиперпролактинемией необходимо учитывать воз-
Таблица 7—10. Дифференциальный диагноз гиперпролактинемии
I. Пролактинсекретирующая опухоль гипофиза
II. Фармакологические средства
А. Ингибиторы синтеза моноаминов (a-метилдофа)
Б. Средства, снижающие запасы моноаминов (резерпин)
В. Антагонисты дофаминовых рецепторов (фенотиазины, бутирофеноны, тиоксантены)
Г. Ингибиторы захвата моноаминов (трициклические антидепрессанты) Д. Эстрогены (оральные контрацептивы) Е. Наркотики (морфин, героин)
III. Изменения ЦНС
А. Воспалительные/инфильтративные заболевания (саркоидоз, гистиоцитоз)
Б. Травматические (разрыв ножки гипофиза) В. Неопластические (гипоталамические или параселлярные опухоли)
IV. Прочие
А. Гипотиреоз
Б. Недостаточность функции почек
В. Цирроз
Г. Опухоли неэндокринных тканей с эктопической продукцией гормона
Д. Повреждения стенок грудной клетки
Е. Повреждения спинного мозга
V. «Идиопатическая гиперпролактинемия»
можность других причин повышения уровня гормона (табл. 7— 10). При тщательном опросе больного в анамнезе можно обнаружить прием препаратов, способных вызывать гиперпролактинемию. К этим препаратам относятся прежде всего вещества, влияющие на центральную дофаминергическую регуляцию, или эстрогенсодержащие средства. Из таких веществ в настоящее время чаще всего применяют психотропные антагонисты дофаминовых рецепторов (фенотиазины, бутирофеноны, тиоксантены) и трициклические антидепрессанты, гипотензивные средства (a-метилдофа, резерпин), антигистаминные фенотиазины (меклизин) и противорвотные (метоклопрамид, прохлорперазин), а также пероральные контрацептивы. Галакторею наблюдали и у наркоманов, пользующихся героином; она может появиться при стимуляции энкефалиновых рецепторов в ЦНС.
Гиперпролактинемия, обусловленная уменьшением тормозных влияний ЦНС на секрецию пролактина,, может быть результатом и первичных изменений в ЦНС, приводящих к нарушению целостности гипоталамо-гипофизарной оси. Гиперпролактинемия и галакторея наблюдаются иногда вследствие гранулематозных повреждений гипоталамуса при саркоидозе. Эти симптомы обычно поддаются лечению противовоспалительными средствами. Часто сопровождаются гиперпролактинемией инфильтративные нарушения, такие, как эозинофильная гранулема. В таких случаях обычно выявляются и другие признаки дисфункции гипоталамуса, в частности несахарный диабет, который редко встречается при небольших опухолях гипофиза. К гиперпролактинемии вследствие травмы ножки гипофиза могут привести повреждения черепа, связанные с переломами основной кости или проникающими ранениями.
Подобно этому, гиперпролактинемию наряду с признаками гипопитуитаризма могут вызывать параселлярные опухоли (менингиомы, глиомы зрительного нерва, краниофарингиомы) или опухоли, образующиеся внутри гипоталамуса (эпендимомы).
У больных с гипотиреозом часто обнаруживается болезненность молочных желез и иногда галакторея. Хотя обычно уровень пролактина находится в пределах нормы, он может и повышаться. При длительном гипотиреозе может развиться увеличение гипофиза, ошибочно диагностируемое как опухоль этого органа. В отличие от больных с пролактинсекретирующими опухолями при гипотиреозе реакция пролактина на ТРГ повышена.
У 60—70% больных с хронической недостаточностью функции почек уровень пролактина повышается, достигая 150 нг/мл. Реакция пролактина на ТРГ нарушается, но в отличие от того, что наблюдают при опухолях гипофиза, введение дофа и дофамина не приводит к острому снижению уровня гормона, что свидетельствует о дефекте в самих лактотрофах [88а]. Эти сдвиги, равно как и гиперпролактинемия, сохраняются при гемодиализе, но исчезают после пересадки почки.
Повышение уровня пролактина в 2—3 раза наблюдалось при циррозе печени, особенно у больных с печеночной энцефалопатией [205а]; это считают результатом образования ложных нейротрансмиттеров, роль которых подозревается и в других проявлениях заболевания со стороны ЦНС.
Продукцию пролактина наблюдали в раковых опухолях легких и почек [205Ь], хотя эктопическая секреция этого гормона все же весьма редка.
Галакторею и гиперпролактинемию можно зарегистрировать после повреждений спинного мозга и стенок грудной клетки (ожоги, разрезы, опоясывающий лишай), когда в процесс вовлекаются 4—6-й межреберные нервы, стимуляция которых вызывает вне-родовую лактацию [206, 207]. Анестезия межреберных нервов уменьшает уровень пролактина и часто лактацию [207].
При отсутствии всех этих нарушений, а также анамнестических указаний на прием соответствующих лекарственных препаратов больной, у которого повышен уровень пролактина в плазме и отсутствуют изменения в области турецкого седла на томограмме, представляет собой трудную диагностическую проблему. Для описания такого состояния применяют термин «идиопатическая гиперпролактинемия», но разграничить «функциональное» нарушение секреции пролактина и скрытую пролактинсекретирующую опухоль нелегко. Гиперпролактинемия и/или галакторея часто наблюдаются у женщин с сохранностью менструального цикла или с аменореей после прекращения приема пероральных контрацептивов или в течение длительного периода после родов. У некоторых из этих женщин в конце концов появляются анатомические признаки опухоли гипофиза, тогда как у других это состояние сохраняется на протяжении многих лет или восстанавливается нормальная секреция пролактина. Поскольку опухоли гипофиза можно найти у женщин с анамнезом галактореи в течение 20 лет (независимо от нарушений менструального цикла), не исключено, что у большинства больных с идиопатической гиперпролактинемией имеются такие опухоли, но слишком малого размера, чтобы их можно было обнаружить. Результаты динамических исследований секреции пролактина у этих больных, сходные с таковыми у больных с опухолями гипофиза [193, 203], подтверждают такую возможность. Чрезвычайную важность приобретает непрерывное наблюдение за этими больными с периодическими томографией турецкого седла и определением пролактина в плазме.
У больных с галактореей, но нормальным уровнем пролактина, при динамических исследованиях его секреции обычно получают нормальные результаты; вероятность опухоли гипофиза у них мала и можно прогнозировать сохранение овуляторных менструальных циклов и фертильности. У этой группы лиц отмечается, вероятно, наиболее распространенный тип внеродовой галактореи, обусловленной, по-видимому, повышенной чувствительностью молочных желез к нормальному уровню пролактина в плазме. Обычно эта форма галактореи проявляется сохранением послеродовой лактации или возникает после прекращения приема пероральных контрацептивов.
Патогенез пролактинсекретирующих опухолей патология гипоталамуса или гипофиза
Общепринято, что в основе гиперпролактинемии, появляющейся после отмены пероральных контрацептивов или сохраняющейся в течение чрезмерного срока после родов, по всей вероятности, лежит дисфункция ЦНС (гипоталамуса). Идиопатическую гиперпролактинемию также считают результатом нарушения гипоталамо-гипофизарных дофаминергических механизмов [208]. Разногласия существуют по вопросу о том, является ли это нарушение промежуточным состоянием, в конце концов приводящим к образованию аденомы, и локализуется ли дефект дофаминергической системы в гипоталамической тубероинфундибулярной области или на рецепторах лактотрофов (рис. 7—17).
В пользу гипоталамического происхождения свидетельствуют следующие данные: 1 — антагонисты дофаминовых рецепторов (например, аминазин), нарушающие дофаминергическую передачу в ЦНС и повышающие уровень пролактина у здоровых людей, у больных с пролактинсекретирующими опухолями неэффективны, что указывает на отсутствие или уменьшение эндогенного дофаминергического тонуса [127, 203]; 2—нарушение реакции пролактина на ТРГ, характерное для больных с пролактинсекретирующими опухолями, можно воспроизвести и у здоровых лиц путем предварительного введения им антагониста дофаминовых рецепторов (метоклопрамид) [209], что указывает на необходимость дофаминергического тонуса для нормальной реакции пролактина и на другие стимулы; 3 — секреция пролактина опухолью, как правило, может тормозиться инфузией дофамина, который дейст-

Рис. 7—17. Возможные нейроэндокринные нарушения в патогенезе пролактинсекретирующих опухолей гипофиза. а — нормальная регуляция секреции пролактина по принципу обратной связи. которая опосредуется самим пролактином или каким-то пока неизвестным интермедиатом и предполагает стимулирующее влияние на выделение дофамина (ДА) и/или другого пролактинингибирующего фактора (ПИФ) и тормозное влияние на выделение пролактин-рилизинг фактора (ПРФ): б — изменения, которые должны были бы наблюдаться при развитии опухоли гипофиза de novo. Повышенная секреция пролактина должна была бы подавлять выделение ПРФ .и стимулировать выделение ДА—ПИФ, приводя к гипофункции нормальных лактотрофов. Следовательно. опухоль гипофиза, чтобы сохранить гиперсекрецию пролактина, должна обладать определенной резистентностью к тормозным влияниям ДА или ПИФ. Поскольку пролактинсекретирующие опухоли (1) нормально реагируют на экзогенное подавление дофамином, эта модель требует существования особого ПИФ, не являющегося дофамином; в — изменения, которые должны были бы наблюдаться при гипоталамической этиологии заболевания. Предполагается, что первично возникает гиперсекреция ПРФ или снижение секреции ДА—ПИФ, что приводит к гиперплазии лактотрофов и в конце концов к образованию опухоли. Это означает также нарушение тормозного влияния на выделение ПРФ по механизму обратной связи, аналогичное нарушение выделения ДА—ПИФ или относительную резистентность к эффектам ПИФ.
вует непосредственно на гипофиз, или L-ДОФА, который как на периферии, так и в ЦНС превращается в дофамин. Однако если с помощью карбидофа в дозах, не проникающих через гематоэнцефалический барьер, затормозить периферическое декарбоксилирование дофа, то L-ДОФА перестает угнетать секрецию пролактина, хотя у здоровых лиц в аналогичных условиях его тормозной эффект сохраняется; 4 — введение бромкриптина здоровым лицам снижает уровни дофамина, норадреналина и адреналина в крови опосредованно через центрально-нервный механизм, тогда как у больных с пролактинсекретирующими опухолями ни до операции, ни, возможно, после операции (в условиях нормализации уровня пролактина) такого снижения не наблюдается [210]. После операции сохраняется и отсутствие центрального дофаминергического подавления секреции пролактина. Таким образом, хотя гиперпролактинемия вызывает изменения в кругообороте дофамина в гипоталамусе [211], эти наблюдения указывают на то, что нарушения центральной дофаминергической функции в определенной мере не зависят от гиперпролактинемии; 5 — предварительные данные о том, что циметидин стимулирует секрецию пролактина (через центральный механизм) у здоровых лиц, но не у большинства больных с пролактинсекретирующими опухолями [88а], указывают на центральный гистаминергический дефект при этих опухолях; 6—почти у 1/3 больных с пролактинсекретирующими аденомами находят гиперплазию лактотрофов, что подтверждает гипотезу о первичной гиперфункции как причине последующего образования опухоли [212]; 7—опубликованы предварительные данные о присутствии в сыворотке больных с пролактинсекретирующими опухолями пролактин-рилизинг активности [213], которые, если они будут подтверждены, явятся важным доказательством «гипоталамической» гипотезы.
В противовес перечисленным аргументам одна важная группа данных свидетельствует в пользу гипофизарного происхождения заболевания. После успешного удаления микроаденом нормализуется секреция пролактина, восстанавливаются менструальный цикл и фертильность. В связи с этим можно полагать, что ликвидация гиперпролактинемического состояния нормализует вторично нарушенную секрецию гонадотропинов. Однако проведено лить очень немного детальных нейрофармакологических исследований секреции пролактина у оперированных больных с нормальным уровнем этого гормона в плазме, а данные об эффектах блокаторов дофаминовых рецепторов не всегда совпадают [127, 214]. Имеются также ограниченные сведения о частоте рецидивов опухолей и/или гиперпролактинемии у больных, уровень пролактина у которых удалось нормализовать. Сохранение периодичности менструаций, о чем часто сообщают, еще не позволяет ответить на этот вопрос, так как возобновление гиперпролактинемии не всегда сразу вызывает аменорею [215]. Указывалось также, что торможение секреции пролактина агонистом дофамина бромкриптином ликвидирует клиническую симптоматику и тем самым свидетельствует о роли гипофиза в патогенезе процесса. Однако бромкриптин оказывает существенное действие на ЦНС, и роль этих центральных эффектов не может быть исключена.
Хотя в большинстве случаев результаты нейрофармакологических исследований свидетельствуют в пользу гипоталамического генеза пролактинсекретирующих опухолей гипофиза, в настоящее время этот вопрос нельзя считать полностью решенным и для ответа на него необходимы детальные исследования и катамнестические наблюдения за больными, подвергающимися различным видам лечения. Не исключено, что будет показано образование одних пролактинсекретирующих опухолей de novo, а других — вследствие изменений гипоталамических влияний. В этих случаях центральные нарушения, приводящие к гиперпролактинемии, могли бы сохраняться даже после ликвидации гиперпролактинемии и ее последствий с помощью бромкриптина.
Лечение
Лечение пролактинсекретирующих опухолей является предметом значительных разногласий. Отчасти это связано с недавними успехами в области транссфеноидальной микрохирургии и фармакотерапии, но в еще большей степени обусловлено нехваткой информации о естественном течении заболевания. В частности, во-первых, неизвестна частота, с которой у больных с идиопатической гиперпролактинемией болезнь прогрессирует до появления признаков опухоли; во-вторых, неизвестна частота, с которой у больных с гиперпролактинемией и рентгенологическими признаками небольшой опухоли последняя увеличивается в размерах до степени появления признаков супраселлярного роста или нарушения других функций передней доли гипофиза, и, в-третьих, недостаточно сведений о том, может ли сохраняющаяся дисфункция гипоталамуса, если она играет роль в развитии гиперпролактинемии и образовании аденомы, приводить иногда к рецидиву опухоли или лечение, направленное на ЦНС, может обусловить регрессию гиперпролактинемии и роста опухоли.
Пока на эти вопросы нет ответов, современная терапия исходит из следующих положений: сама по себе гиперпролактинемия не приводит к отдаленным последствиям, за исключением бесплодия или профузной галактореи у женщин, что составляет личную или социальную проблему, а также к снижению либидо и потенции у мужчин; при обнаружении опухолей гипофиза их следует удалять или разрушать с помощью облучения, так как без лечения они могут увеличиваться в размерах, вероятность нормализации уровня пролактина после хирургической операции тем меньше, чем больше размер опухоли и предоперационный уровень пролактина, и поэтому откладывание решения об операции увеличивает возможность ее неблагоприятного исхода; значительный процент больных нуждается в фармакотерапии даже после хирургического или лучевого лечения.
Хирургическое вмешательство
В настоящее время наиболее распространенным методом лечения пролактинсекретирующих опухолей является их транссфеноидальное микрохирургическое удаление. Все в большем проценте случаев приходится иметь дело с небольшими, но заметными аденомами, располагающимися в передней доле гипофиза сбоку и снизу. Многие аденомы обладают капсулой и могут быть отделены от окружающей ткани. Некоторые хирурги считают, что аппликация на несколько секунд спирта на ложе опухоли после ее удаления способствует разрушению всех оставшихся опухолевых клеток. В значительном числе случаев, однако, особенно при опухолях, размеры которых превышают 10 мм, опухоль нечетко отграничена от окружающей ткани, содержит некротические или геморрагические участки или имеет кистозную природу. Киста может сообщаться с субарахноидальным пространством и создавать картину частично «пустого» турецкого седла. В таких случаях вероятность нормализации уровня пролактина гораздо меньше, и некоторые хирурги рекомендуют при этих опухолях ипсилатеральную гемигипофизэктомию.
В силу разного состава групп больных и, что более вероятно, различия в методике оперативного вмешательства эффективность хирургической помощи, оцениваемая по нормализации уровня пролактина и спонтанному восстановлению менструаций, широко варьирует. Общепринято, что наиболее высокие результаты получаются при меньших опухолях (с размерами менее 10 мм или при уровне пролактина перед операцией менее 200 нг/мл) [126, 127, 216]. У таких больных эффективность хирургического вмешательства достигает 94% [127], хотя в большинстве случаев она все же несколько ниже. При более крупных опухолях результаты менее благоприятны; хотя снижение уровня пролактина наблюдается обычно в 70—80% случаев, нормализуется он лишь у 20—30% больных. Нередко даже при казалось бы полном удалении опухоли уровень пролактина остается повышенным. Связано это с неполнотой удаления опухоли или ее мультицентрическим ростом, гиперплазией окружающей ткани или измененным кровоснабжением нормальных лактотрофов, трудно определить без длительных катамнестических наблюдений.
При небольших аденомах даже при сохранении послеоперационной гиперпролактинемии облучение после операции обычно не рекомендуют; им пользуются лишь при опухолях, обнаруживающих признаки инвазивного роста или не поддающихся полному удалению.
Лучевая терапия
Первичное лечение пролактинсекретирующих опухолей с помощью внешнего облучения применяется реже, чем хирургическое, и поэтому имеются лишь ограниченные сведения о его влиянии на секрецию пролактина [191]. Тем не менее уровень пролактина в таких случаях снижается, по-видимому, медленнее и в меньшей степени, чем после операции. Рентгенотерапию (с последующей фармакотерапей) вместо операции рекомендуют проводить больным с гиперпролактинемией и минимальными рентгенологическими изменениями турецкого седла, которые желают забеременеть [217]. Основанием для такого лечения служит риск роста опухоли во время беременности у женщин с клиническими признаками пролактинсекретирующей аденомы, которые не получали предшествующего лечения. Однако чтобы окончательно оценить эффективность такого подхода, необходимы длительные катамнестические наблюдения.
Фармакотерапия
Крупным шагом вперед в лечении гиперпролактинемии явилось применение 2-а-бромэргокриптина (бромкриптин) — производного алкалоидов спорыньи, обладающего мощной активностью агониста дофамина в отношении дофаминовых рецепторов мозга и гипофиза [183]. Опыт использования этого вещества, накопленный за последние 7 лет, свидетельствует о его эффективности в плане снижения уровня пролактина примерно на 80—90% почти у всех больных с гиперпролактинемией независимо от ее этиологии. Полная нормализация содержания пролактина наиболее вероятна опять-таки у больных с его исходным уровнем менее 200 нг/мл. Бромкриптин действует непосредственно на лактотрофы, что можно видеть in vitro [84, 219], хотя нельзя исключить и его вторичного действия на ЦНС. Эффект бромкриптина характеризуется быстрым началом (через несколько часов) и малой продолжительностью, так что отмена препарата приводит к восстановлению гиперпролактинемии. Во многих случаях, даже при сохранении несколько повышенного уровня пролактина, уменьшается или исчезает галакторея. Подобно этому восстановление цикличности менструаций и фертильности может произойти и без полной нормализации уровня пролактина.
Большинству больных необходима доза препарата 2,5— 7,5 мг/сут, назначаемая дробно. Лечение начинают с наименьшей дозы, которую постепенно увеличивают до получения нужного эффекта. В некоторых случаях приходится применять 15 мг/сут. К побочным эффектам относятся главным образом тошнота и рвота вследствие раздражения рвотного центра и иногда гипотензия также вследствие влияния бромкриптина на центральные механизмы регуляции артериального давления. У некоторых больных это препятствует применению препарата. Необходимо тщательно подбирать его дозу.
Ко времени написания настоящей книги комиссия по пищевым и лекарственным веществам США одобрила применение бромкриптина только в случае синдрома аменореи—галактореи при отсутствии опухоли гипофиза в течение ограниченного срока (6 мес) и не в качестве средства, повышающего фертильность. Однако большинство больных, принимающих этот препарат, намереваются забеременеть. Из-за недостаточности сведений, которые позволили бы исключить его тератогенный эффект, рекомендуется прекращать прием бромкриптина, как только удастся подтвердить беременность. Главное опасение, появляющееся при лечении бромкриптином для создания возможности забеременеть у женщин с опухолями гипофиза, заключается в том, что при физиологическом увеличении размеров гипофиза в ходе беременности может увеличиваться и размер опухоли, что может сопровождаться супраселлярным ее распространением и появлением симптомов сдавления перекреста зрительных нервов. У больных без исходного увеличения турецкого седла такие осложнения, хотя и встречаются, но относительно редко. Нерезко выраженные нарушения полей зрения, появляющиеся при беременности, у большинства больных успешно лечат консервативным методом, а именно вновь используют прием бромкриптина, хотя у некоторых больных может появиться необходимость в хирургическом вмешательстве.
Опыт применения бромкриптина показал, что он эффективен при лечении больных с сохраняющейся после неполного удаления опухоли гиперпролактинемией, причем это справедливо как для женщин, так и для мужчин [199], у которых сочетание гипофизарных и центральных влияний препарата восстанавливает уровень тестостерона в плазме и потенцию. Бромкриптин эффективен, по-видимому, и у мужчин с идиопатической гиперпролактинемией и импотенцией [220]. Предварительно полученные данные свидетельствуют также о его способности прекращать послеродовую лактацию и облегчать предменструальное напряжение, хотя в этом отношении необходимы дальнейшие клинические наблюдения.
Наиболее важный вопрос заключается в том, обладает ли бромкриптин каким-либо противоопухолевым действием на пролактинсекретирующие аденомы. Несколько недавно опубликованных описаний случаев и комментариев к ним убедительно свидетельствуют о том, что бромкриптин может снижать не только уровень пролактина, но и размеры опухоли [185—188], что показано в отношении агонистов дофамина на модели экспериментальных пролактинсекретирующих опухолей у крыс [184]. Прежде чем можно будет рекомендовать этот вид лечения, необходимо провести тщательно контролируемое исследование, хотя уже в настоящее время следует учитывать такую возможность (порознь или в сочетании с облучением) у больных, которым противопоказано хирургическое удаление опухоли. Бромкриптин эффективен и у женщин, у которых во время беременности произошло супраселлярное распространение опухоли [218].
Антагонисты серотониновых рецепторов также снижают уровень пролактина у больных с гиперпролактинемией, но возможность их применения в качестве лечебных средств не изучена.
ОПУХОЛИ, СЕКРЕТИРУЮЩИЕ АКТГ: БОЛЕЗНЬ КУШИНГА
Первым зависимость двусторонней гиперплазии коры надпочечников и клинических проявлений избыточной продукции кортизона от аденомы гипофиза предположил Кушинг [221]. Небольшие размеры этих опухолей и редкость, с которой их удается выявить к моменту появления у больного признаков и симптомов гиперплазии надпочечников, обусловили концентрацию внимания на коре надпочечников как на месте первичного поражения. Однако современные данные, полученные при транссфеноидальней операции, свидетельствуют о том, что АКТГ-секретирующие опухоли встречаются почти во всех случаях гиперплазии коры надпочечников (болезнь Кушинга). Появление опухолей гипофиза после двусторонней адреналэктомии по поводу болезни Кушинга впервые было описано Nelson и соавт. [222], обнаружившими повышение адренокортикотропной активности в плазме и постулировавших возможность развития АКТГ-секретирующей опухоли вследствие адреналэктомии. В то же время разнообразные нейроэндокринные нарушения, наблюдаемые при болезни Кушинга, а также реакции гипофизарных гормонов на нейрофармакологические средства позволяют предполагать центрально-нервное происхождение этого заболевания.
Опухоли гипофиза при болезни Кушинга и синдроме Нельсона обладают либо базофильными (около 80% случаев), либо хромофобными свойствами. В настоящее время известно, что предшественник АКТГ с молекулярной массой 31000 является гликопротеином и что способность опухолевых клеток окрашиваться основными красителями определяется присутствием в них этого гликопротеина. С помощью иммуногистохимических реакций содержание АКТГ можно обнаружить как в базофильных, так и в хромофобных опухолях. Кроме того, в опухолевой ткани и крови больных с АКТГ-продуцирующими опухолями показано присутствие b-ЛПГ и b-эндорфина [31].
Базофильные аденомы находят в 5—7% гипофизов, полученных при аутопсии умерших, у которых при жизни отсутствовали признаки гиперсекреции АКТГ. Не функционирующие опухоли этого типа могут синтезировать АКТГ, который никогда не поступает в кровь, а подвергается внутриклеточному (лизосомному) разрушению, возможно, из-за дефекта секреторного механизма в клетках опухоли [118]. Секретирующие АКТГ опухоли обычно доброкачественны, однако, в отличие от других опухолей передней доли гипофиза, иногда могут обнаруживать истинно злокачественные свойства, метастазируя как в ЦНС, так и вне ее [223, 224].
Признаки и симптомы
Клинические проявления АКТГ-секретирующих опухолей можно разделить на две группы: связанные с гиперплазией коры надпочечников и повышенной продукцией кортизола и обусловленные вненадпочечниковыми эффектами АКТГ и родственных пептидов. Гиперкортизолемия имеет одни и те же признаки и симптомы независимо от того, обусловлена она гипофизарной или внегипофизарной секрецией АКТГ, аденомами коры надпочечников или введением экзогенного кортизола. К этим признакам относятся в основном перераспределение жира на туловище, гипертония, диабет, аменорея, гирсутизм, угри, остеопороз и компрессионные переломы, мышечная слабость, фиолетового цвета стрии, ломкость капилляров, плохое заживление ран, сниженная устойчивость к инфекциям и поведенческие нарушения.
Повышение секреции АКТГ и, вероятно, b-ЛПГ приводит к усилению пигментации подобно тому, что встречается при аддисоновой болезни. Кожа темнеет на участках, испытывающих давление (коленные, локтевые и межфаланговые суставы, области ношения пояса и бретелек бюстгальтера), и вокруг сосков, в области гениталий и слизистых оболочек, а также в местах образования свежих рубцов. Поскольку секреция АКТГ опухолью не полностью автономна, а частично подавляется при гиперкортизолемии, на ранних стадиях болезни гиперпигментация не достигает значительной степени и становится наиболее выраженной после адреналэктомии, когда уровень АКТГ может резко повыситься. Гиперпигментация является ведущим признаком синдрома Нельсона и внегипофизарных АКТГ-продуцирующих опухолей. Хотя фрагменты АКТГ и эндорфины оказывают выраженное влияние на ЦНС, поведенческие нарушения, наблюдаемые при болезни Кушинга (эйфория, снижение потребности в сне,, а иногда истинные психозы), могут, вероятно, обусловливаться повышенным уровнем кортизола в плазме.
Благодаря более ранней диагностике и лечению частота распространенных симптомов роста самой опухоли гипофиза (головная боль, нарушение зрения, гипопитуитаризм) в настоящее время снижается.
Данные лабораторных исследований
Здесь будут рассмотрены главным образом результаты исследований, применяемых для диагностики АКТГ-секретирующих опухолей, а не для дифференциальной диагностики гиперфункции коры надпочечников. У больных с такими опухолями повышен уровень АКТГ и кортизола в плазме, усилена экскреция с мочой кортизола и метаболитов адренокортикальных стероидов, нарушено влияние кортизола по механизму отрицательной обратной связи и расстроена нейроэндокринная регуляция (в основном периодичность) секреции не только АКТГ, но и гормона роста и пролактина.
Содержание АКТГ в плазме повышено примерно у 50% больных с болезнью Кушинга [24, 225]. Верхняя граница нормы в отношении уровней гормона колеблется от 80 до 100 пг/мл, но в разных лабораториях могут получать неодинаковые цифры. Надежность лабораторного исследования играет важнейшую роль в таких определениях. Суточные колебания уровня АКТГ отсутствуют, и даже при нормальном абсолютном его содержании оно оказывается повышенным по отношению к концентрации кортизола в крови. У большинства больных с болезнью Кушинга повышены утренние показатели содержания кортизола в плазме. Верхняя граница колебаний этих показателей составляет 250 мг/л утром и 150 мг/л вечером. Суточные размахи, наблюдаемые у здоровых лиц, при болезни Кушинга отсутствуют, и поэтому повышение уровня кортизола в плазме чаще наблюдается в вечернее время. Из показателей экскреции с мочой суточная экскреция свободного кортизола наиболее надежно выявляет различия между нормальной и повышенной функцией коры надпочечников [226]. Нормальные значения не достигают 100 мкг/сут. Содержание 17-ОН-кортикостероидов (17-ОКС) — обычно менее информативный показатель, но его также можно использовать. Верхняя граница его нормальных колебаний составляет 10—12 мг/сут в зависимости от метода исследования. Определение 17-кетостероидов (17-КС) мало что дает для диагностики болезни Кушинга, но имеет значение при дифференциальной диагностике синдрома
Кушинга. Хотя исследование суточной мочи имеет преимущество перед исследованием одиночной пробы крови, так как позволяет интегрально оценивать секрецию кортизола, полнота сбора мочи при использовании этого исследования в качестве метода первичного обследования у амбулаторно наблюдаемых больных иногда вызывает сомнения. Чтобы проверить это, следует измерять объем мочи и уровень креатинина в ней.
Наиболее надежным общедоступным показателем, позволяющим разграничить норму, болезнь Кушинга и опухоль надпочечника, служит эффективность отрицательной обратной связи в системе гипоталамус — гипофиз — надпочечники. Основой соответствующего теста является характерное снижение чувствительности секреции АКТГ гипофизарными опухолями к тормозному действию кортизола. При использовании этой пробы в качестве метода первичного обследования дексаметазон в дозе 1 мг вводят в 11 ч вечера, а уровень кортизола в плазме определяют в 8 ч утра следующего дня. При содержании кортизола в плазме менее 50 мкг/л диагноз опухоли гипофиза исключается, тогда как при более высоком уровне его необходимы дальнейшие исследования. Стандартный тест на подавление дексаметазоном [227] предполагает сбор последовательных порций мочи в течение суток до введения дексаметазона и в течение каждых 2 сут его введения в дозе 2 и 8 мг/сут. У здоровых лиц малая доза дексаметазона снижает содержание свободного кортизола в моче до уровня менее 20 мкг/сут, а 17-ОКС — до уровня менее 3 мг/сут. У больных с АКТГ-секретирующими опухолями снижение этих показателей при малой дозе отсутствует, но при большой все еще составляет не менее 50%. Отсутствие снижения при введении даже большой дозы указывает на опухоль надпочечников. Следует подчеркнуть однако, что это правило имеет исключения. У некоторых больных с АКТГ-секретирующими опухолями подавление удается наблюдать лишь при использовании дексаметазона в дозе 32 мг/сут.
Стимуляция оси гипоталамус — гипофиз метопироном обнаруживает при болезни Кушинга повышенную реакцию коры надпочечников, что проявляется повышением чувствительности всей этой системы как к сигналам, опосредованным ЦНС, так и к выключению отрицательной обратной связи. Реакция кортизола на инсулиновую гипогликемию, наоборот, снижается.
В случае появления сомнений в отношении диагноза помощь в разграничении двусторонней гиперплазии надпочечников вследствие АКТГ-секретирующих опухолей и аденом надпочечников может оказать сканирование надпочечников с радиоактивным йодхолестерином. Обычно в этом не возникает необходимости.
У больных с подозрением на АКТГ-продуцирующую опухоль следует производить томографию турецкого седла, хотя необходимо помнить, почти у 40% таких больных при этом вообще могут не обнаруживаться изменения, а у больных, у которых выявляются рентгенологические изменения, локализация опухоли может не соответствовать их местоположению [225].
Дифференциальный диагноз
Примерно у 80% больных с синдромом Кушинга (без учета больных, у которых симптоматика обусловлена введением экзогенных гормонов) последний является следствием АКТГ-секретирующей опухоли гипофиза. Примерно у 15% больных встречается опухоль надпочечников, а у остальных этот синдром связан с продукцией АКТГ эктопической опухолью. Диагноз ставят на основании ускорения секреции кортизола, изменения результатов теста на подавление дексаметазоном, повышения уровня кортизола в плазме и гиперреактивности гипоталамо-гипофизарно-надпочечниковой системы в отсутствие каких бы то ни было признаков другого новообразования и независимо от данных томографии турецкого седла. Диагностика проходит два основных этапа. Первый заключается в дифференциации гиперадренокортицизма от состояний, характеризующихся клиническими признаками этого заболевания, но без нарушения секреции стероидов, а второй — в исключении состояний, при которых гиперадренокортицизм не зависит от патологии гипоталамуса или гипофиза. Одним из состояний, заслуживающих специального рассмотрения, является синдром эктопической продукции АКТГ. Чаще всего эктопическая продукция АКТГ осуществляется мелкоклеточными раками легких, карциноидными опухолями и опухолями островков поджелудочной железы. Заболевание своими клиническими и биологическими особенностями может имитировать зависимую от гипофиза болезнь Кушинга, хотя у больных со злокачественными опухолями часто отсутствует увеличение массы тела и ведущую роль приобретает гипокалиемия. Проба с дексаметазоном обнаруживает различную степень торможения. Некоторые из опухолей секретируют не АКТГ (или не только АКТГ), а КРФ [228], что может объяснить сходство динамических реакций. Удаление опухолей полностью устраняет биохимические и клинические нарушения.
Утрата периодичности секреции кортизола, отсутствие тормозящего эффекта дексаметазона и часто некоторое повышение уровня кортизола в плазме наблюдается при стрессе, в периоды тяжелых переживаний и при эмоциональных расстройствах, особенно депрессивных состояниях. С биохимических позиций может оказаться невозможным отличить таких больных от лиц с АКТГ-секретирующими опухолями, хотя клинические признаки, как правило, отсутствуют.
Генез АКТГ-секретирующих опухолей: патология гипоталамуса или гипофиза
Многие аргументы, изложенные в связи с СТГ- и пролактинсекретирующими опухолями, сохраняют силу и в отношении АКТГ-секретирующих опухолей. Кушинг считал, что это заболевание имеет гипофизарное происхождение, но последующие наблюде-

Рис. 7—18. Возможные нейроэндокринные нарушения в патогенезе АКТГ- секретирующих опухолей (I). а — нормальная регуляция секреции АКТГ по принципу обратной связи которая опосредуется кортизолом и предполагает его тормозящее влияние как на гипофиз так и на гипоталамус (возможно, и на другие участки ЦНС). Влияние на гипоталамус приводит к угнетению секреции кортикотропин-рилизинг фактора (КРФ) а влияние на гипофиз — к угнетению реакции АКТГ на КРФ; б — изменения,- которых следовало бы ожидать в случае развития опухоли гипофиза de novo. Усиление секреции АКТГ и кортизола должно было бы тормозить секрецию КРФ и его действие на опухоль. Следовательно, опухоль гипофиза должна обладать определенной резистентностью к тормозящему действию кортизола, чему имеется множество подтверждений; в — изменения, которых следовало бы ожидать при развитии первичных нарушений гипоталамуса. Повышение секреции КРФ должно было бы вызвать гиперплазию кортикотрофов и в конце концов образование опухоли. Кроме того, это означает нарушение тормозного действия кортизола на секрецию КРФ по механизму отрицательной обратной связи, а также возможную резистентность к тормозящему влиянию кортизола на действие КРФ.
ния указали на возможность первичной локализации процесса в ЦНС (рис. 7-18).
Гипотеза гипоталамического генеза основана на следующих наблюдениях: 1 — на аутопсии у умерших в результате болезни Кушинга выявляются повреждения паравентрикулярных и супраоптических ядер гипоталамуса [229]; есть также сообщения о болезни Кушинга, связанной с опухолями ЦНС и повышенным внутричерепным давлением, симптомы которой исчезали после удаления опухоли; 2 — на аутопсии у умерших в результате болезни Кушинга в 10—25% случаев в гипофизе находят гиперплазию базофилов, а, согласно позднее полученным данным, в 87% гипофизов, удаленных транссфеноидально по поводу болезни Кушинга, имелась диффузная или узелковая гиперплазия кортикотрофов, тогда как опухоли были найдены в 73% случаев [177]. Аналогичные изменения происходят в гипофизе больных с синдромом Нельсона; 3 — сходство симптомов болезни Кушинга (утрата периодичности секреции АКТГ и кортизола и ослабление тормозного влияния глюкокортикоидов) с симптомами, наблюдаемыми при первичных нарушениях в ЦНС, свидетельствует об общности патогенеза обоих состояний, опосредованных повышением секреции КРФ, причем появление аналогичных симптомов при КРФ-продуцирующих опухолях легких подтверждает эту точку зрения; 4 — исследования периодических явлений (секреция СТГ и пролактина и процент времени, занятого медленноволновым сном) также указывают на первичность нарушений в ЦНС. Периодичность секреции пролактина утрачивается при болезни, но не при синдроме Кушинга [230], а отсутствие периодичности секреции СТГ и кортизола и укорочение медленно волнового сна [231], что встречается у больных с активной болезнью Кушинга, исчезают после нормализации уровня кортизола вследствие хирургического лечения только в некоторых случаях; 5 — реакции некоторых больных болезнью Кушинга на нейрофармакологические средства, такие, как блокатор серотониновых рецепторов ципрогептадин [232], который, как показано в опытах на животных, влияет на центральную регуляцию секреции АКТГ, убедительно свидетельствуют в пользу первичной роли ЦНС в патогенезе заболевания.
Главный довод в пользу гипофизарного происхождения болезни Кушинга заключается в том, что избирательная аденомэктомия в процессе транссфеноидальной хирургической операции приводит вначале к недостаточности секреции АКТГ, а затем к восстановлению функции гипоталамо-гипофизарной системы [225, 233, 234]. Нарушение секреции АКТГ считают следствием подавления АКТГ-секретирующей опухолью функции нормальных кортикотрофов подобно тому, что наблюдают после удаления аденомы коры надпочечников. Восстановление не только секреции кортизола, но и нормальной суточной периодичности и чувствительности к подавлению глюкокортикоидами свидетельствует в пользу гипофизарного происхождения болезни. Поскольку глюкокортикоиды могут подавлять секрецию АКТГ не только на уровне центрально-нервных механизмов, но и на уровне гипофиза, нарушение чувствительности к эффектам обратной связи, наблюдаемое при АКТГ-секретирующих опухолях, не противоречит мнению о гипофизарном генезе.
Главным препятствием для решения вопроса служит ограниченность числа больных, леченных разными методами, и относительно небольшая продолжительность катемнестического наблюдения в большинстве случаев. Так остается неизвестной частота рецидива после гипофизарной аденомэктомии. Не исключено также, что существует болезнь Кушинга двух типов, один из которых имеет гипофизарный генез, а другой обусловлен чрезмерной секрецией КРФ. Расхождение результатов хирургического лечения больных разных групп, а также их реакции на фармакотерапию согласуется с представлением о двоякой этиологии заболевания. Ответ на вопрос может дать разработка чувствительного и специфичного метода определения КРФ в крови.
ЛЕЧЕНИЕ
Из всех гиперфункционирующих опухолей гипофиза АКТГ-секретирующие являются наиболее четким показанием для радикального лечения, поскольку они сопровождаются симптомами длительной гиперфункции коры надпочечников. Хотя Кушинг вначале показал эффективность лечения, направленного на гипофиз, но впоследствии основное внимание уделялось надпочечникам. Однако благодаря успехам транссфеноидальных хирургических вмешательств гипофиз вновь занял центральное место в качестве объекта лечения. Одновременное усовершенствование средств фармакотерапии, направленной как на надпочечники, так и на ЦНС, обеспечило врачам возможность выбора. Прежде чем начинать лечение, направленное на надпочечники, гипофиз или ЦНС, необходимо провести тщательное исследование для исключения внегипофизарных АКТГ- или КРФ-секретирующих опухолей, удаление которых может привести к излечению болезни Кушинга.
Хирургическое вмешательство
До недавнего времени чаще всего применяемой методикой была двусторонняя адреналэктомия. Предпринимаемые в прошлом попытки оставлять часть одного надпочечника, чтобы сохранить остаточную функцию коркового слоя, были оставлены из-за частого развития рецидивов заболевания вследствие гиперплазии оставленного фрагмента под действием продолжающейся и усиливающейся секреции АКТГ. Подобно этому попытки трансплантировать надпочечниковую ткань в легко доступные участки тела (например, в предплечье), хотя и были успешными в некоторых случаях [235, 236], но либо удовлетворительная функция трансплантата устанавливалась лишь через несколько лет, либо возникала повторная гиперплазия. После нормализации уровня кортизола с помощью частичной адреналэктомии секреция АКТГ резко увеличивалась из-за уменьшения тормозного эффекта гиперкортизолемии по механизму обратной связи. Со временем примерно у 10% больных проявлялись АКТГ-секретирующие опухоли, характеризующиеся генерализованной гиперпигментацией [224]. Срок между адреналэктомией и появлением опухоли широко варьирует (от 1 года до 16 лет), причем в небольшом проценте случаев опухоль может прорастать окружающие ткани и даже метастазировать [237]. Хотя в качестве меры профилактики при адреналэктомии предлагалось облучать гипофиз, немногочисленные данные свидетельствуют о недостаточной эффективности этого способа [224].
Наиболее рациональным методом в настоящее время является транссфеноидальный подход с аденомэктомией [177, 225, 238]. В отличие от того что наблюдают в отношении других гиперфункционирующих опухолей гипофиза, в данном случае операция показана при установлении диагноза даже у больных с неизмененным на томограмме турецким седлом. Опухоль может иметь крайне малые размеры (2—3 мм) и располагаться в любых участках передней доли гипофиза [225], а не только по средней линии, как отмечалось ранее [146]. Хотя одни хирурги, учитывая частоту мультицентрических очагов гиперплазии, рекомендуют полное удаление передней доли гипофиза [177], большинство из них считают предпочтительной в качестве первой операции простую аденомэктомию. При этом методе эффективность операции, судя по послеоперационному снижению гиперсекреции кортизола, достигает 80—90% [225, 238]. После операции обычно появляются симптомы гипофункции коры надпочечников, требующие применения заместительной глюкокортикоидной терапии; это считают результатом подавления опухолью гипоталамо-гипофизарной оси подобно тому, что наблюдается после удаления аденомы надпочечников. Время, необходимое для восстановления функции этой оси, может достигать 2 лет, а частота рецидивов остается неизвестной. Результаты операции у больных с синдромом Нельсона не столь обнадеживающи; уменьшение гиперпигментации и снижение уровня АКТГ наблюдается лишь в 30% случаев [225].
Лучевая терапия
В качестве основного метода лечения АКТГ-секретирующих опухолей гипофиза можно применить и обычную рентгенотерапию. Эффективность этого метода, согласно недавно полученным результатам обследования большой группы детей с болезнью Кушинга, составляет 80% [239]. Облучение пучком протонов приводит к снижению секреции кортизола у 90% больных и полностью нормализует его уровень примерно у 60% [150, 153]. Применяемые дозы облучения (от 60 до 150 Дж/кг) выше, чем при других опухолях гипофиза. Динамические реакции гипоталамо-гипофизарной оси после облучения изучены недостаточно, хотя частота рецидивов, по-видимому, довольно низка.
Фармакотерапия
Для лечения болезни Кушинга применяются фармакологические средства, действующие либо на биосинтез кортизола в надпочечниках (аминоглютетимид, метопирон, о,pр-DDD или используемое в эксперименте средство трилостан), либо на метаболизм нейротрансмиттеров в ЦНС. Различия в механизме действия, применяемых дозах, эффективности и побочных эффектах ингибиторов синтеза стероидов не описаны в данном разделе. Вначале они применялись как основной способ лечения, направленного на надпочечники, затем—в качестве дополнительного средства при облучении гипофиза, а в настоящее время — как альтернативный метод при противопоказаниях к операции или ее безуспешности, а также для нормализации уровня кортизола перед операцией.
Сочетание облучения с ингибиторами биосинтеза стероидов позволяет быстрее добиться нормализации секреции кортизола, чем применение одного облучения, и обеспечивает особенно обнадеживающие результаты у больных с умеренно выраженной клинической симптоматикой.
Метопирон при отсутствии других видов лечения обладает быстрым эффектом, но иногда вызывает гирсутизм [240], а у некоторых больных наблюдается «феномен ускользания», т. е. при уменьшении действия кортизола по механизму отрицательной обратной связи усиливающаяся секреция АКТГ преодолевает блокаду синтеза стероидов. Метопирон, назначаемый вместе с аминоглютетимидом и дексаметазоном, является эффективным средством подавления секреции кортизола как на короткий, так и на длительный срок [241]. Такое сочетание рекомендовалось для нормализации секреции кортизола до хирургического удаления АКТГ-секретирующей аденомы. Хотя у большинства больных этого, вероятно, не требуется, в некоторых выраженных случаях заболевания предварительная медикаментозная терапия может снижать опасность операции. С другой стороны, о,рp-DDD обладает гораздо более медленным действием и применяется преимущественно для длительного лечения в меньших дозах, чем рекомендуется при раке надпочечников [242].
Большее понимание нейротрансмиттерной регуляции секреции АКТГ обусловило возможность применения ряда нейрофармакологических средств для снижения его секреции за счет изменения центральных механизмов. Использование дофаминергических средств (L-ДОФА и бромкриптина) приводит к получению нечетких результатов [243, 244]; у большинства больных реакция на эти препараты либо незначительна, либо полностью отсутствует. Учитывая многочисленные данные о роли серотонина в опосредовании стимуляции секреции АКТГ (см. главу 6), для лечения болезни Кушинга с обнадеживающими результатами был применен ципрогептадин — блокатор серотониновых рецепторов [232]. При этом наблюдении снижение уровня АКТГ и кортизола в плазме, восстановление скорости секреции кортизола, подавляющего эффекта дексаметазона и суточной периодичности. Одновременно с биохимическими нарушениями наступала ремиссия клинической симптоматики. Суточные дозы составляли 24—32 мг, а побочные эффекты сводились к сонливости и гиперфагии. Устранить последнюю, особенно у детей, может быть трудно. Наибольшая эффективность лечения достигала 50%, причем на фоне лечения у некоторых больных развивались рецидивы, а при отмене препарата это наблюдалось во всех случаях. В настоящее время невозможно предсказать, у кого из больных ципрогептадин окажется эффективным. Положительный эффект этого препарата наблюдался у больных с синдромом Нельсона. Ципрогептадин применялся и в качестве дополнительного средства у больных, получавших лучевую терапию, и способствовал более быстрому наступлению эффекта.
ОПУХОЛИ, СЕКРЕТИРУЮЩИЕ ТИРОТРОПНЫЙ ГОРМОН
ТТГ-секретирующие опухоли гипофиза встречаются весьма редко, и в литературе имеются главным образом описания отдельных случаев, а не данные об их проценте среди гиперфункционирующих опухолей. При гистологическом исследовании они представляют собой обычно хромофобные аденомы, хотя с помощью иммуногистохимических методик в них удается обнаружить присутствие ТТГ. Эти опухоли выявляются, как правило, при обследовании больных с гипертиреозом при повышенном, а не нормальном или сниженном уровне ТТГ в плазме [245, 246]. Клинические проявления складываются из симптомов роста опухолевой массы (что может отсутствовать, если опухоль мала) и симптомов тиреотоксикоза. Описаны также опухоли, состоящие из различных типов клеток гипофиза, которые секретируют не только ТТГ, но одновременно и СТГ или пролактин.
При этих опухолях секреция ТТГ не всегда автономна. Хотя одновременное повышение уровня ТТГ и тироксина свидетельствует об утрате ингибиторного влияния последнего на гипофиз по механизму отрицательной обратной связи, снижение уровня тироксина с помощью метимазола часто сопровождается дальнейшим повышением секреции ТТГ [246], что напоминает ситуацию в отношении АКТГ-секретирующих опухолей гипофиза. Реакция ТТГ на ТРГ варьирует, проявляясь лишь у некоторых больных [247], и в отличие от больных с первичным гипотиреозом, у которых L-ДОФА подавляет секрецию ТТГ, в данном случае описано отсутствие эффекта L-дофа. У больных с ТТГ-секретирующими и «не функционирующими» опухолями наблюдали также повышенный уровень a-субъединицы гликопротеиновых гормонов [248].
Опухоли, секретирующие ТТГ, следует дифференцировать от увеличения турецкого седла и повышения уровня ТТГ вследствие длительного гипотиреоза. Эту группу больных легко можно отличить по субнормальному уровню тироксина и снижающему действию экзогенного тироксина на повышенный уровень ТТГ. Труднее отличить больных с повышенным содержанием ТТГ и гипертиреозом, но без признаков опухоли гипофиза [249, 250]. Считается, что у таких больных имеется не опухоль, а резистентность гипофиза к действию тироксина по механизму обратной связи, хотя возможность существования небольшой, клинически невыявленной, опухоли исключить нельзя.
При выявлении опухоли лечение должно быть направлено на гипофиз. Однако у больных с симптомами тиреотоксикоза важно до операции подавить секрецию тироксина с помощью фармакологических средств, чтобы обеспечить эутиреоидное состояние.
ОПУХОЛИ ГИПОФИЗА, СЕКРЕТИРУЮЩИЕ ГОНАДОТРОПИН
Описано всего несколько случаев ФСГ- или ФСГ- и ЛГ-секретирующих аденом гипофиза [251—254]. Считают, что у некоторых больных увеличение гипофиза и образование опухоли происхо- дит вторично по отношению к длительно существующему гипогонадизму, тогда как у других больных опухоли гипофиза могут быть первичным заболеванием. Реакция ФСГ на введение ГнРГ или кломифена. может либо сохраняться, либо отсутствовать, а тестостерон может либо недостаточно снижать уровень ФСГ, либо вообще не влиять на него. Повышенная секреция ФСГ, как правило, сохраняет клетки Сертоли, но уровень тестостерона обычно снижается, приводя к появлению симптомов гипогонадизма и нарушению сперматогенеза. Описанные опухоли были относительно крупными и после их удаления не удавалось достичь нормализации функции гипофиза и половых желез.
МЕТОДИЧЕСКИЕ ПОДРОБНОСТИ В ОТНОШЕНИИ ОЦЕНКИ СОСТОЯНИЯ ГИПОТАЛАМО-ГИПОФИЗАРНОЙ СИСТЕМЫ
Приводимое далее описание методов исследования не претендует на исчерпывающую полноту, а относится лишь к тем, которые являются, как установлено практикой, наиболее полезными в диагностике нарушений секреции гормонов гипофиза. Показания к их применению и подробная интерпретация результатов изложены в предыдущих разделах.
АДРЕНОКОРТИКОТРОПНЫЙ ГОРМОН
Определение исходного уровня
Определение содержания АКТГ в плазме требует безусловной на- дежности лабораторных исследований. В норме величины колеблются от 20 до 80 пг/мл, хотя их оценка требует одновременно определения уровня кортизола. Определение уровня кортизола в плазме все еще сохраняет свое значение в качестве прекрасного метода оценки секреции АКТГ при исследовании функции гипофиза, если только доказана интактность самой коры надпочечников. Колебания в норме, по данным большинства лабораторий, составляют 50—250 мкг/л. Суточный размах в норме составляет не менее 50 мкг/л. Суточная экскреция 17-ОКС равна 4— 12 мг, а свободного кортизола у здоровых взрослых лиц — 20— 100 мкг.
Стимуляционные пробы
Инсулиновая гипогликемия. Методика. Эту пробу следует проводить в утренние часы после ночного голодания. В локтевую вену больного вводят иглу, заполненную гепаринизированным раствором. Внутривенно вводят обычный инсулин в дозах, достаточных для снижения уровня глюкозы в крови на 50% или не менее чем на 400 мкг/л. Обычно для этого требуется 0, 1 ЕД/кг, хотя при подозрении на инсулинорезистентность (т. е. при ожирении, акромегалии и синдроме Кушинга) дозу увеличивают до 0,15 ЕД/кг, а при сильном подозрении на гипопитуитаризм снижают до 0,05 ЕД/кг. Если появляются признаки и симптомы адренергического возбуждения, гипогликемический стимул можно считать адекватным даже при недостаточном снижении уровня сахара в крови. Если же не произошло ни того, ни другого, тест следует повторить с использованием большей дозы инсулина. На случай неожиданно резкой гипогликемии под рукой всегда должен находиться раствор декстрозы (50%). Уровень глюкозы в крови регистрируют на 0, 15, 30, 45, 60, 90 и 120-й минуте после инъекции инсулина. Концентрацию кортизола в плазме измеряют на 0, 30, 60, 90 и 120-й минуте. По показаниям пробу с инсулиновой гипогликемией можно проводить одновременно с ТРГ- или ГнРГ-тестами.
Неизмененные показатели. Минимальный уровень глюкозы в крови должен регистрироваться на 30—45-й минуте. В норме содержание кортизола повышается по крайней мере на 100 мкг/л и достигает уровня не менее 200 мкг/л.
Интерпретация результатов. Нормальная реакция указывает на интактность гипоталамо-гипофизарно-надпочечниковой системы. Измененная реакция ничего не говорит о месте нарушения этой системы. Для доказательства интактности коры надпочечников следует проводить стимуляционный тест с АКТГ. При исходно высоком уровне кортизола, что часто встречается у больных, находящихся в состоянии стресса, реакция на инсулиновую гипогликемию может снижаться или отсутствовать. Она снижена также у больных, получавших в период пробы или незадолго до нее экзогенные глюкокортикоиды, при синдроме и болезни Кушинга и у больных с депрессивными заболеваниями.
Риск. Пока не истечет срок, в течение которого гипогликемия наиболее выражена, все больные должны находиться под непосредственным наблюдением врача. Пробу не следует проводить у больных с клиническими признаками недостаточности коры надпочечников, а при указании в анамнезе на недостаточность коронарных или мозговых сосудов ее проведение требует крайней осторожности.
Метопирон. Вначале стимуляцию метопироном проводили путем перорального введения препарата со сбором четырех последовательных суточных проб мочи. Эта длительная процедура в основном уступила свое место более быстрому внутривенно проводимому тесту, хотя из-за небольшого спроса метипирон для внутривенного использования в настоящее время мало доступен.
Внутривенно проводимая метопироновая проба. Методика. Метопирон в дозе 35 мг/кг (максимальная доза 1 г) медленно вводят внутривенно в 250—500 мл изотонического раствора хлорида натрия в течение 4 ч больному .натощак. Пробы крови для определения 11-дезоксикортизола (соединение S) и кортизола берут на 2, 4 и 5-м часу.
Неизмененные показатели. О достаточном подавлении биосинтеза гормонов свидетельствует снижение уровня кортизола в плазме ниже 80 мкг/л. Максимальная концентрация 11-дезоксикортизола должна превышать 30 мкг/л.
Интерпретация результатов. Адекватное снижение уровня кортизола в плазме подтверждает снижение эффекта по принципу отрицательной обратной связи. Нормальное повышение уровня 11-дезоксикортизола указывает на способность гипоталамо-гипофизарной оси реагировать на блокаду эффекта стероидов по механизму обратной связи. Измененная реакция ничего не говорит о локализации дефекта. При болезни Кушинга наблюдается усиление реакции, тогда как у больных, получающих экзогенные стероиды или страдающих аденомой коры надпочечников, эта реакция нарушается.
Риск. В процессе проведения пробы не возникает значительных опасностей, поскольку больной находится в положении лежа и получает изотонический раствор хлорида натрия. Пробу нельзя проводить, если больной получает глюкокортикоидную терапию, его не следует применять у больных с первичной недостаточностью коры надпочечников.
Проба с метопироном, вводимом внутрь. Методика. Суточную мочу собирают в течение четырех последовательных дней. Метопирон в дозе 0,75 г назначают через рот каждые 4 ч в 6 порциях, начиная после окончания сбора второй суточной пробы мочи. В каждой пробе определяют содержание 17-ОКС или 17-кетогенных стероидов (17-КГС) и креатинина (для проверки полноты сбора мочи).
Неизмененные показатели. Содержание 17-ОКС или 17-КГС на 3-й или 4-й день должно быть в 2,5—3 раза больше, чем в 1-й или 2-й день. Усиление и ослабление реакции наблюдается в тех же случаях, что и при внутривенном введении препарата.
Риск. Проба, как правило, безопасна. Однако у больных лишь с минимальной остаточной секрецией кортизола независимо от причины в процессе проведения пробы могут возникать легко или умеренно выраженные симптомы недостаточности коры надпочечников, что может потребовать прекращения исследования.
Проба с вазопрессином. Методика. Внутривенно вводят 10 ЕД водного раствора вазопрессина, и пробы плазмы для определения содержания кортизола получают на 0, 30 и 60-й минуте.
Неизмененные показатели. В норме уровень кортизола либо в 2 раза превышает исходный, либо максимальная его концентрация составляет более 250 мкг/л.
Интерпретация результатов. Хотя вазопрессин может непосредственно стимулировать секрецию АКТГ гипофизом, его доза, применяемая в клинике, действует и опосредованно через гипоталамус. Этот тест нельзя использовать для дифференциации гипоталамических и гипофизарных расстройств, хотя вазопрессин стимулирует секрецию АКТГ посредством механизма, отличающегося от такового при действии инсулина и метопирона.
Риск. К побочным эффектам относятся сужение сосудов кожи, иногда боли в животе, тошнота и рвота. Пробу не следует проводить у больных с поражением коронарных артерий.
Пробы на подавление функции гипофиза
Ночная проба с дексаметазоном. Методика. Дексаметазон в дозе 1 мг назначают через рот в 11 ч вечера, а уровень кортизола в плазме определяют в 8 ч утра на следующий день.
Неизмененные показатели. Уровень кортизола в плазме должен составлять 50 мг/л или меньше.
Интерпретация результатов. Этот тест наиболее широко применяется для исключения синдрома Кушинга. Отсутствие снижения уровня кортизола требует проведения стандартного теста с дексаметазоном. В случаях острых заболеваний, в состоянии депрессии или стресса снижения уровня кортизола также отсутствует.
Стандартная проба с дексаметазоном. Методика. Этот тест требует сбора суточной мочи в течение 6 дней. Дексаметазон назначают через рот по 0,5 мг каждые 6 ч на 3-й и 4-й день и по 2 мг каждые 6 ч на 5-й и 6-й день. В каждой пробе мочи определяют 17-ОКС, 17-КГС или (что предпочтительнее) свободный кортизол, а также креатинин для проверки полноты сбора мочи.
Неизмененные показатели. У здоровых лиц экскреция 17-КГС уменьшается, достигая уровня ниже 7 мг/сут, 17-ОКС—ниже 3 мг/сут и свободного кортизола—ниже 20 мкг/сут при введении малой дозы дексаметазона (2 мг/сут).
Интерпретация результатов. Неизмененная реакция исключает диагноз синдрома или болезни Кушинга. При болезни Кушинга малая доза дексаметазона недостаточно снижает экскрецию стероидов, но большая доза снижает ее на 50%. У больных с опухолями коры надпочечников снижения секреции стероидов не наблюдается даже при введении большой дозы дексаметазона. Отсутствие снижения секреции стероидов под действием малой дозы препарата наблюдается также у больных с острым заболеванием, депрессивными реакциями и у находящихся в состоянии острого стресса. Иногда для снижения экскреции стероидов при болезни Кушинга требуются еще большие дозы дексаметазона (до 32 мг/сут). Определение свободного кортизола в моче позволяет четко разграничивать неизмененные и патологические реакции.
ТИРОТРОПНЫЙ ГОРМОН
Определение исходного уровня
Определение уровня ТТГ в плазме позволяет разграничить нормальное и повышенное его содержание и поэтому полезно при дифференциации первичного и вторичного гипотиреоза. Каждая лаборатория должна иметь результаты своих собственных определений нормального уровня ТТГ как в исходном состоянии, так и после стимулирования гипофиза. Верхняя граница колебаний в норме при использовании стандартного препарата сравнения ТТГ (МРС 68/38) достигает 6 мкЕД/мл. Повышение уровня находят иногда у детей с гипоталамическим гипотиреозом. В случае повышения уровня ТТГ, не поддающегося подавлению тиреоидными гормонами, следует учитывать возможность артефакта, обусловленного перекрестно-реагирующими антителами к вводимому ранее бычьему ТТГ. Сниженные показатели невозможно надежно отдифференцировать от нормы.
Стимуляционные пробы
Проба с тиротропин-рилизинг гормоном (ТГР-тест). Методика. Внутривенно вводят 500 мкг ТРГ; пробы крови для определения ТТГ берут на 0, 15, 30, 60 и 120-й минуте после введения ТРГ.
Неизмененные показатели. У женщин и мужчин в возрасте моложе 40 лет уровень ТТГ должен повыситься не менее чем на 6 мкЕД/мл, а у мужчин в возрасте старше 40 лет — не менее чем на 2 мкЕД/мл. Максимальные значения регистрируются на 30-й минуте.
Интерпретация результатов. Даже у здоровых лиц реакция иногда может быть снижена, что затрудняет выделение группы больных с частичной недостаточностью резерва ТТГ. При . первичном гипотиреозе реакция на ТРГ усилена, тогда как при гипертиреозе или у больных, получающих тироксин, трийодтиронин, фармакологические дозы глюкокортикоидов, а также часто при эутиреоидной болезни Грейвса эта реакция отсутствует. При гипоталамическом гипотиреозе реакция ТТГ на ТРГ повышена, а ее пик часто сдвигается к 60-й минуте. Задержка реакции, однако, наблюдается иногда у больных с поражением гипофиза. Нарушение реакции встречается у больных с хронической почечной недостаточностью.
Риск. В процессе проведения пробы не возникает существенных опасностей. Сразу после инъекции ТРГ появляется ощущение тепла, тошноты, странного вкуса во рту и позыв к мочеиспусканию, что продолжается в течение 30—60 с, а затем исчезает.
ЛЮТЕИНИЗИРУЮЩИЙ И ФОЛЛИКУЛОСТИМУЛИРУЮЩИЙ ГОРМОНЫ
Определение исходного уровня
Результаты определения ФСГ и ЛГ варьируют в зависимости от методик и стандартов, используемых в разных лабораториях. Большинство опубликованных значений получено при использовании второго МПС/МГЧ. Уровень ФСГ у женщин составляет приблизительно 4—15 мЕД/мл в фолликулиновую и лютеиновую фазы, 10—50 мЕД/мл в середине цикла и 30—200 мЕД/мл после наступления менопаузы. Уровень ЛГ равен 4—30 ммЕД/мл в фолликулиновую фазу, 30—150 мЕД/мл в середине цикла, 4— 40 мЕД/мл в лютеиновую фазу и более 40 мЕД/мл после наступления менопаузы. У мужчин в возрасте до 60—70 лет уровень этих гормонов аналогичен таковому у женщин в фоликулиновую фазу; позднее он увеличивается. Хотя низкий уровень обычно невозможно отличить от нормального, отсутствие повышения содержания ЛГ или ФСГ у больных с клиническими или биохимическими признаками гипогонадизма указывает на гипофункцию гипоталамуса или гипофиза.
Стимуляционные пробы
Проба с рилизинг-гормоном лютеинизирующего гормона (ЛГ- РГ-или ГнРГ-тест). В настоящее время ГнРГ в США доступен только в качестве средства для исследования.
Методика. Внутривенно вводят 100 мкг ГнРГ; пробы крови для определения ЛГ и ФСГ берут на 0, 15, 30 и 60-й минуте-после введения.
Неизмененные показатели. Показатели неизмененной реакции в разных лабораториях значительно отличаются друг от друга. Как правило, за норму принимают повышение уровня ФСГ более чем на 12 мМЕД/мл, а ЛГ более чем на 3 мМЕД/мл у женщин и ФСГ более чем на 8 мМЕД/мл, а ЛГ более чем на 3 мМЕД/мл у мужчин. У женщин реакция ЛГ зависит от стадии менструального цикла, причем максимальная реакция наблюдается в середине его. Максимальные значения ЛГ регистрируются в течение первых 30 мин, но в отношении ФСГ у некоторых лиц. эти значения могут наблюдаться позднее.
Интерпретация результатов. У больных с гипопитуитаризмом реакции на ГнРГ могут быть в пределах нормы,. снижены или даже полностью отсутствовать, причем это справедливо и в отношении больных с гипоталамическими расстройствами. Если неизмененная реакция позволяет исключить гипофизарную этиологию гипогонадизма, то сниженная реакция или ее отсутствие ничего не говорит об анатомической локализации нарушения. Тем не менее результаты теста отражают функциональную способность гонадотрофов; если функция гипофиза в других отношениях не нарушена, то сниженная реакция указывает на отсутствие воздействия эндогенного ГнРГ. Дефицит эстрогенов обычно снижает реакцию ЛГ в большей степени, нежели реакцию ФСГ, обусловливая извращение отношения реакций ФСГ/ЛГ. У женщин с вторичной аменореей гипоталамического происхождения (например, при нервной анорексии) реакция ФСГ может быть усиленной.
Проба с кломифеном. Кломифена цитрат (синтетический стероид со слабой эстрогенной активностью) связывается с рецепторами эстрогенов в гипоталамусе, где он проявляет антиэстрогенные свойства, и у взрослых лиц стимулирует секрецию ГнРГ, а затем и ЛГ и ФСГ. У детей препубертатного возраста, у которых эстрогены отсутствуют, кломифен в низких дозах подавляет секрецию гонадотропинов. В раннем пубертатном периоде отмечается резистентность к препарату, а начиная с середины до конца пубертатного периода, он стимулирует секрецию гонадотропинов, как и у взрослых.
Методика проведения теста у женщин. Ежедневно в течение 5 дней (начиная с 5-го дня менструального цикла, если он сохранен) дают через рот по 100 мг кломифена. Пробы крови для определения ЛГ и ФСГ берут в 0, 5, 7, 10 и 13-й день.
Методика проведения теста у мужчин. В течение 1—4 нед дают по 100 мг кломифена в день. Пробы крови для определения ЛГ и ФСГ берут дважды в неделю.
Неизмененные показатели. У женщин уровень ФСГ и ЛГ должен повышаться и достигать на 5-й день приема максимального значения, обычно превышающего колебания в норме. После приема последней дозы уровень гонадотропинов должен снижаться, вслед за чем наступает вторичное повышение уровня ЛГ (между 9-м и 14-м днем). У мужчин в течение недели содержание ЛГ удваивается, причем в дальнейшем оно еще больше увеличивается. Уровень ФСГ повышается параллельно, но в меньшей степени.
Интерпретация результатов. Нормальное повышение уровня гонадотропинов свидетельствует о сохранности гипоталамической реакции на блокаду тормозного действия эстрогенов по принципу отрицательной обратной связи. Отсутствие реакции в сочетании с нормальной реакцией на ГнРГ указывает на гипоталамическое происхождение дефицита гонадотропинов. При снижении реакции на ГнРГ результаты теста с кломифеном обычно отличаются от нормы и не позволяют разграничить гипоталамические и гипофизарные расстройства. При нервной анорексии и гиперпролактинемии реакции" на кломифен, как правило, отсутствуют.
ГОРМОН РОСТА
Определение исходного уровня
Иногда достаточно однократного определения уровня СТГ, чтобы доказать адекватность его секреции у больных с подозрением на дефицит СТГ или исключить диагноз акромегалии. В первом случае пробы крови берут один или несколько раз. У детей особенно показательным является уровень СТГ в крови, полученной через 90 мин после наступления сна. Значения 6 нг/мл или выше исключают недостаточность СТГ. У больных с подозрением на акромегалию также можно взять пробу однократно без предварительной подготовки или предпочтительно через 2 ч после еды. Значения меньше 5 нг/мл у женщин или меньше 2 нг/мл у мужчин позволяют исключить диагноз активного заболевания.
Стимуляпионные пробы
Все существующие стимуляционные пробы предполагают интактность гипоталамо-гипофизарной оси и поэтому не позволяют идентифицировать анатомическую локализацию нарушения. Повышение исходного уровня СТГ обусловливает снижение или отсутствие его реакции почти на все стимулы. Однако с диагностической точки зрения повышение исходных значений на любой стимул достаточно для исключения дефицита СТГ. Отсутствие или снижение реакции на любой из стимулов довольно часто наблюдается и у здоровых лиц, так что необходимо доказать снижение реакции по меньшей мере на два стимула, чтобы подтвердить диагноз дефицита СТГ.
Инсулинотолерантная проба. У здоровых лиц гипогликемия стимулирует секрецию СТГ; этот тест наиболее часто используется для оценки резервов СТГ.
Методика. Методические подробности, включающие дозу, критерии адекватности гипогликемии и сроки отбора проб крови, описаны в разделе, посвященном методикам оценки секреции АКТГ. Уровень СТГ определяют на 0, 30, 60, 90 и 120-й минуте.
Неизмененные показатели. За норму принимают повышение уровня СТГ до 9 нг/мл или выше, что происходит обычно на 60—90-й минуте. У женщин реакция выше, чем у мужчин, но это различие не имеет диагностического значения.
Интерпретация результатов. Нормальная реакция исключает дефицит СТГ. Однако снижение или отсутствие реакции наблюдается почти у 20% здоровых лиц. Это часто наблюдается при повышении исходного уровня СТГ. Снижение или отсутствие реакции наблюдают также при ожирении, депрессии, гипотиреозе, гипертиреозе, синдроме Кушинга (в том числе ятрогенном), хронической почечной недостаточности и нередко при акромегалии.
Риск. См. раздел, посвященный АКТГ.
Проба с L-ДОФА. L-ДОФА стимулирует секрецию СТГ, усиливая дофаминергическую передачу в ЦНС, что в свою очередь, как полагают, повышает секрецию СТГ-рилизинг фактора. Этот тест часто проводят в качестве второго метода оценки резервов СТГ.
Методика. L-ДОФА в дозе 0,5 г дают через рот натощак в состоянии покоя, а пробы крови для определения СТГ берут на О, 60, 90,120, 150 и 180-й минуте.
Неизмененные показатели. Обычная реакция предполагает повышение уровня СТГ до 6 нг/мл или выше обычно между 90-й и 150-й минутой Снижение или отсутствие реакции чаще наблюдается в условиях повышения исходного уровня гормона.
Интерпретация результатов. Обычная реакция исключает дефицит СТГ, но наблюдается лишь у 65—75% здоровых лиц, особенно в пожилом возрасте. Снижение или отсутствие реакции встречается при ожирении, гипотиреозе и у больных, получающих a-метилдофа и нейролептики. У большинства больных акромегалией уровень СТГ после приема L-ДОФА снижается благодаря его непосредственному дофаминергическому действию на опухолевоизмененные соматотрофы.
Риск. К основным побочным эффектам L-ДОФА относятся тошнота и рвота, которые обусловливаются стимуляцией дофамин-чувствительного механизма в ЦНС. Эти осложнения наблюдаются у 20—25% обследуемых, обычно на 2-м часу теста и, несмотря на малую интенсивность, часто вызывают умеренный дискомфорт. Обычно эти симптомы исчезают самопроизвольно, но их можно купировать введением антагониста дофаминовых рецепторов (например, 5 мг перфеназина) после завершения пробы.
Проба с инфузией аргинина. L-Аргинин стимулирует секрецию СТГ каким-то, опосредованным ЦНС, механизмом.
Методика. L-Аргинина гидрохлорид в дозе 0,5 г/кг (максимально 30 г) вводят в течение 30 мин внутривенно натощак в состоянии покоя. Пробы крови для определения СТГ берут на О, 30, 60, 90 и 120-й минуте.
Неизмененные показатели. Обычная реакция заключается в повышении уровня СТГ не менее чем до 9 нг/мл, что наблюдается, как правило, на 60—90-й минуте. У женщин реакция выше, чем у мужчин.
Интерпретация результатов. Обычная реакция наблюдается у 65—75% здоровых лиц. Реакция снижена или отсутствует при ожирении и гипотиреозе, а при акромегалии варьирует и не имеет диагностического значения.
Риск. В процессе проведения теста практически не возникает каких-либо опасностей, однако у больных с тяжелой печеночной или почечной недостаточностью его проводить не следует.
ТРГ-проба. Методика. Дозы и сроки отбора проб крови описаны в разделе, посвященном ТТГ.
Неизмененные показатели. У здоровых лиц ТРГ не стимулирует секрецию СТГ.
Интерпретация результатов. У 80—90 % больных акромегалией наблюдается резкое повышение уровня СТГ, достигающее пика на 15—30-й минуте; наряду с тестом подавления глюкозой эта проба наиболее полезна при обследовании больных с минимальным повышением исходного уровня СТГ. Резко выраженная реакция встречается также у больных с хронической почечной недостаточностью. При голодании, белковокалорической недостаточности питания, нервной анорексии и циррозе печени в отличие от акромегалии реакция запаздывает и достигает пика часто на 45—60-й минуте.
Пробы на подавление секреции СТГ
Проба с введением глюкозы. Этот тест основан на подавлении секреции СТГ, которое происходит в норме в ответ на гипергликемию.
Методика. Проводят стандартный глюкозотолерантный тест (75 г частично гидролизованных углеводов или 100 г глюкозы внутрь); пробы крови для определения СТГ берут до приема глюкозы, а также через 0,5, 1, 2 и 3 ч после приема. Чтобы выявить «феномен отдачи» СТГ часто полезно брать дополнительные пробы крови на 4-м и 5-м часу.
Неизмененные показатели. У здоровых лиц в течение 2 ч уровень СТГ должен снизиться до уровня ниже 2 нг/мл. На 4-м и 5-м часу часто наблюдается «феномен отдачи» и уровень СТГ превышает 7 нг/мл.
Интерпретация результатов. Этот тест используют при обследовании больных с подозрением на активную акромегалию. У больных акромегалией наблюдается отсутствие подавления секреции гормона, недостаточное подавление или даже парадоксальная стимуляция ее; обычное подавление секреции исключает акромегалию. У больных с нервной анорексией на фоне повышенного уровня СТГ глюкоза может лишь частично подавлять его секрецию. Однако через определенный период нормального питания реакция на глюкозу восстанавливается.
ПРОЛАКТИН
Определение исходного уровня
Результаты определения уровня пролактина в плазме в разных лабораториях неодинаковы, что связано с использованием разных методов и стандартов для сравнения. При использовании наиболее очищенного из стандартов (NIH-VLS-2) верхняя граница нормы у мужчин составляет 15 нг/мл, а у женщин — 15—20 нг/мл. У детей содержание пролактина примерно такое же, хотя у новорожденных на протяжении нескольких первых недель жизни оно может достигать 150 нг/мл. Для исключения гиперпролактинемии при скрининге, проводимом с помощью однократных определений, могут потребоваться повторные исследования, так как иногда наблюдается прерывистое усиление секреции гормона. Пролактин в плазме определяется у всех здоровых лиц, хотя в некоторых случаях его содержание близко к границе чувствительности метода определения. Дифференцировать норму и гипопитуитаризм, как правило, невозможно.
Стимуляционные пробы
Стимулы, вызывающие секрецию пролактина, можно разделить на влияющие на гипофиз непосредственно и требующие участия гипоталамуса. Разные реакции на эти стимулы могут способствовать разграничению гипофизарных и гипоталамических расстройств.
ТРГ-проба. ТРГ стимулирует секрецию пролактина путем не посредственно действия на лактотрофы с помощью механизма, связанного с активацией аденилатциклазы.
Методика. Дозы и сроки отбора проб крови указаны в разделе, посвященном ТТГ.
Неизмененные показатели. У здоровых лиц содержание пролактина не менее чем в 3 раза превышает исходный уровень, причем пик (более 20 нг/мл) регистрируется на 15-й или 30-й минуте. У женщин реакция выше, чем у мужчин.
Интерпретация результатов. Снижение или отсутствие реакции у больных с низким исходным уровнем пролактина указывает на недостаточность резервов гормона и свидетельствует о первичной гипофизарной патологии. Снижение или отсутствие реакции у больных с гиперпролактинемией, по мнению некоторых авторов, указывает на пролактинсекретирующую опухоль. Однако сниженная реакция наблюдается также при гиперпролактинемии, вызываемой лекарственными средствами, при хронической почечной недостаточности и у больных с идиопатической гиперпролактинемией. Кроме того, у некоторых больных с опухолями гипофиза реакция на ТРГ остается в пределах нормы. Таким образом, результаты, полученные при проведении этого теста, не позволяют с какой бы то ни было определенностью дифференцировать больных с пролактинсекретирующими опухолями и больных с другими формами гиперпролактинемии. Хлорпромазиновая (аминазиновая) проба. Секреция пролактина под действием хлорпромазина (аминазина) и других нейролептиков усиливается вследствие блокады дофаминергических рецепторов в ЦНС и гипофизе. Максимальный высвобождающий пролактин эффект наблюдается при использовании доз этих препаратов, которые гораздо ниже применяемых для лечения поведенческих расстройств.
Методика. Хлорпромазин (аминазин) вводят внутримышечно в дозе 25 мг. Пробы крови для определения пролактина берут на 0, 30, 60, 90 и 120-й минуте.
Неизмененные показатели. Уровень пролактина должен по крайней мере в 2—3 раза превысить исходный, причем пик реакции регистрируется на 60—90-й минуте.
Интерпретация результатов. Этот тест был предложен для того, чтобы дифференцировать гипоталамические нарушения от гипофизарных. Однако поскольку дофаминергические рецепторы присутствуют и на самих лактотрофах, эффект антагонистов рецепторов дофамина определяется отчасти прямым их действием на гипофиз. Снижение или отсутствие реакции на хлорпромазин (аминазин) регистрируется не только при гипоталамических нарушениях, но почти у всех больных с пролактинсекретирующими опухолями; поэтому информативность данного теста весьма ограничена.
Риск. Умеренно часто наблюдаются сонливость и гипотензия, но они обычно нерезко выражены и кратковременны. Аналогичное повышение уровня пролактина можно воспроизвести с помощью двух других блокаторов дофаминовых рецепторов — сульпирида (100 мг внутримышечно) или метоклопрамида (10 мг внутрь или внутривенно), которые не вызывают таких нарушений. В настоящее время, однако, эти вещества применяются лишь в исследовательских целях.
Инсулиновая гипогликемия. Механизм, с помощью которого инсулиновая гипогликемия стимулирует секрецию пролактина, неизвестен. Уровень пролактина определяют в те же временные интервалы, что и уровень СТГ. Обычная реакция заключается в повышении уровня гормона на 10 нг/мл или более и наблюдается у 70% здоровых лиц. Снижение или отсутствие реакции наблюдается у больных с опухолями гипофиза и гипопитуитаризмом, но этот тест не имеет дифференциально-диагностического значения.
Пробы на подавление секреции пролактина
В настоящее время подавить секрецию пролактина можно только путем стимуляции дофаминергических рецепторов. Этого можно достичь введением либо самого дофамина, либо его агонистов. Наиболее широко применяемым средством является предшественник дофамина L-ДОФА.
Тест с L-ДОФА. Методика. Дозы и сроки отбора проб крови указаны в разделе, посвященном СТГ.
Неизмененные показатели. У здоровых лиц на 2-м и 3-м часу уровень пролактина снижается не менее чем на 50%.
Интерпретация результатов. Подавление секреции пролактина наблюдается у большинства больных с гиперпролактинемией. У некоторых больных с пролактинсекретирующими опухолями подавление секреции оказывается недостаточным, но при удлинении срока исследования обычно удается наблюдать нормальные подавления ее. Таким образом, тест с L-ДОФА, подобно другим тестам, не позволяет выделить больных с пролактинсекретирующими опухолями. Аналогичное подавление секреции пролактина наблюдают при инфузии дофамина (4 мкг/кг в 1 мин внутривенно) или при приеме бромкриптина (2,5 мг через рот). У больных с хронической почечной недостаточностью ни L-ДОФА, ни дофамин, ни бромкриптин не приводят к резкому снижению уровня пролактина.
Риск. См. раздел, посвященный СТГ.


